воспаление. Виды воспаления. Этиология 117. Определение понятия воспаление
 Скачать 92.8 Kb. Скачать 92.8 Kb.
|
  Виды воспаления. Этиология Виды воспаления. Этиология§ 117. Определение понятия «воспаление» Воспаление — местная реакция кровеносных сосудов, соединительной ткани и нервной системы на повреждение.При воспалении возникают три группы процессов:
Развитие воспаления тесно связано с реактивностью организма как целого. Пониженная реактивность вызывает замедление и ослабление развития воспаления. Например, у стариков, у людей с пониженным питанием, при авитаминозах воспаление развивается очень медленно, а некоторые признаки его отсутствуют. С другой стороны, воспаление оказывает влияние на состояние реактивности всего организма. Более или менее обширное воспаление вызывает у человека лихорадку, лейкоцитоз и другие изменения реактивности целого организма. § 118. Сравнительная патология воспаления Сравнительная патология воспаления разработана великим русским ученым И. И. Мечниковым. Воспаление встречается в различных формах у всех представителей животного мира. Усложнение организации животного сопровождается усложнением воспалительной реакции. Как и другие патологические процессы, воспаление эволюционирует с эволюцией животных видов. У животных, лишенных кровеносных сосудов (губки, кишечнополостные, иглокожие), воспаление выражается в скоплении амебоидных соединительнотканных клеток (амебоциты) вокруг места повреждения. И. И. Мечников вводил шип розы в прозрачный колокол медузы и наблюдал скопление амебоцитов вокруг поврежденного участка ткани. Эта реакция и представляла собой воспаление У высших беспозвоночных (ракообразные, насекомые), имеющих кровеносную систему открытого типа, воспаление также выражается в скоплении кровяных клеток— лимфогематоцитов — в месте повреждения. Изменения кровообращения в воспаленной ткани, характерные для позвоночных животных и человека, у беспозвоночных не возникают. Развитие кровеносной системы и ее нервной регуляции у позвоночных животных и у человека значительно усложнило воспалительную реакцию. Расстройства кровообращения в воспаленной ткани являются важнейшими выражениями воспаления. Кроме того, существенное значение в развитии воспаления приобрела нервная система. Участие кровяных клеток в воспалении у высших животных и у человека проявляется выходом лейкоцитов в воспаленную ткань. Кроме того, наблюдается размножение местных соединительнотканных клеток (гистиоцитов, фибробластов) в очаге воспаленной ткани. § 119. Основные признаки воспаления у человека Внешние проявления воспаления на коже и слизистых оболочках у человека были описаны еще в древности (Гиппократ, Цельс, Гален). Цельс писал: «Верные признаки воспаления суть: краснота (rubor) и опухоль (tumor) с жаром (calor) и болью (dolor)». Гален добавил к этому определению воспаления пятый признак — «нарушение функций» (functio laesa). Развитие воспаления во внутренних органах не всегда сопровождается указанными признаками. Однако в разных сочетаниях они часто встречаются при воспалении и до настоящего времени считаются классическими признаками воспалительной реакции. Обозначать воспаление в том или ином органе или ткани принято путем прибавления окончания «itis» к латинскому названию этой ткани или органа. Например, воспаление нерва называют neuritis, воспаление мышцы — miositis, воспаление почки — nephritis, воспаление печени — hepatitis и т. д. Воспаление легких называется пневмонией (от греч. pneuma — воздух), воспаление подкожной клетчатки — флегмоной (от греч. phlegmone — воспаление) и пр. § 120. Этиология воспалительных процессов Воспаление вызывается самыми различными повреждающими агентами:
ВоспалениеПатологическая физиология Под. ред. А. Д. Адо и Л. М. Ишимовой М.: Медицина, 1980 Патогенез воспаления§ 121. Роль повреждения ткани в развитии воспаленияАльтерация ткани при воспалении сопровождается рядом изменений ее структуры, функции и обмена веществ. Распространение повреждения на субклеточные структуры — митохондрии, которые являются основными носителями окислительно-восстановительных ферментов, существенно понижает окислительные процессы в воспаленной ткани. Количество кислорода, поглощаемого в воспаленных тканях, обычно меньше чем в здоровых, неповрежденных тканях. Вследствие нарушения активности ферментов цикла Кребса в воспаленной ткани увеличивается содержание пировиноградной, альфа-кетоглютаровой, яблочной, янтарной и других кислот. Образование СО2 уменьшается, дыхательный коэффициент понижается. Снижение окислительных процессов в воспаленной ткани выражается также в снижении ее окислительно-восстановительного потенциала. Выделяемая при дыхании воспаленной ткани углекислота связывается буферными системами экссудата в меньшем количестве, чем в крови, вследствие истощения буферных систем экссудата за счет связывания указанных органических кислот. Повреждение других субклеточных структур в воспаленной ткани — лизосом — сопровождается освобождением большого количества гидролитических ферментов (катепсинов), ферментов гликолиза и липолиза. Источником этих ферментов являются лизосомы нейтрофилов крови, микрофагов и паренхиматозных клеток той ткани, где происходит воспаление. Следствием активации процессов протеолиза, гликолиза и липолиза является образование и освобождение большого количества органических кислот цикла Кребса, жирных кислот, молочной кислоты, полипептидов и аминокислот. Следствием этих процессов является увеличение осмотического давления — гиперосмия. Увеличение осмотического давления происходит в связи с распадом крупных молекул на большое количество мелких. Накопление указанных кислых продуктов приводит к увеличению концентрации водородных ионов в воспаленной ткани — Н+ — гиперионии и ацидозу (рис. 13). 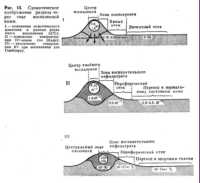 Разрушение клеток сопровождается накоплением в воспаленной ткани ионов калия, натрия, хлора, анионов фосфорной кислоты и др. Разрушение клеток сопровождается накоплением в воспаленной ткани ионов калия, натрия, хлора, анионов фосфорной кислоты и др.§ 122. Боль и жар при воспаленииРаздражение чувствительных нервных окончаний в воспаленной ткани осмотически активными веществами, кислотами, полипептидами (брадикинин), гистамином, ионами калия вызывает характерный признак воспаления — боль. Имеет значение также повышение возбудимости рецепторов в воспаленной ткани под влиянием ионов водорода и калия. Расширение артериол и возникновение капиллярного пульса в воспаленной ткани (см. ниже) вызывают механическое раздражение чувствительных нервных окончаний в очаге воспаления. Это приводит к характерным пульсирующим болям, хорошо известным при пульпите, панариции и других острых гнойных воспалениях. Одним из важных признаков воспаления является «жар» — гипертермия, т. е. повышение температуры в воспаленной ткани. В механизме этого явления участвуют следующие процессы. Если воспаление развивается на поверхности тела (например, на коже), активная гиперемия способствует быстрому поступлению более теплой артериальной крови в область тела с относительно низкой температурой (25—30°С) и вызывает ее нагревание. Именно эту форму повышения температуры в воспаленной ткани наблюдали древние врачи, когда описывали «жар» как признак воспаления. Повышение температуры в воспаленной ткани наблюдается, однако, и в глубоколежащих внутренних органах, имеющих в норме высокую температуру. В этих случаях повышение температуры вызывается освобождением тепла в результате повышения обмена веществ. § 123. Расстройства кровообращения и микроциркуляции в воспаленной тканиРасстройство кровообращения в воспаленной ткани можно наблюдать под микроскопом на прозрачных тканях экспериментальных животных. Классическими объектами являются препараты языка или брыжейки лягушки, брыжейки крысы и морской свинки. Используют также ткани мочевого пузыря и плавательной перепонки лягушки. Подробное описание расстройств кровообращения в этих тканях при воспалении было сделано Конгеймом и известно в истории изучения воспаления как «опыт Конгейма». Он заключается в следующем: язык или брыжейку лягушки растягивают на пробковом кольце вокруг отверстия на препаровальной доске, которую устанавливают под микроскопом. Фактором, вызывающим воспаление, является часто уже само приготовление препарата. Повреждение ткани можно вызвать также, положив на нее кристаллик поваренной соли. Под малым увеличением легко наблюдать процесс расширения артериол, капилляров и венул, маятникообразные движения крови и стаз. Под большим увеличением отмечаются процессы прилипания лейкоцитов к стенке кровеносных сосудов и эмиграции их в воспаленную ткань (рис. 14). В настоящее время для изучения расстройств микроциркуляции при 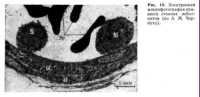 воспалении у теплокровных животных вживляют прозрачные пластинки в серозные полости, используют методы микроскопии терминальных сосудов защечного мешка хомячка, мигательной перепонки глаза кролика и пр. Широко используются микросъемки, инъекции сосудов коллоидными и флюоресцирующими красками. Широко применяются методы введения меченных изотопами белков и других веществ. воспалении у теплокровных животных вживляют прозрачные пластинки в серозные полости, используют методы микроскопии терминальных сосудов защечного мешка хомячка, мигательной перепонки глаза кролика и пр. Широко используются микросъемки, инъекции сосудов коллоидными и флюоресцирующими красками. Широко применяются методы введения меченных изотопами белков и других веществ.Расстройства кровообращения в воспаленной ткани развиваются в виде следующих четырех стадий:
Перечисленные стадии и наблюдаемые при них элементы различных нарушений кровообращения и микроциркуляции в воспаленной ткани не всегда проявляются в типичной форме и в указанной последовательности. Например, при остром воспалении от легкого ожога расстройство кровообращения ограничивается признаками артериальной гиперемии. Сильный ожог кислотой может сразу привести к картине полного стаза. При хроническом воспалении, например при некоторых видах экземы, в ткани часто наблюдаются явления застойной гиперемии и отека, воспаленная ткань синюшна. В настоящее время есть основания считать, что расстройства микроциркуляции при воспалении качественно отличаются от таковых при артериальной или венозной гиперемиях невоспалительного происхождения. Эти отличия позволяют выделить воспалительную гиперемию как специальный вид нарушений микроциркуляции (А. Д. Адо, Г. И. Мчедлишвили). Особенности воспалительной гиперемии по сравнению с другими формами полнокровия представлены в табл. 15.
Кратковременное сужение артериол при воспалении вызывается раздражением сосудосуживающих нервов и гладкомышечных клеток артериол повреждающими агентами, которые вызывают воспаление. Сужение артериол является кратковременным потому, что первичное раздражающее действие быстро проходит. Медиатор симпатической иннервации артериол — норадреналин — разрушается моноаминоксидазой, количество которой увеличивается в воспаленной ткани. Далее развивается расширение артериол, капилляров и венул, сопровождающееся ускорением тока крови — артериальная гиперемия. Стадия артериальной гиперемии характеризуется:
Расширение артериол и возникающая при этом артериальная гиперемия вокруг воспаленного очага хорошо заметны на коже в виде красной каймы, окружающей очаг воспаления (например, воспаление волосяного мешочка на коже — фурункул). Расширение артериол при воспалении возникает, по-видимому, по типу аксон-рефлекса (рис. 15). Продукты повреждения ткани (Н+-ионы, ионы К+, гистамин, пептиды) 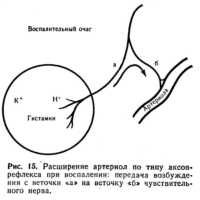 раздражают чувствительные нервные окончания в воспаленной ткани. Возбуждение распространяется антидромным путем, достигая окончаний сосудорасширительных нервов артериол. Расширение артериол вокруг воспалительного очага создает характерное покраснение — коллатеральную гиперемию. раздражают чувствительные нервные окончания в воспаленной ткани. Возбуждение распространяется антидромным путем, достигая окончаний сосудорасширительных нервов артериол. Расширение артериол вокруг воспалительного очага создает характерное покраснение — коллатеральную гиперемию.Следует учитывать, что диаметр капилляров и венул в очаге воспаления увеличивается гораздо больше, чем при артериальной гиперемии невоспалительного происхождения. Характерно, что нередко эти сосуды расширяются неравномерно: на их протяжении появляются варикозные выпячивания, которые способствуют краевому стоянию лейкоцитов в венулах, предшествующему их эмиграции в ткань. Увеличивается объемная скорость тока крови. Несмотря на увеличение объемной скорости тока крови линейная скорость в части капилляров увеличивается не всегда, а в некоторых капиллярах даже уменьшается. Известно, что линейная скорость кровотока V зависит от объемной скорости Q и суммарной площади поперечного сечения капиллярного русла S - V=Q/S. При воспалении увеличивается как Q, так и S, но S растет больше, чем Q, и в результате этого уменьшается V. Причиной же очень значительного увеличения S при воспалении является резкое увеличение количества функционирующих капилляров, а также их значительное расширение. Вследствие расширения артериол и усиления притока крови давление крови в капиллярах и венах воспаленной ткани увеличивается. Застой крови возникает по мере нарастания воспалительного процесса, когда затрудняется отток крови в венозную систему. Существует несколько факторов, способствующих появлению признаков застоя крови в ходе развития воспаления. Факторы эти следующие. Внутрисосудистые факторы:
К внесосудистым факторамотносится выхождение жидкой части крови в воспаленную ткань (экссудация), которая создает условия для сдавления стенок вен и лимфатических сосудов и также способствует затруднению оттока крови из воспаленной ткани по венам и лимфатическим сосудам. Кроме того, в механизме венозного застоя большое значение имеет разрушение (деструкция) мелких и мельчайших (эластических, коллагеновых) соединительнотканных волокон и волоконец, окружающих стенки капилляров и венул. Система соединительнотканных волокон удерживается в здоровой ткани специальными ультраструктурными укрепляющими образованиями, называемыми десмосомами, которые доступны наблюдению только с помощью электронного микроскопа. Повреждение ткани при воспалении разрушает (расплавляет) этот соединительнотканный скелет вокруг капилляров и мельчайших вен, стенки которых растягиваются кровяным давлением. На значение деструкции соединительнотканного скелета вокруг капилляров в механизме их расширения при воспалении указывал еще В. В. Воронин (1897). Стаз— местная остановка кровотока в микроциркуляторном русле, чаще всего в капиллярах. Изменения кровотока во время развития стаза заключаются в следующем:
Перед остановкой кровообращения в сосудах воспаленной ткани могут возникать своеобразные, синхронные с ритмом сердечных сокращений изменения направления токов крови. Они называются маятникообразными движениями крови: в момент систолы кровь движется в капиллярах воспаленной ткани в обычном направлении — от артерий к венам, а в момент диастолы направление крови становится обратным — от вен к артериям. Механизм маятникообразных движений крови в воспаленной ткани состоит в том, что во время систолы пульсовая волна проскакивает через расширенные артериолы и создает картину, известную под названием капиллярного пульса. В момент диастолы кровь встречает препятствия к оттоку по венозной системе и отливает обратно вследствие падения кровяного давления в капиллярах и артериолах во время диастолы. От маятникообразных движений крови в воспаленной ткани следует отличать передвижения крови из одной сосудистой территории в другую под влиянием прорыва тромбов, открытия или закрытия просвета капилляров вследствие их сдавления, регионарного расширения, закупорки агломерированными форменными элементами и других факторов перераспределения крови внутри сосудисто-капиллярной сети воспаленной ткани. Эти перемещения масс крови из одной сосудистой территории в другую в очаге воспаления чаще возникают в стадии застоя крови и наблюдаются в виде потоков крови по капиллярам, не синхронных с сердечными сокращениями, как при маятникообразных движениях. Повреждение капилляров и венул в начале воспалительного процесса вызывает раннюю реакцию тромбоцитов крови, которые прилипают и скапливаются в местах повреждения. Этот процесс, с одной стороны, является защитным, так как «заклеивает» дефектную структуру эндотелиальной стенки, с другой стороны, он является вредным, так как организует в дальнейшем развитие прилипания и выхождение лейкоцитов в воспаленную ткань, т. е. организует воспаление как вредную для организма патологическую реакцию. Этот диалектически противоположный процесс «защитного» и патологического продолжается далее во всех стадиях развития воспаления. В настоящее время получены данные о том, что при повреждении эндотелия капилляров и вен освобождается вещество (медиатор), которое увеличивает «клейкость» внутренней поверхности эндотелия по отношению к тромбоцитам и лейкоцитам. Этот процесс способствует возникновению «краевого стояния» лейкоцитов при воспалении. Природа этого медиатора пока не определена. Возможно, что оно относится к кининам (пептидам). § 124. Медиаторы воспаленияМедиаторами воспаления называют биологически активные вещества, которые обнаруживаются в крови в форме предшественников (глобулины) и в очаге воспаленной ткани. В последней они образуются как продукты ее распада. Кроме того, они появляются в воспаленной ткани как специфические, специально синтезируемые в клетках вещества (гистамин, ацетилхолин и др.). Медиаторы воспаления можно разделить на 3 группы: Медиаторы белковой природы.
В воспаленной ткани обнаружены и другие белки с ферментативными свойствами, например некрозин — фермент типа трипсина, вызывающий повреждение и некроз ткани. Полипептиды. Полипептиды постоянно встречаются в экссудатах. Менкин назвал полипептиды воспаленной ткани лейкотаксинами. Они вызывают эмиграцию лейкоцитов и увеличивают проницаемость сосудов. Среди них наибольшее значение имеет брадикинин, в образовании которого участвует фермент калликреин. Последний образуется из калликреиногена в крови и тканях. Под влиянием калликреина, активированного фактором Хагемана (XII — фактор свертывания крови), из α2-глобулина образуются полипептиды каллидин и брадикинин. Процесс этот заключается в том, что из α2-глобулина сначала образуется полипептид из 10 аминокислот, называемый каллидином. После отщепления от него под влиянием аминопептидазы аминокислоты лизина образуется брадикинин. Последний является медиатором, расширяющим артериолы и капилляры. Пептиды раздражают чувствительные нервные окончания и вызывают боль при воспалении. Биогенные амины.
Другие медиаторы.
ВоспалениеПатологическая физиология Под. ред. А. Д. Адо и Л. М. Ишимовой М.: Медицина, 1980 Отек и эксудация при воспалении§ 125. Воспалительный отекВокруг очага воспаления нередко развивается отек; между эндотелиальными клетками образуются просветы, куда входят вода и белки. Примером воспалительного отека является отек мягких тканей лица при воспалении тканей зубной лунки и пульпы зуба (флюс). В механизме воспалительного отека важную роль играет увеличение проницаемости кровеносных капилляров под влиянием гистамина, брадикинина и других биологически активных веществ. Вопрос о механизмах проницаемости мелких и мельчайших кровеносных сосудов (капилляров и венул) для плазмы крови и ее форменных элементов при воспалении получил сейчас новые решения в свете электронно-микроскопических исследований (Чернух А. М., 1976). Выяснилось, что строение капилляров как в норме, так и при воспалении неоднородно. Различают по крайней мере три типа структуры капилляров и мелких вен:
В разных органах преобладают капилляры разных типов. Например, в скелетных мышцах, в коже — первый тип, во внутренних органах — второй тип, в селезенке, в лимфоузлах — третий тип. В зависимости от функционального состояния органа и в особенности при патологии один тип может переходить в другой, например сплошной в пористый (кожа и другие ткани). Таким образом, структура эндотелиальной стенки не стабильна, подвижна. Образование в ней пор и щелей представляет собой обратимый процесс. В ходе развития воспаления гистамин и другие медиаторы вызывают сокращение актомиозиновых нитей эндотелиальных клеток, сокращение этих клеток раздвигает межэндотелиальные щели, вызывает образование фенестров и пор. Другие медиаторы (кинины, брадикинин) вызывают образование в эндотелиальных клетках пузырьков (везикул) различной величины, а также отека под эндотелием, способствующего образованию щелей и пор. Все эти процессы участвуют также в активации процессов экссудации при воспалении. Важно подчеркнуть, что процесс образования везикул, вероятно, энергозависимый процесс, в механизме которого важную роль играют системы аденилциклазы, гуанилциклазы, холинэстеразы и других ферментов клеточных мембран. По имеющимся данным, это влияние на проницаемость реализуется при участии макроэргических соединений (АТФ). Так, выключение с помощью цианидов тканевого дыхания, в ходе которого синтезируется АТФ, ослабляет действие медиаторов проницаемости. Большую роль в механизме воспалительного отека играет затруднение оттока крови и лимфы из очага воспаленной ткани. Задержка оттока крови и лимфы вызывает выход плазмы крови и лимфы в ткань и развитие отека. Воспалительный отек имеет некоторое защитное значение. Белки отечной жидкости связывают токсические вещества воспаленной ткани, нейтрализуют токсические продукты распада тканей при воспалении. Это задерживает поступление указанных выше веществ из очага воспаления в общую циркуляцию и предупреждает распространение их по организму. § 126. Экссудация и экссудатыВыход жидкой части крови в воспаленную ткань называется экссудацией, а вышедшая в ткань жидкость — экссудатом.Увеличение объема воспаленной ткани вследствие выхода в нее плазмы крови и лейкоцитов называютвоспалительным отекомили воспалительной опухолью. Экссудаты представляют собой патологические жидкости воспалительного происхождения, нередко инфицированные различными микробами. Эти жидкости могут быть прозрачными, опалесцирующими, окрашенными кровью. Гнойные экссудаты часто имеют желто-зеленую окраску. В зависимости от вида экссудата в нем содержится большее или меньшее количество клеток — лейкоцитов, эритроцитов, эндотелиальных клеток и различных продуктов их повреждения. Экссудаты следует отличать от отечной и водяночной жидкостей (транссудаты). Ближе всего к транссудату серозный экссудат, однако и он отличается оттранссудата по удельному весу, белковому, клеточному составу и рН (табл. 16).
Выход жидкой части крови в воспаленную ткань, или экссудация, представляет собой сложный процесс. Процесс этот определяется прежде всего увеличением кровяного (фильтрационного) давления в венозной части капилляроввоспаленной ткани. Другим фактором, обусловливающим образование экссудата, является повышение проницаемости капиллярной стенки. Электронно-микроскопические исследования показали, что фильтрация воды и растворенных в ней белков плазмы крови через клетки эндотелия происходит через мельчайшие ходы (поры) (рис. 16). В настоящее время различают два вида пор в эндотелии капилляров: 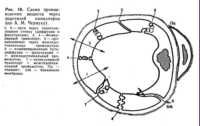 1. Относительно крупные поры в протоплазме эндотелия в виде вакуолей, образующихся по ходу прохождения через стенку капилляра коллоидных красок, белков, липидов. 2. Мелкие поры (9 нм и меньше) в местах соединений эндотелиальных клеток друг с другом или в местах микроканалов в их протоплазме (А. М. Чернух). Через эти поры могут проходить нейтрофильные лейкоциты во время эмиграции. Они иногда возникают и исчезают в зависимости от изменений фильтрационного давления и различных «факторов проницаемости»: α1, α2-глобулинов, гистамина, брадикинина и др. Увеличение фильтрационного гидростатического кровяного давления в капиллярах и венулах воспаленной ткани вызывает также расширение межэндотелиальных щелей, размеры которых составляют от 8 до 10 нм (см. рис. 16). Проницаемость капилляров при воспалении, по мнению некоторых исследователей, увеличивается также вследствие округления эндотелиальных клеток и растягивания межклеточных щелей. Кроме фильтрации белков плазмы через ультрамикроскопические каналы, экссудация совершается также с помощью активных процессов захватывания и проведения через эндотелиальную стенку мельчайших капель плазмы крови. Процесс этот носит название везикуляции, ультрапиноцитоза, или цитопемпсиса (от греч. pempsis — проведение). В мельчайших пузырьках — везикулах протоплазмы эндотелиальной клетки находятся ферменты (5-нуклеотидаза и др.), что свидетельствует о наличии активного транспортного механизма плазмы крови в воспаленной ткани. Экссудацию с этой точки зрения можно рассматривать как своеобразный микросекреторный процесс. Различные повреждающие агенты, например бактериальные токсины, в зависимости от их природы и концентрации влияют на экссудацию. В зависимости от характера этого влияния в воспаленную ткань поступают белки плазмы крови (фибриноген, глобулины, альбумины) в различных комбинациях и количествах. Поэтому белковый состав различных видов экссудата существенно отличается (см. § 129). Некоторое значение в механизме образования белкового состава экссудатов имеют также процессы резорбции белков, вышедших в воспаленную ткань из кровеносных сосудов. Так, относительно большая резорбция альбуминов в лимфатические сосуды может способствовать увеличению содержания в экссудате глобулинов. Эти механизмы не имеют существенного значения, так как лимфатические сосуды в воспаленной ткани уже в ранних стадиях развития воспаления блокируются осадками выпавшего фибрина, глобулинов, конгломератами лимфоцитов и пр. Наконец, третьим фактором экссудации являетсяувеличение осмотического и онкотического давления в очаге воспаления, создающее диффузионные и осмотические токи жидкости в воспаленную ткань. § 127. Выход лейкоцитов в воспаленную ткань (эмиграция лейкоцитов)Выход лейкоцитов в воспаленную ткань начинается в стадии артериальной гиперемии и достигает максимума в стадии венозной гиперемии. Известно, что с наружной стороны эндотелиальная клетка граничит с базальной мембраной толщиной 40—60 нм. В условиях нормального капиллярного кровообращения поверхность эндотелия покрыта тончайшей пленкой «цемент-фибрина», к которой примыкает неподвижный слой плазмы, а с ним уже граничит подвижный слой плазмы. Цемент-фибрин состоит из:
Различают три периода выхода лейкоцитов в воспаленную ткань:
Процесс краевого стояния длится от нескольких минут до получаса и больше. Выход лейкоцита через эндотелиальную клетку происходит также в течение нескольких минут. Движение лейкоцитов в воспаленной ткани продолжается много часов и суток. Краевое стояние, как показывает название, заключается в том, что нейтрофильные лейкоциты располагаются у внутреннего края эндотелиальной стенки (рис. 17). 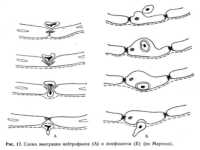 При нормальном кровообращении они не соприкасаются с пленкой фибрина, покрывающей эндотелиальные клетки изнутри. При нормальном кровообращении они не соприкасаются с пленкой фибрина, покрывающей эндотелиальные клетки изнутри.При повреждении капилляров в воспаленной ткани в их просвете появляется клейкое вещество в виде нежелатинированного фибрина. Нити этого фибрина могут перекидываться через просвет капилляра от одной его стенки к другой. При замедлении кровообращения в капиллярах воспаленной ткани лейкоциты соприкасаются с фибринной пленкой и удерживаются её нитями некоторое время. Первые секунды соприкосновения лейкоцита с фибринной пленкой еще позволяют ему как бы перекатываться по этой поверхности. Следующим фактором удержания лейкоцитов у внутренней поверхности эндотелиальной стенки, по-видимому, являются электростатические силы. Поверхностный заряд (дзета-потенциал) лейкоцитов и эндотелиальной клетки имеет отрицательный знак. Однако в ходе эмиграции лейкоцит теряет свой отрицательный заряд — как бы разряжается, по-видимому, за счет действия на него ионов кальция и других положительных ионов. В механизме прилипания лейкоцитов к эндотелиальной стенке, возможно, участвуют также процессы прямой химической связи через ионы Са++. Эти ионы вступают в соединение с карбоксильными группами поверхности лейкоцита и эндотелиальной клетки и образуют так называемые кальциевые мостики. Находясь у внутренней поверхности эндотелиальной стенки, нейтрофильный лейкоцит выпускает тонкие плазматические отростки, которые протискиваются в межэндотелиальные щели, пробуравливают базальную мембрану капилляра и выходят за пределы кровеносного сосуда в воспаленную ткань. § 128. ХемотаксисПроцесс направленного движения лейкоцитов в воспаленную ткань называется положительным хемотаксисом. Вещества, привлекающие лейкоциты, разделяются на две группы: 1) цитотаксины и 2) цитотаксигены. Цитотаксины1 — это вещества, обладающие свойством привлекать лейкоциты непосредственно. Цитотаксигены — сами по себе не вызывают хемотаксиса, но способствуют превращению веществ, не обладающих способностью стимулировать хемотаксис, в цитотаксины. Разные виды лейкоцитов (нейтрофилы, моноциты, эозинофилы и др.) привлекаются различными цитотаксинами. Для нейтрофилов цитотаксинами являются, например, компоненты комплемента (СЗа, С5а, и др.), калликреин, денатурированные белки и др. Цитотаксическими свойствами обладают бактериальные токсины, казеин, пептон и другие вещества. Цитотаксигенами для нейтрофилов являются трипсин, плазмин, коллагеназа, комплексы антиген — антитело, крахмал, гликоген, бактериальные токсины и др. Торможение хемотаксиса вызывают гидрокортизон, простагландины E1 и Е2, цАМФ, колхицин. Для макрофагов цитотаксинами являются С5а-компонент комплемента, белковые фракции фильтратов культур бактерий (Str. pneumoniae, Corynebacteria) и др. Цитотаксигенами для макрофагов являются лизосомальные фракции лейкоцитов, протеиназы макрофагов, липополисахариды микробов кишечной группы, микобактерии и др. Для эозинофилов цитотаксинами являются эозинофильный фактор хемотаксиса при анафилаксии (см. § 90), продукты повреждения лимфоцитов — лимфокины и др. Цитотаксигенами для эозинофилов являются различные иммунные комплексы, продукты агрегации иммуноглобулинов IgG и IgM. Впервые на роль положительного химиотаксиса в механизме эмиграции указал И. И. Мечников. Сущность хемотаксиса лейкоцитов заключается в активации микротубулярного аппарата их протоплазмы, а также в сокращении актомиозиновых нитей псевдоподий лейкоцита. Процесс хемотаксиса требует участия ионов Са++ и Mg++. Ионы кальция потенцируют действие ионов магния. Хемотаксис сопровождается увеличением поглощения кислорода лейкоцитами. Следует заметить, что прохождению лейкоцита через эндотелиальные щели в определенной степени содействуют токи жидкости экссудата, которые также частично проходят в этом месте. Вслед за нейтрофилами в воспаленную ткань выходят моноциты и лимфоциты. Эту последовательность эмиграции различных видов лейкоцитов в воспаленную ткань описал И. И. Мечников; ее называют законом эмиграции лейкоцитов Мечникова. Более поздний выход мононуклеарных клеток объясняли их меньшей чувствительностью к химиотаксическим раздражениям. В настоящее время электронно-микроскопические исследования показали, что механизм эмиграции мононуклеаров отличается от такового у нейтрофилов. Мононуклеары внедряются в тело эндотелиальной клетки. Вокруг мононуклеаров образуется большая вакуоль; находясь в ней, они проходят через протоплазму эндотелия и выходят по другую его сторону, разрывая базальную мембрану. Процесс этот напоминает своеобразный фагоцитоз, в котором большую активность проявляет поглощаемый объект. Кроме того моноциты могут проходить между эндотелиальными клетками подобно нейтрофилам. Процесс прохождения мононуклеарных клеток через эндотелий более медленный, чем прохождение нейтрофилов через щели между эндотелиальными клетками. Поэтому они появляются в воспаленной ткани позже и выражают собой как бы второй этап, или вторую очередь лейкоцитов, выходящих в воспаленную ткань (см. рис. 17). § 129. Виды экссудатовВ зависимости от причин, вызывающих воспаление, и особенностей развития воспалительного процесса различают следующие виды экссудатов:
Соответственно наблюдается серозное, фибринозное, гнойное и геморрагическое воспаление. Встречаются и комбинированные виды воспаления: серо-фибринозное, фибринозно-гнойное, гнойно-геморрагическое. Любой экссудат после его заражения гнилостными микробами называется гнилостным. Поэтому выделение такого экссудата в самостоятельную рубрику вряд ли целесообразно. Экссудаты, содержащие большое количество жировых капелек (хилус), называются хилезными, или хилоидными. Следует заметить, что поступление жировых капелек возможно в экссудат любого указанного выше типа. Оно может быть вызвано локализацией воспалительного процесса в местах скопления крупных лимфатических сосудов в брюшной полости и другими побочными влияниями. Поэтому выделять хилезный тип экссудата как самостоятельный также вряд ли целесообразно. Примером серозного экссудата при воспалении является содержимое пузыря от ожога на коже (ожог II степени). Примером фибринозного экссудата или воспаления служат фибринозные налеты в зеве или гортани при дифтерии. Фибринозный экссудат образуется в толстом кишечнике при дизентерии, в альвеолах легких при крупозном воспалении. Серозный экссудат. Его свойства и механизмы образования приведены в § 126 и табл. 16. Фибринозный экссудат. Особенностью химического состава фибринозного экссудата является выход фибриногена и выпадение его в виде фибрина в воспаленной ткани. В дальнейшем выпавший фибрин растворяется за счет активации фибринолитических процессов. Источниками фибринолизина (плазмина) служат как плазма крови, так и сама воспаленная ткань. Увеличение фибринолитической активности плазмы крови в период фибринолизиса при крупозной пневмонии, например, легко видеть, определяя эту активность в экссудате искусственного волдыря, созданного на коже больного. Таким образом, процесс развития фибринозного экссудата в легком как бы отражается в любом другом месте организма больного, где возникает в той или иной форме воспалительный процесс. Геморрагический экссудатобразуется при бурно развивающемся воспалении с выраженным повреждением сосудистой стенки, когда в воспаленную ткань выходят эритроциты. Геморрагический экссудат наблюдается в оспенных пустулах при так называемой черной оспе. Он возникает при сибиреязвенном карбункуле, при аллергических воспалениях (феномен Артюса) и других остро развивающихся и бурно протекающих воспалительных процессах. Гнойный экссудати гнойное воспаление вызываются гноеродными микробами (стрепто-стафилококками и другими патогенными микробами). Гнойный экссудат отличается от других видов экссудата очень большим содержанием клеток, главным образом лейкоцитов. В зависимости от вида агента, вызвавшего гнойное воспаление, клеточный состав гноя различен. При остром гнойном воспалении, вызываемом гноеродными микробами, в гнойном экссудате преобладают нейтрофилы. В случаях нагноения, вызываемого животными паразитами (глистные инвазии), в экссудате относительно много эозинофилов. При хроническом нагноении, вызываемом туберкулезной микобактерией, бледной спирохетой, в гнойном экссудате обычно много лимфоцитов. Если нагноение связано с опухолевым процессом, в гнойном экссудате содержатся опухолевые клетки, эритроциты. В ходе развития гнойного воспаления гнойный экссудат поступает в воспаленную ткань и лейкоциты пропитывают, инфильтрируют ее, располагаясь в большом количестве вокруг кровеносных сосудов и между собственными клетками воспаленных тканей. Воспаленная ткань в это время обычно плотна на ощупь. Клиницисты определяют эту стадию развития гнойного воспаления как стадию гнойной инфильтрации. Источником ферментов, вызывающих разрушение (расплавление) воспаленной ткани, являются лейкоциты и клетки, поврежденные в ходе воспалительного процесса. Особенно богаты гидролитическими ферментами зернистые лейкоциты (нейтрофилы). В гранулах нейтрофилов содержатся протеазы, катепсин, химотрипсин, щелочная фосфатаза и другие ферменты. При разрушении лейкоцитов, их гранул (лизосом) ферменты выходят в ткань и вызывают разрушение ее белковых, белково-липоидных и других составных частей. Под влиянием ферментов воспаленная ткань становится мягкой, и клиницисты определяют эту стадию как стадию гнойного расплавления, или гнойного размягчения. Типичным и хорошо заметным выражением этих стадий развития гнойного воспаления является воспаление околоволосяного мешочка кожи (фурункул) или слияние многих фурункулов в один воспалительный очаг — карбункул и острое разлитое гнойное воспаление подкожной клетчатки — флегмона. Гнойное воспаление не считается завершенным, «созревшим», пока не произойдет гнойное расплавление ткани. В результате гнойного расплавления тканей образуется продукт этого расплавления — гной. Гнойобычно представляет собой густую сливкообразную жидкость желто-зеленого цвета, сладковатого вкуса, имеющую специфический запах. При центрифугировании гной разделяется на две части:
Клетки гноя называют гнойными тельцами. Они представляют собой лейкоциты крови (нейтрофилы, лимфоциты, моноциты) в различных стадиях повреждения и распада. Повреждение протоплазмы гнойных телец заметно в виде появления в них большого количества вакуолей, нарушения контуров протоплазмы и стирания границ между гнойным тельцем и окружающей его средой. При специальных окрасках в гнойных тельцах и обнаруживается большое количество гликогена и капелек жира. Появление свободного гликогена и жира в гнойных тельцах является следствием нарушения комплексных полисахаридных и белково-липоидных соединений в протоплазме лейкоцитов. Ядра гнойных телец уплотняются (пикноз) и распадаются на части (кариорексис). Наблюдаются также явления разбухания и постепенного растворения ядра или его частей в гнойном тельце (кариолизис). Распад ядер гнойных телец вызывает значительное увеличение в гное количества нуклеопротеидов и нуклеиновых кислот. Гнойная сыворотка не отличается существенно по составу от плазмы крови (табл. 17).
Содержание сахара в экссудатах вообще и в гнойном экссудате в частности обычно ниже, чем в крови (0,5—0,6 г/л), вследствие интенсивных процессов гликолиза. Соответственно в гнойном экссудате значительно больше молочной кислоты (0,9—1,2 г/л и выше). Интенсивные протеолитические процессы в гнойном очаге вызывают увеличение содержания полипептидов и аминокислот. § 130. Восстановительные процессы в воспаленной тканиРоль соединительнотканных клеток.В зависимости от вида воспаления ткань всегда в большей или меньшей степени разрушается. Это разрушение достигает наибольших размеров при гнойном воспалении. После того как гнойник прорывается или вскрывается хирургическим путем, из него вытекает или удаляется гной, а на месте бывшего воспаления остается полость. В дальнейшем эта полость, или дефект ткани, вызванный воспалением, постепенно восполняется за счет размножения местных соединительнотканных клеток — гистиоцитов и фибробластов. Гистиоциты (макрофаги по И. И. Мечникову), а также моноциты крови дольше сохраняются в очаге воспаления, чем нейтрофилы и другие гранулоциты. Более того, продукты распада в воспаленной ткани, вызывающие гибель гранулоцитов, оказывают стимулирующее влияние на фагоцитарную активность макрофагов. Макрофаги поглощают и переваривают продукты распада в воспаленной ткани, оставшиеся после истечения или удаления гноя. Они очищают воспаленную ткань от этих продуктов распада путем внутриклеточного переваривания. Одновременно среда воспаленной ткани оказывает стимулирующее влияние на размножение этих клеток и метаплазию их в фибробласты и фиброциты. Они образуют таким путем новую, молодую, богатую кровеносными сосудами грануляционную ткань, которая постепенно превращается в волокнистую ткань, называемую рубцом (рис. 18). Важно отметить, что разрушение, вызванное воспалением в  различных органах и тканях, например в мозгу, миокарде, никогда не приводит к восстановлению дифференцированных паренхиматозных клеток воспаленного органа. На месте, бывшего ранее гнойника образуется соединительнотканный рубец. Это часто приводит ко многим вторичным осложнениям, связанным с постепенным рубцовым стягиванием, к «спайкам», деформирующим нормальную структуру органа и нарушающим его функцию. Хорошо известно вредоносное влияние рубцового спаечного процесса после воспаления в брюшине, после ранения нервных стволов, ранения или воспаления сухожилий, суставов и многих других органов. различных органах и тканях, например в мозгу, миокарде, никогда не приводит к восстановлению дифференцированных паренхиматозных клеток воспаленного органа. На месте, бывшего ранее гнойника образуется соединительнотканный рубец. Это часто приводит ко многим вторичным осложнениям, связанным с постепенным рубцовым стягиванием, к «спайкам», деформирующим нормальную структуру органа и нарушающим его функцию. Хорошо известно вредоносное влияние рубцового спаечного процесса после воспаления в брюшине, после ранения нервных стволов, ранения или воспаления сухожилий, суставов и многих других органов.Глава 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
