Гидравлика и противопожарное водоснабжение курсовой проект. ТБ-24 Ломакин Д. А. ТОПГиТ. Курсовая работа. Выполнение курсовой работы
 Скачать 463.34 Kb. Скачать 463.34 Kb.
|
1. Общие сведения о веществе.1) Бутаналь С4Н8О 2) 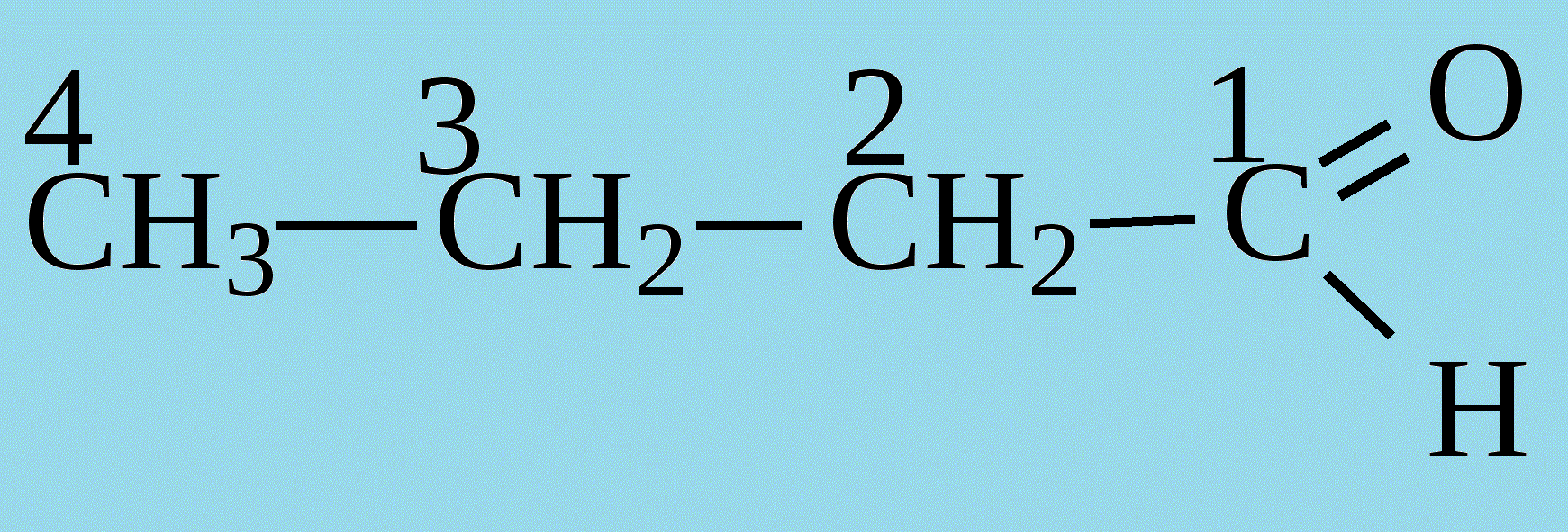 Бутаналь используется в качестве растворителя и является посредником для получения многочисленных продуктов: ускорители вулканизации каучуков, смол, фармацевтических препаратов и агрохимикатов.(лвж) Бутаналь — бесцветная жидкость с едким альдегидным запахом. Хорошо растворяется в органических растворителях. Относительная плотность пара по воздуху: 72/29 = 2,48 Температура кипения: 75 °C Химические свойства: бутаналь проявляет высокую химическую активность за счет группы атомов –CHO. Эта функциональная группа имеет название – карбонильная. Реакции окисления бутаналя являются качественными, то есть служат для обнаружения альдегида. Воздействие на человека - Токсичны. При вдыхании – воспаление верхних дыхательных путей, далее - смерть. 2. Определение характеристик горения.2.1 Характер свечения пламени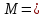 72 кг/кмоль 72 кг/кмольω(C) = 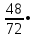 100% = 66,7 % 100% = 66,7 %ω(H) = 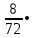 100% = 11,1 % 100% = 11,1 %ω(O) = 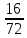 • 100% = 22,2 % • 100% = 22,2 %На основании полученных данных можно приблизительно судить о характере свечения пламени. Характер свечения пламени
Вывод: при горении пламя будет яркое, не коптящее, так как массовая доля углерода 66,7 % , а содержание кислорода 22,2 % 2.2 Теоретический и практический расход воздуха на горениеC4H8O + 5,5 • (O2+3,76N2) = 4CO2 + 4H2O + 5,5 • 3,76N2 Рассчитываем Vв при m=1 кг, t=19o C=292 К, p=107 кПа, α=1,5 1 способ1) Запишем уравнение химической реакции горения в воздухе C4H8O + 5,5 • (O2+3,76N2) = 4CO2 + 4H2O + 5,5 • 3,76N2 2) молярная масса : M=72 кг/кмоль 3) Находим молярный объем : Vм= 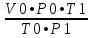 = = 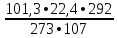 = 22,41 м3/кмоль = 22,41 м3/кмоль4) Теоретический объем воздуха: Vвтеор = 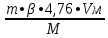 = = 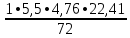 = 8,1 м3 = 8,1 м35) Практический объем воздуха: Vвпрак = Vвтеор • α = 8,1 • 1,5 = 12,15 м3 2 способ1) Молекулярная масса : M=72 кг/кмоль 2) Процентный состав : ω(C) = 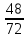 • 100% = 66,7 % • 100% = 66,7 %ω(H) = 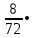 100 % = 11,1 % 100 % = 11,1 %ω(O) = 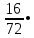 100% = 22,2 % 100% = 22,2 %3) Объем молярный: Vм = 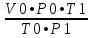 = = 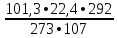 = 22,41 м3/кмоль = 22,41 м3/кмоль4)Vвтеор = 1 • 0,267 • ( 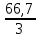 +11,1- +11,1-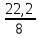 ) = 8,1 м3 ) = 8,1 м3 5) Практический объем воздуха: Vвпрак = Vвтеор • α = 8,1 • 1,5 = 12,15 м3 |
