Гидравлика и противопожарное водоснабжение курсовой проект. ТБ-24 Ломакин Д. А. ТОПГиТ. Курсовая работа. Выполнение курсовой работы
 Скачать 463.34 Kb. Скачать 463.34 Kb.
|
2.3 Объем и состав продуктов полного сгорания1 способ 1) Запишем уравнение химической реакции горения в воздухе C4H8O + 5,5 • (O2+3,76N2) = 4CO2 + 4H2O + 5,5 • 3,76N2 2) молярная масса : M = 72 кг/кмоль 3) Vпр(пг)= 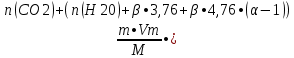 4) Vпр(пг)= 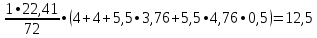 м3 м32 способ- По процентному составу 1) Запишем уравнение химической реакции горения в воздухе C4H8O + 5,5 • (O2+3,76N2) = 4CO2 + 4H2O + 5,5 • 3,76N2 2) молярная масса : M= 72 кг/кмоль 3) массовые доли ω(C) = 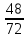 • 100% = 66,7 % • 100% = 66,7 %ω(H) = 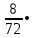 100% = 11,1 % 100% = 11,1 %ω(O) = 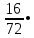 100% = 22,2 % 100% = 22,2 %4)объем каждого вещества V(CO2) = 1 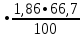 =1,2 м3 =1,2 м3V(H2O) = 1 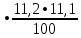 =1,2 м3 =1,2 м3V(N2) = 1• ( 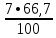 + + 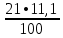 - -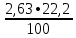 ) = 6,4 м3 ) = 6,4 м3 Vвозд = Vвтеор • (а -1) = 8,1 • (1,5 - 1) = 4,05 м3 Vвозд = Vвтеор • (а -1) = 8,1 • (1,5 - 1) = 4,05 м35) объем продуктов горения Vпг = 1,2 + 1,2 + 6,4 + 4,05 = 12,85 м3 2.4 Низшая теплота горенияНизшая теплота горения- количество тепла, которое выделяется при сжигании единицы топлива до продуктов полного сжигания. 2.4.1 Расчет по уравнению Менделеева1)Молекулярная масса: M = 72 кг/кмоль 2)Процентный состав каждого вещества: ω(C) = 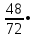 100% = 66,7 % 100% = 66,7 %ω(H) = 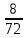 • 100% = 11,1 % • 100% = 11,1 %ω(O) = 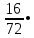 100% = 22,2 % 100% = 22,2 %3)Определяем низшую теплоту горения: Qн = 339,4[C] +1257[H] -108,9 • ([О]+[N]) –S) – 25,1• (9•[H] + [W]) = 339,4• 66,7 + 1257• 11,1 – 108,9 • 22,2 – 25,1 • (9•11,1) = 31 670,61 кДж/кг 2.4.2 Расчет по закону ГессаΔH0 р-и = 4•Δ H0(CO2) + 4•Δ H0(H2O) - Δ H0(C4H18O) = 4•(-393,5) + 4•(-241,8) - (-205) = - 2336,2 кДж 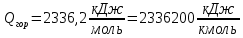 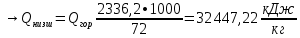 2.5 Стехиометрическая концентрация паров в смесиСтехиометрическая концентрация - концентрация горючего вещества, когда реагирующие вещества взяты в эквивалентных отношениях, соответствующих уравнению реакции, при этом ни одно из веществ не находится в избытке. C4H8O + 5,5 • (O2+3,76N2) = 4CO2 + 4H2O +5,5 • 3,76N2 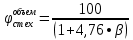 = = 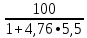 = 3,7 % (сухой воздух) = 3,7 % (сухой воздух)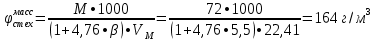 |
