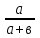Хим Равновесие. лаба химическое равновесие. Влияние концентрации реагирующих веществ на скорость химической реакции
 Скачать 39.21 Kb. Скачать 39.21 Kb.
|
|
Опыт №1 Влияние концентрации реагирующих веществ на скорость химической реакции. Уравнение реакции: Na2S2O3+ H2SO4 = Na2SO4 + SO2 + S + H2O Ход работы: В четыре пробирки мы налили из бюретки по 6 мл 0,5М раствора серной кислоты. В четыре пронумерованных стаканчика (по 50 мл) налили указанное в табл. 1 количество 0,5М раствора тиосульфата натрия и воды. Выливаем в стаканчик №1 отмеренные 6 мл серной кислоты, быстро перемешиваем, муть в объеме раствора начинает появляться через 7 секунд. Выливаем в стаканчик №2 отмеренные 6 мл серной кислоты, быстро перемешиваем, муть в объеме раствора начинает появляться через 10 секунд. Выливаем в стаканчик №3 отмеренные 6 мл серной кислоты, быстро перемешиваем, муть в объеме раствора начинает появляться через 12 секунд. Выливаем в стаканчик №1 отмеренные 6 мл серной кислоты, быстро перемешиваем, муть в объеме раствора начинает появляться через 15 секунд. Табл. 1
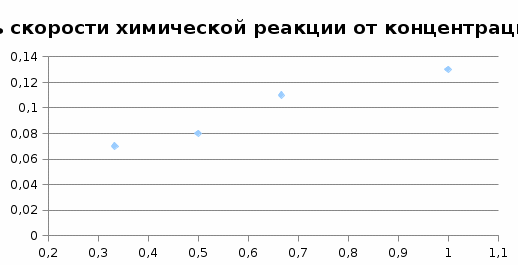 Вывод: С уменьшение концентрации реагирующего вещества, уменьшается и скорость химической реакции, т.к. время протекания реакции увеличивается. Опыт №2а Влияние величины поверхности раздела реагирующих веществ на скорость гетерогенной химической реакции. У  равнение реакции: равнение реакции:СаС 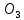 + 2НСl = Са + 2НСl = Са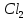 + С + С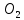 + +  О ОХод работы: Наливаем в две пробирки на ¼ их объема 2М раствор соляной кислоты. Берем кусочек Ca 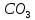 (тв) (мел) и порошокCaC (тв) (мел) и порошокCaC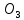 . Одновременно в первую пробирку бросаем кусочек мела, а во вторую – порошок. Мы наблюдаем, что реакция протекает быстрее с порошком, чем с кусочком мела. Реакция протекает с выделение газа. . Одновременно в первую пробирку бросаем кусочек мела, а во вторую – порошок. Мы наблюдаем, что реакция протекает быстрее с порошком, чем с кусочком мела. Реакция протекает с выделение газа.Вывод: Химическая реакция протекает быстрее, если площадь соприкосновения реагирующих веществ больше. Опыт № 3а Влияние катализатора на скорость химической реакции. а) гетерогенный катализ. Уравнения реакций: 1)  2) 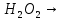 3)  Ход работы: В три пробирки наливаемпо ¼ объема перекиси водорода. Одновременно добавили: в первую пробирку – оксид марганца (II) (MnO2), во-вторую– оксид кремния (IV) (SiO2), в третью – оксид железа (II) (FeO). Наблюдаем реакцию разложения перекиси водорода.Опускаем в каждую пробиркутлеющую лучинку. В 1 и во 2 пробирке выделяется кислород и лучинка зажигается.Si  не является катализатором. не является катализатором.Вывод: С добавлением катализатора химическая реакция протекает быстрее, чем без катализатора. Опыт №4 а Химическое равновесие и его смещение. а) влияние изменения концентрации на смещение равновесия. Уравнение реакции: F 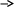 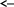 e e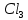 +3KCNS Fe(CNS +3KCNS Fe(CNS +3KCl +3KClKc= 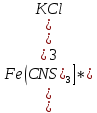 Ход работы: В стаканчик на 50мл наливаемна ¾ объема дистиллированной воды, и добавляем по 2 капли насыщенных растворов Fe 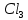 и KCNS. Окрашенный в красный цвет раствор разливаем поровну в 4 пробирки. и KCNS. Окрашенный в красный цвет раствор разливаем поровну в 4 пробирки. Первую пробирку оставляем в качестве эталона, во-вторую добавляем по 2 капли насыщенного раствора Fe 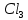 , в третью – 2 капли насыщенного раствора KCNS, а в четвертую добавляем несколько кристаллов KCl. Во 2 и 3 пробирке цвета растворов стали темными, т.к. равновесие сместилось в направление образования продуктов реакции, а в 4 пробирке он стал светлее, т.к. равновесие сместилось в направление образования исходных веществ. , в третью – 2 капли насыщенного раствора KCNS, а в четвертую добавляем несколько кристаллов KCl. Во 2 и 3 пробирке цвета растворов стали темными, т.к. равновесие сместилось в направление образования продуктов реакции, а в 4 пробирке он стал светлее, т.к. равновесие сместилось в направление образования исходных веществ.Вывод: С повышением концентрации исходных веществ равновесие смещается в сторону продуктов реакции, а с повышением концентрации продуктов реакции равновесие смещается в сторону исходных веществ. | ||||||||||||||||||||||||||||||||