Лабораторная работа №2. Лабораторная работа 2 Зависимость скорости реакции от концентрации реагирующих веществ при постоянной температуре Работу выполнил студент
 Скачать 34.53 Kb. Скачать 34.53 Kb.
|
|
Новосибирский государственный архитектурно-строительный университет (Сибстрин) Кафедра физики и химии Лабораторная работа №2 Зависимость скорости реакции от концентрации реагирующих веществ при постоянной температуре Работу выполнил студент: Каташев Даниил Игоревич группа 123 з «20» декабря 2021 г Работу проверил преподаватель: Полунина Ольга Анатольевна «___»__________20__ г Новосибирск 2021 Цель работы: Установить характер зависимости скорости реакции от концентрации реагирующего вещества. Приборы: пробирки, мерные пробирки, штатив, секундомер. Реактивы: 2%-ный раствор серной кислоты, 2%-ный раствор тиосульфата натрия, дистиллированная вода. Описание опыта: В четырех пробирках готовим растворы серной кислоты:
Приливаем 4 мл раствора тиосульфата натрия, реакция протекает по уравнению: Na2S2O3 + H2SO4 = Na2SO4 + SO2 + H2O + S Реакция считается законченной, когда из-за помутнения раствора клетки на бумаге, расположенной за пробиркой, станут невидимыми. Рассчитаем для всех 4-х случаев: а) скорость реакции 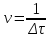 , с-1 , с-1б) молярную концентрацию серной кислоты 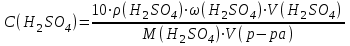 , моль/л , моль/лгде ω(H2SO4) –массовая доля исходного раствора H2SO4, 2 (%); ρ(H2SO4) = 1,012 г/см3; М(H2SO4) – молярная масса H2SO4, 98 г/моль; V(H2SO4) – объем 2 % - ной серной кислоты, используемый для приготовления каждого раствора, см3; Vр-ра – общий объем раствора при реакции (16 см3). Таблица результатов:
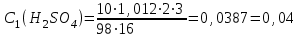 моль/л моль/л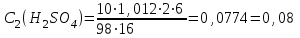 моль/л моль/л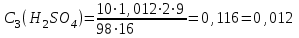 моль/л моль/л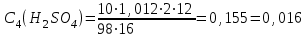 моль/л моль/лИзобразим графически полученные результаты, отложив на оси абсцисс молярные концентрации H2SO4, а на оси ординат скорость реакции υ·102. 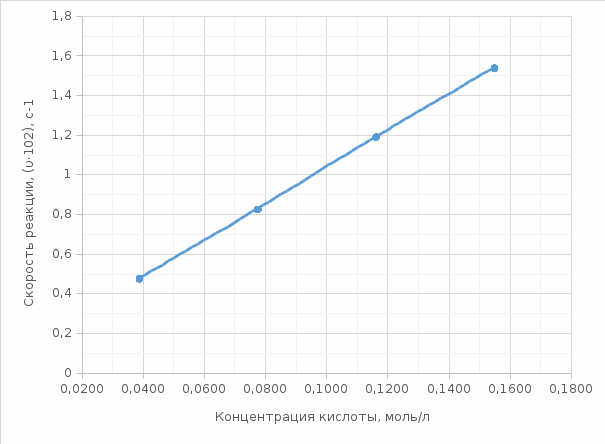 Закон действующих масс для проведенной реакции. v = k ∙ C(H2SO4) ∙ C(Na2S2O3) Скорость реакции прямо пропорциональна концентрации серной кислоты (линейная зависимость). Вывод: В ходе лабораторной работы была изученная зависимость скорости химической реакции от концентрации одного из действующих веществ при постоянной температуре. Так как показатель степени у концентрации серной кислоты в законе действующих масс равен 1, то зависимость должна быть линейной, что и наблюдается в построенном графике. Установлено, что график 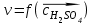 имеет линейный характер. имеет линейный характер. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
