ВЛИЯНИЕ ВНЕШНИХ ФАКТОРОВ НА АГРЕГАТИВНУЮ УСТОЙЧИВОСТЬ ГЛИНИСТЫХ СУСПЕНЗИЙ. Влияние внешних факторов на агрегативную устойчивость
 Скачать 334.98 Kb. Скачать 334.98 Kb.
|
|
УДК 544.77 ВЛИЯНИЕ ВНЕШНИХ ФАКТОРОВ НА АГРЕГАТИВНУЮ УСТОЙЧИВОСТЬ ГЛИНИСТЫХ СУСПЕНЗИЙ К.А. Алванян, Н.А. Медведева, Н.А. Драчева, П.С. Потураев, А.Д. Метляков Пермский государственный национальный исследовательский университет 614990, г. Пермь, ул. Букирева, 15 E-mail: nata-kladova@yandex.ru В работе изучены электрокинетические характеристики глинистых суспензий различных месторождений Урала. Определено влияние внешних факторов (кислотность среды, присутствие электролитов и их совместное влияние) на величину электрокинетического потенциала. Осуществлен расчет потенциальной энергии взаимодействия (электростатического отталкивания и молекулярного притяжения) частиц глинистых минералов в различных условиях. Ключевые слова: электрокинетический потенциал, потенциальная энергия, каолинит, монтмориллонит, агрегативная устойчивость, теория ДЛФО Введение Регулирование физико-химических характеристик водных минеральных суспензий, а также предвидение их агрегативной устойчивости и процессов структурообразования являются актуальными проблемами при изучении структурно-адсорбционных характеристик природных глинистых минералов [1-3]. Во многих областях промышленности глины применяют в виде дисперсных систем, преимущественно в виде суспензий, когда твердая фаза находится в высокодисперсном состоянии. Образованная система имеет достаточно развитую границу раздела фаз между твердым телом и жидкостью [4, 5]. В связи с этим вопросы, связанные с установлением закономерности взаимодействия глинистых частиц, а также влияние на него различных факторов, таких как рН, присутствие электролитов, их ионной силы, расчету энергии взаимодействия и определению особенностей поверхности минеральных дисперсий, являются актуальной задачей [6-8]. Целью данной работы явилось изучение агрегативной устойчивости суспензий глины различных месторождений и влияние на нее внешних факторов. Методика эксперимента В качестве объектов исследования использовали глину трех месторождений: Александровского, Челябинского и Лобановского. Минеральный состав глин, согласно результатам рентгенофазового анализа, представлен в таблице 1 (где ЧК – Челябинский каолинит, АК – Александровский каолинит, ЛМ – Лобановский монтморрилонит). Таблица 1 Минеральный состав исследуемых глинистых пород
Структурные (размер частиц) и электрокинетические характеристики (электрокинетический потенциал) глины в воде, в присутствие электролитов и при различных рН осуществляли с помощью анализатора частиц субмикронного размера и дзета-потенциала DelsaNanoC (Bruker, Германия). Измерение размера частиц осуществляли в ячейке с кварцевой кюветой, а определение дзета-потенциала частиц проводили в проточной ячейке. В основе измерений размеров частиц и электрокинетических характеристик лежат методы фотонно-корреляционной спектроскопии (PCS), основанные на принципе динамического рассеяния света, и электрофоретического светорассеяния Результаты и их обсуждение Фракционный состав глинистых минералов осуществляли методом фотонно-корреляционной спектроскопии. Зависимость интенсивности рассеивания излучения от размера частиц глинистых суспензий были построены в виде гистограмм. На рис.1 в качестве примера приведены диаграммы распределения глинистых частиц по размерам для Челябинского каолинита. Для исследованных глинистых суспензий гистограммы, как правило, состояли из двух областей, каждая из которых характеризуется средним наивероятнейшим размером частиц (d1 и d2) (табл.2). В табл. 2 представлены усредненные результаты, проведенных измерений, на основании которых следует, что глинистые частицы в суспензии находятся в виде агрегатов (d1) и агломератов (d2). Видно, что водные суспензии каолинитов имеют нейтральную среду, тогда как суспензия монтмориллонита – щелочную. Согласно распределению глинистых частиц по размеру, можно судить о степени полидисперсности (P.I.) изучаемых систем. Значения электрокинетического потенциала поверхности частиц глинистых пород получились отрицательными, что согласуется с литературными данными [7-9]. 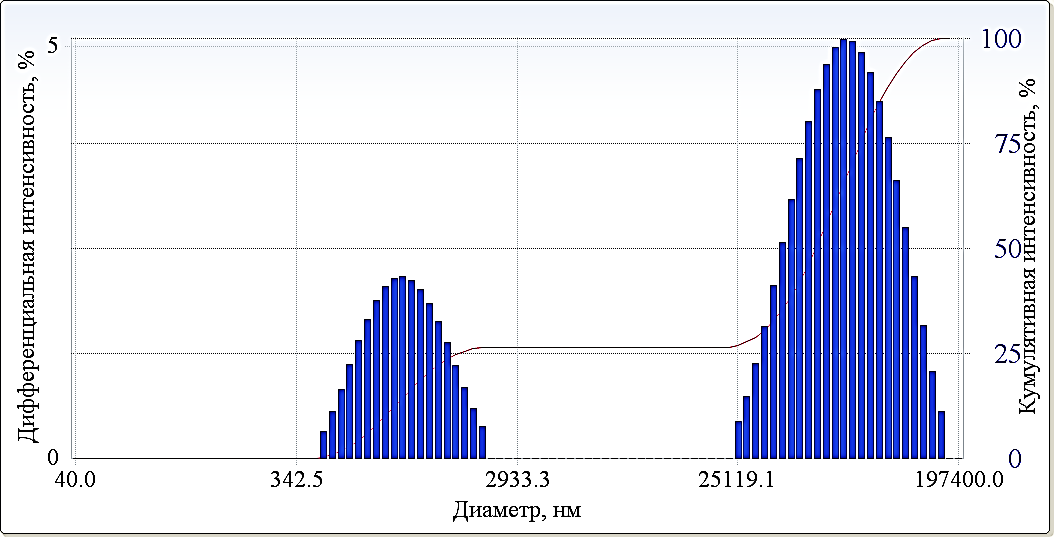 Рис.1. Фракционное распределение частиц Лобановского монтмориллонита в воде Отрицательно заряженная поверхность частиц обусловлена двумя факторами: во-первых, изоморфными превращениями внутри структуры тетраэдрических и октоэдрических сетках, что приводит к появлению отрицательного нескомпенсированного заряда структурной ячейки. Во-вторых, разрыв химических связей в тетраэдрических и октоэдрических сетках, приводит к появлению на их боковых гранях гидроксильных групп. Таблица 2 Физико-химические параметры водных глинистых суспензий
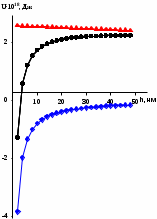
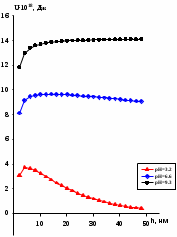
d1 и d2 – средний наивероятнейший размер частиц (величина соответствует пику на гистограмме), d – средний размер всех частиц в системе, P.I. – степень полидисперсности Важная роль при изучении устойчивости суспензии глинистых минералов отведена механизму, вызывающему коагуляцию глинистых частиц в дисперсных системах под действием электролитов. Одним из параметров, характеризующим коагуляцию, является электрокинетический потенциал [8, 9]. На величину заряда влияют следующие параметры: минеральный состав глин, рН среды, а также процессы специфической адсорбции на поверхности частиц, вызванной присутствием электролитов. Присутствие электролитов в глинистой суспензии приводит к нарушению ДЭС частиц глины, тем самым способствуя понижению ее устойчивости. Процесс разрушения дисперсной системы, сопровождающийся потерей седиментационной устойчивости вызван явлением коагуляции, которая протекает с заметной скоростью при концентрации электролита, превышающей некоторое критическое значение, называемое порогом коагуляции Cк [10-11]. Основной причиной, приводящей к коагуляции частиц, служит сжатие диффузного слоя ДЭС под действием электролитов, в результате чего происходит нарушение ДЭС и снижение электрокинетического потенциала глинистых частиц в суспензиях. Устойчивость дисперсных систем определяется балансом энергии притяжения и энергии отталкивания частиц. Энергия притяжения обусловлена межмолекулярными силами, главным образом силами Ван-дер-Вальса. В первом приближении эта энергия обратно пропорциональна квадрату расстояния между частицами. Согласно теории ДЛФО, которая учитывает только электростатическую составляющую расклинивающего давления (давления отталкивания), энергия отталкивания убывает с расстоянием по экспоненциальному закону [12]. При вычислении суммарной энергии были приняты следующие допущения: частицы имеют сферическую форму, отсутствует эффект электромагнитного запаздывания, не учитываются взаимодействия между частицами различных радиусов. Расчет проводили только для средних размеров глинистых частиц, которые соответствовали максимуму на кривой распределения, поскольку содержание таких частиц в глинистых суспензиях составляло 70-90%. Уравнение Гамакера для сферических частиц имеет вид 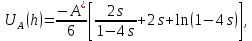 где s=(r/R)2; R=2r + h: расстояние между центрами частиц радиуса r, разделенных тонкой прослойкой толщины h. Сложные константы Гамакера А* для частиц глинистых минералов в водной среде соответственно равны: А* (каолинит) = 3,110-20 Дж; А*(монтмориллонит) = 2,210-20 Дж [13]. В данной работе было принято, что частицы сферические. Поэтому для расчета энергии взаимодействия сферических частиц UE(h) – функции энергии взаимодействия сферических частиц, разделенных тонкой прослойкой толщины h, использовали уравнение Дерягина [12, 14]: 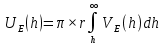 , ,где r – радиус частиц, м;VE(h) – функция энергии взаимодействия между призматическими частицами, разделенными тонкой прослойкой толщины h, Дж. Энергию отталкивания частиц UE(h) в растворах хлорида калия рассчитывали по уравнению для симметричных электролитов: 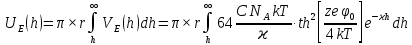 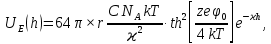 где С – молярная концентрация электролита, моль/л; NA – число Авогадро; 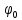 – потенциал поверхности частиц, В; k– постоянная Больцмана, Дж/К; Т – температура, К; – потенциал поверхности частиц, В; k– постоянная Больцмана, Дж/К; Т – температура, К;  – параметр Дебая (обратная толщина диффузной части ДЭС, 1/ – параметр Дебая (обратная толщина диффузной части ДЭС, 1/ =δ), м-1; δ - толщина диффузной части ДЭС, м; z – заряд ионов. =δ), м-1; δ - толщина диффузной части ДЭС, м; z – заряд ионов.В случае сульфата калия применяли уравнение для несимметричных электролитов типа 1-2: 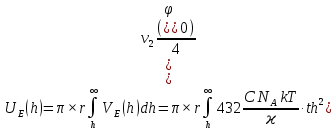 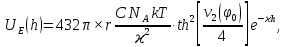 где 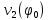 – определяется выражением – определяется выражением 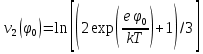 . .Потенциал на поверхности частиц 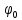 трудно определить экспериментально. В связи с этим для облегчения вычислений используют величину -потенциала дисперсных частиц вместо трудно определить экспериментально. В связи с этим для облегчения вычислений используют величину -потенциала дисперсных частиц вместо 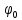 и и 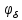 в уравнениях электростатической составляющей энергии взаимодействия [14-16]. в уравнениях электростатической составляющей энергии взаимодействия [14-16].Зная размер частиц и значение электрокинетического потенциала для каждой суспензий (результаты представлены ранее в [17-18]), рассчитывали суммарную энергию взаимодействия между двумя частицами одинакового размера в системах (в нашем случае использовали средний размер частиц) определяли по формуле U= 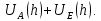 Результаты расчетов представлены в виде потенциальных кривых зависимости суммарной энергии взаимодействия частиц от расстояния между поверхностями двух частиц (h). Значения h выбраны произвольно и соответствуют условию h0 < h < r. Потенциальные кривые в начальном состоянии системы характеризуются наличием высокого барьера на пути сближения частиц, который препятствует агрегации и обеспечивает устойчивость системы в водных суспензиях. В качестве примера представлены потенциальные кривые энергии притяжения, энергии отталкивания и суммарной энергии взаимодействия частиц одинакового размера для суспензии Александровского каолинита (рис.2). Полученные потенциальные кривые в присутствии электролитов приведены на рис. 3. Смещение потенциальных кривых в отрицательную область при добавлении электролитов связано с уменьшением стабильности суспензий с последующей агрегацией частиц и потерей устойчивости при пороговых концентрациях. Необходимо отметить общие черты между взаимодействием двух частиц. На больших расстояниях между частицами преобладают силы притяжения (вследствие более медленного падения сил притяжения с расстоянием между частицами по сравнению с силами отталкивания). Однако при уменьшении h начинают действовать силы электростатического отталкивания, что приводит к появлению энергетического барьера, для преодоления которого необходима определенная кинетическая энергия сближающихся частиц. При еще меньших h энергия притяжения оказывается большей по сравнению с энергией электростатического отталкивания, частицы начинают самопроизвольно сближаться и в конце концов коагулируют.
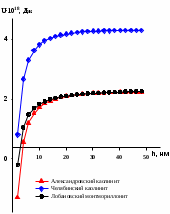
При сравнении суммарной потенциальной энергия взаимодействия двух глинистых частиц различной природы в присутствии электролита KCl (0.001 М) наблюдается следующая ситуация (рис.3.а). Наибольшей устойчивостью обладает Челябинский монтмориллонит, о чем свидетельствует большее значение энергетического барьера. В присутствии сульфата калия поведение глинистых частиц иное, о чем свидетельствует вид суммарных энергетических кривых (рис.3 б). В данной ситуации наиболее устойчивой глинистой суспензией является Александровский каолинит. Наряду с электролитами, рН среды также оказывает влияние на значение -потенциала. Ранее была установлена зависимость электрокинетического потенциала от рН в водных суспензиях глин в отсутствии электролитов [19]. Была установлена зависимость электрокинетического потенциала от кислотности среды. Показано, что изменение величины -потенциала от рН обусловлено повышением способности разрыва химических связей в тетраэдрических и октаэдрических сетках кристаллов глинистых минералов, согласно реакциям 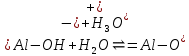 (в октаэдрических сетках) и (в октаэдрических сетках) и 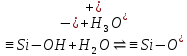 (в тетраэдрических сетках) при снижении кислотности, в результате чего поверхность частиц заряжается более отрицательно. В слабокислой и слабощелочной средах равновесие реакций разрыва смещается незначительно. (в тетраэдрических сетках) при снижении кислотности, в результате чего поверхность частиц заряжается более отрицательно. В слабокислой и слабощелочной средах равновесие реакций разрыва смещается незначительно. Для данной статьи выбраны три значения рН, соответствующие кислой, нейтральной и щелочной средам: 3.2, 6.6, 9.3, соответственно. В табл.3 представлены результаты проведенных измерений. Видно, что средний размер глинистых частиц существенным образом не изменяется от рН среды, однако зависит от природы глинистого минерала. Так, для каолиновых глин средний размер частиц дисперсной фазы в 1,5-2 раза меньше по сравнению с монтмориллонитом. Значение электрокинетического потенциала также зависит от природы глинистого минерала и слабо изменяется при переходе из нейтральной среды в щелочную. Необходимо отметить, что при рН=3.2 наблюдается минимальное значение -потенциала по абсолютному значению. В тоже время, числовые значения электрокинетического потенциала в кислой среде свидетельствуют о неустойчивости глинистой системы в выбранных условиях. Таблица 3 Размерные и электрокинетические характеристики глинистых частиц в буферных растворах
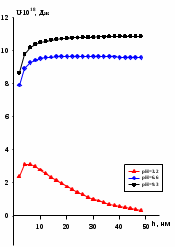
В таблицах 4 и 5 представлены усредненные результаты исследовании для глинистых минералах в присутствии электролитов и при разной кислотности среды. Таблица 4 Физико-химические характеристики глинистых частиц в буферных растворах в присутствии электролита KCl (Ск)
Таблица 5 Физико-химические характеристики глинистых частиц в буферных растворах в присутствии электролита K2SO4 (Ск)
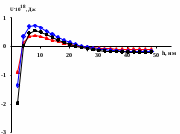
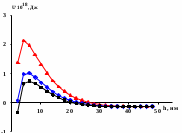
Рассчитанные потенциальные кривые представлены на рис.4 а. В качестве примера представлены результаты для монтмориллонита Лобановского месторождения. Для всех глин при разных значениях кислотности наблюдается расположение суммарной энергии в положительной области ординаты. Таким образом, основной вклад обусловлен электростатическим отталкиванием частиц. Однако, в условиях рН=3.2 взаимодействие между частицами характеризуется наличием барьера, значение которого уменьшается при переходе от АКЛМЧК, в этом же ряду происходит снижение агрегативной устойчивости.
Изменение электрокинетических характеристик в присутствии электролитов обусловлено тем, что для каолинитов Александровского и Челябинского месторождений хлорид и сульфат калия являются индифферентными электролитами. Согласно правилу Фаянса-Панета ионы этих электролитов (K+, Cl, SO42) не способны достраивать кристаллическую решетку частиц каолинита Al4[Si4O10](OH)8, в которую входят ионы Al3+ и Si4+. В данном случае, присутствие электролитов KCl и K2SO4 не изменяет потенциал на поверхности частиц глин, а сжатие ДЭС реализуется в результате катионного обмена между противоионом ДЭС частиц глин (Н+) и катионом электролитов (К+). Такое взаимодействие приводит к уменьшению значения электрокинетического потенциала по абсолютному значению (табл.4 и 5). Для монтмориллонита KCl и K2SO4 являются неиндифферентными, за счет способности катиона К+ достраивать кристаллическую решетку данного глинистого минерала. Согласно правилу Фаянса-Панета достраивание кристаллической решетки возможно из-за наличия в кристаллах монтмориллонита ионов щелочных металлов. Присутствие катионов К+ в решетке глинистого минерала вызывает снижение абсолютного значения потенциала поверхности частиц глин. Таким образом, исследовано влияние внешних факторов, таких как рН среды, введение неорганических солей и их совместное действие на агрегативную устойчивость глинистых суспензий различной природы. Определен вклад электростатической энергии отталкивания и молекулярного притяжения в суммарную потенциальную энергию взаимодействия двух частиц в модельных средах. Библиографический список Яковлева A.A., Во Дай Ту, Соловеенко Н.П. Влияние некоторых электролитов на распределение частиц суспензии глины Слюдянского месторождения // Вестник ИГУ. - Иркутск: Изд-во ИГУ, 2010. - С. 440 - 441. Seredin V.V., Rastegayev A.V., Panova E.G., Medvedeva N.A., Changes in Physical properties of Clay under Compression. International Journal of Engineering and Applied Sciences 2017. Vol. 4, № 3, рр. 22–29. Грибанов Е.Н., Оскотская Э.Р., Кузьменко А.П. Особенности строения, морфологии и кислотно-основных свойств поверхности алюмосиликата Хотынецкого месторождения // Конденсированные среды и межфазные границы. – 2018. – Т. 20, № 1. – С. 42–49. DOI: 10.17308/kcmf.2018.20/475. Тарасевич Ю.И. Адсорбция на глинистых минералах / Ю.И. Тарасевич, Ф.Д. Овчаренко. - Киев: Наукова думка, 1975. - 351 с. Осипов В. И. Природа прочностных и деформационных свойств глинистых пород. M.: Изд-во МГУ, 1979. – 232 c. Яковлева А.А., Мальцева Г.Д. Кристаллохимические аспекты оценки энергии взаимодействия частиц глинистых минералов // Известия Сибирского отделения Секции наук о Земле Российской академии естественных наук. Геология, разведка и разработка месторождений полезных ископаемых. - 2018. - Т. 41. № 1. - С. 99–114. DOI: 10.21285/2541-9455-2018-41-1-99-114 Lagaly G., Ziesmer S. Colloid chemistry of clay minerals: the coagulation of montmorillonite dispersions // Advance in Colloid and Interface Science. - 2003. - Vol. 100. - P. 105-128. Lim J., Ross G. Investigating the influence of total electrolyte concentration and sodium - calcium ion competition on controlled dispersion of swelling clay // Int. Journal of Mineral Processing. - 2009. - Vol. 93. - P. 95 - 102. Tombacz E. , Szekeres M. Colloidal behavior of aqueous montmorillonite suspensions: the specific role of pH in the present of indifferent electrolytes. Applied Clay Sci. - 2004. - Vol. 27. - Pp. 75 - 94. ФридрихсбергД.А. Курс коллоидной химии. – СПб.: Лань. - 2010. - 410 с. Щукин Е.Д. Коллоидная химия / Е.Д. Щукин, А.В. Перцов, Е.А. Амелина. - М.: Высш. шк., - 2006. - 444 с. ДерягинБ.В. Поверхностные силы / Б.В. Дерягин, Н.В. Чураев, В.М. Муллер. - М.: Наука, 1985. - 398 с. Novich В.Е., Ring Т.А. Colloid stability of clays using photon correalation spectroscopy // Clays and clay minerals. - 1984. - Vol. 32, № 5. - Pp. 400-406. Wiacek A., Chibowsky E. Application of an extended DLVO theory for the calculation of the interactions between emulsified oil droplets in alcohol solutions // Colloid and Surfaces B: Biointerfaces. - 1999. - №. 14. - Pp. 19-26. Missana Т., Adell A. On the applicability of DLVO theory to the prediction of clay colloids stability // Journal of Colloid and Interface Sci. - 2000. - №. 230. - Pp. 150-156. Benitez E.I., Genovese D.B., Lozano J.E. Effect of pH and ionic strength on apple juice stability. An application of the extended DLVO theory. Food hydrocolloids. - 2007. - №. 21. - Pp. 100 - 109. Середин В.В., Красильников П.А., Медведева Н.А., Паршина Т.Ю., Пешкова Т.А. Закономерности изменения структурных связей (электрокинетического потенциала) глинистых частиц в водном растворе // Современные проблемы науки и образования. – 2015. – № 2-2. - С.888-893. Пешкова Т.А. Мальгина Ю.О., Медведева Н.А. Ионный обмен на глинистых минералах: исследование монтмориллонитовой и каолинитовой глин // Вестник молодых ученых ПГНИУ. Сборник научных трудов. - 2016. - №6. - С. 183-186. ПешковаТ.А. МальгинаЮ.О., МедведеваН.А., СерединВ.В. Влияние рН на электрокинетический потенциал глинистых частиц монтмориллонита и каолинита // Геология в развивающемся мире. – 2017. - Т. 2. - С. 131-134. References Iakovleva A. A., Vo Dai Tu and Soloveenko N. P. (2010), Vliianie nekotorykh elektrolitov na raspredelenie chastits suspenzii gliny sliudianskogo mestorozhdeniia [The effect of some electrolytes on the distribution of particles of clay suspension from the Slyudyanskoe deposit]. Vestnik IGU. Irkutsk: Publ. IGU, pp. 440 - 441. Seredin V. V., Rastegayev A. V., Panova E. G. and Medvedeva N. A. (2017), Changes in Physical properties of Clay under Compression. International Journal of Engineering and Applied Sciences, vol. 4, no. 3, pp. 22–29. Gribanov Е. N., Оskotskay E. R. and Кyzmenko А. P. (2018), Osobennosti stroenia, morfologii b kislotno-ocnovnich svoistv poverchnosti aluymosilikata Hotinetckogo mestorogdenia [Features of the structure, morphology and acid-base properties of the surface of aluminosilicate Hotynets Deposit]. Condensed matter and interphases, vol. 20, no. 1, pp. 42–49. DOI: 10.17308/kcmf.2018.20/475 Osipov V. I. (1979), Priroda prochnostnykh i deformatsionnykh svoistv glinistykh porod [The nature of the strength and deformation properties of clay rocks]. Moscow: Publ. MGU. 232 p. Tarasevich Iu. I. and Ovcharenko F. D. (1975), Adsorbtsiia na glinistykh mineralakh [Adsorption on clay minerals]. Kiev: Naukova dumka. 351 p. Yakovleva A.A. and Maltseva G.D. (2018), Kristallokhimicheskie aspekty otsenki energii vzaimodeistviia chastits glinistykh mineralov [Crystallochemical aspects in the evaluation of clay mineral particle interaction energy]. Izvestiya Sibirskogo otdeleniya Sektsii nauk o Zemle Rossiiskoi akademii estestvennykh nauk. Geologiya, razvedka i razrabotka mestorozhdenii poleznykh iskopaemykh [Proceedings of the Siberian Department of the Section of Earth Sciences of the Russian Academy of Natural Sciences. Geology, Exploration and Development of Mineral Deposits], vol. 41, no. 1, рр. 99–114. DOI: 10.21285/2541-9455-2018-41-1-99-114 Lagaly G. and Ziesmer S. (2003), Colloid chemistry of clay minerals: the coagulation of montmorillonite dispersions. Advance in Colloid and Interface Science, vol. 100, pp. 105-128. Lim J. and Ross G. (2009) Investigating the influence of total electrolyte concentration and sodium - calcium ion competition on controlled dispersion of swelling clay. Int. Journal of Mineral Processing, vol. 93, pp. 95 - 102. Tombacz E. and Szekeres M. (2004) Colloidal behavior of aqueous montmorillonite suspensions: the specific role of pH in the present of indifferent electrolytes. Applied Clay Sci, vol. 27, pp. 75 - 94. Fridrikhsberg D.A. (2010), Kurs kolloidnoi khimii [Course of colloid chemistry]. Saint-Petersburg: Lan. 410 p. Shchukin E.D., Pertsov A.V. and Amelina E.A (2006), Kolloidnaia khimiia [Colloid chemistry]. Moscow: Vyssh. Shk. 444 p. Deriagin B.V., Churaev N.V. and Muller V.M. (1985), Poverkhnostnye sily [Surface forces]. Moscow: Nauka. 398 p. Novich В.Е. and Ring Т.А. (1984), Colloid stability of clays using photon correlation spectroscopy. Clays and clay minerals, vol. 32, no. 5, pp. 400-406. Wiacek A. and Chibowsky E. (1999), Application of an extended DLVO theory for the calculation of the interactions between emulsified oil droplets in alcohol solutions. Colloid and Surfaces B: Biointerfaces, no. 14, pp. 19-26. Missana Т. and Adell A. (2000), On the applicability of DLVO theory to the prediction of clay colloids stability. Journal of Colloid and Interface Sci, no. 230, pp. 150-156. Benitez E.I., Genovese D.B. and Lozano J.E. (2007), Effect of pH and ionic strength on apple juice stability. An application of the extended DLVO theory. Food hydrocolloids, no. 21, pp. 100 - 109. Seredin V.V., Krasilnikov P.A., Medvedeva N.A., Parshina T.Y. and Peshkova T.A. (2015), Laws changes of structural links (zeta potential) of particles clay in aqueous solution. Modern problems of science and education, no. 2 (2), pp. 888-893. Peshkova T.A. Malgina Ya.О. and Medvedeva N.A. (2016), Ionnii obmen na glinistix mineralah: issledovanie montmorillonitovoi i kaolinitovoi glin [Ion exchange on clay minerals: a study of the montmorillonite and kaolinite clays]. Vestnik molodih ychenih PGNIY. Sbornik naychnih trydov. [Bulletin of young scientists, Perm, Russia. Collection of proceedings], no. 6, pp. 183-186. Peshkova T.A. Malgina Ya.О., Medvedeva N.A. and Seredin V.V. (2017), Vliyanie рН na elektrokiniticheskii potencial glinistih chastic montmorillonite i kaolinite [Influence of pH on electrokinetic potential of clay particles of montmorillonite and kaolinite]. Geologiya v razvivayuchemsya mire [Geology in the developing world], vo. 2, pp. 131-134. THE INFLUENCE OF EXTERNAL FACTORS ON AGGREGATE STABILITY OF CLAY SUSPENSIONS K.A. Alvanian, N.A. Medvedeva, N.А.Dracheva, P.S. Poturaev, A.D. Metlyakov Perm Stare University. 15, Bukirev st., Perm, 614990 E-mail: nata-kladova@yandex.ru The electrokinetic characteristics of clay suspensions of various deposits of the Urals are studied. The influence of external factors (acidity, presence of electrolytes and their combined effect) on the electrokinetic potential was determined. The potential energy of interaction (electrostatic repulsion and molecular attraction) of clay mineral particles under different conditions is calculated. Keywords: electrokinetic potential, potential energy, kaolinite, montmorillonite, aggregate stability, DLFO theory
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||