Типы взаимодействия в молекулах. Внутримолекулярные связи
 Скачать 182.83 Kb. Скачать 182.83 Kb.
|
|
Внутримолекулярные связи Атомы могут объединяться, приобретая и теряя электроны (ионная связь) или разделяя электроны (ковалентная связь). Ионная связь: Ионная связь образуется между металлом и неметаллом; Металл имеет почти пустую внешнюю оболочку и теряет электроны, образуя положительно заряженный катион; Неметалл имеет почти полную внешнюю оболочку и поэтому получает электроны, образуя отрицательно заряженный анион; 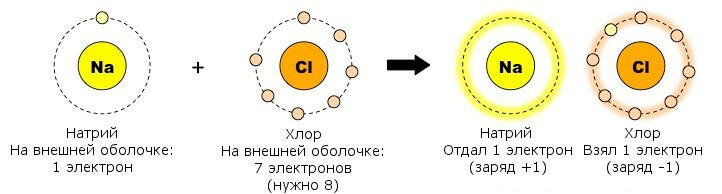 Результирующий заряд этих двух ионов создает сильное электростатическое притяжение между ними - ионную связь. Результирующий заряд этих двух ионов создает сильное электростатическое притяжение между ними - ионную связь.Ковалентная связь: Ковалентная связь образуется между двумя неметаллами; Поскольку оба атома имеют большое количество электронов во внешней оболочке, потерять или получить так много не представляется возможным, и поэтому они разделяют связь; Количество ковалентных связей, которые могут быть сформированы, отражает количество недостающих электронов из внешней оболочки (например, углероду требуется четыре электрона, и поэтому он может образовывать четыре ковалентные связи); Поскольку ионного заряда нет, ковалентные молекулы не так сильно притягиваются друг к другу, как ионные молекулы (ковалентные связи слабее). 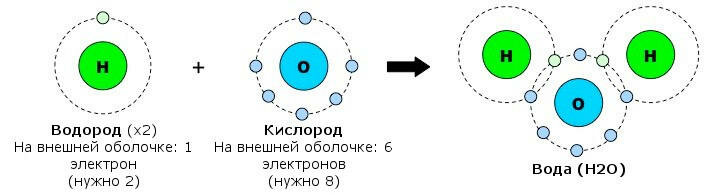 Межмолекулярные связи Атомы из одной молекулы могут привлекать атомы из другой молекулы - эти связи намного слабее, чем внутримолекулярные связи. Водородная связь: Ковалентное распределение электронов между атомами не всегда может быть одинаковым и будет зависеть от: - количества протонов в атоме (чем больше протонов, тем больше притяжение для электронов); - количества электронных оболочек в атоме (электроны, находящиеся на большем расстоянии от ядра, меньше притягиваются к ядру). Считается, что атомы, которые имеют более сильное сродство к электронам, имеют более высокую электроотрицательность; Ковалентно распределенные электроны будут вращаться по орбите ближе к атомам с более высокой электроотрицательностью, что приведет к небольшой разнице в заряде. Эти молекулы являются полярными и могут образовывать слабые электростатические взаимодействия с другими полярными молекулами. Полярные ассоциации между атомом H одной молекулы и атомом F, O или N другой молекулы называются водородными связями. 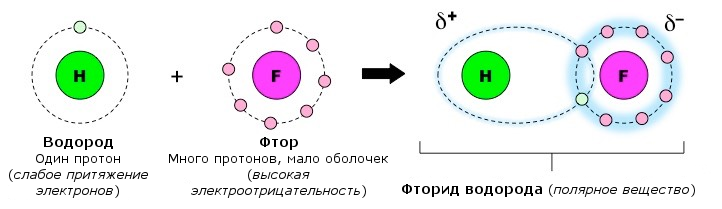 Межмолекулярное взаимодействие — это электромагнитное взаимодействие электронов и ядер одной молекулы с электронами и ядрами другой молекулы. Сила этого взаимодействия зависит от расстояния между молекулами и их взаимной ориентации. Различают три типа межмолекулярного взаимодействия, схематично представленные на рис. 3.22: ориентационное, индукционное и дисперсионное. Ориентационное (диполъ-диполъное) взаимодействие — это взаимодействие между полярными молекулами. При сближении полярные молекулы ориентируются относительно друг друга противоположно заряженными концами диполей с возникновением связи (рис. 3.22, а). Чем более полярны молекулы, тем прочнее химическая связь. С повышением температуры ориентационное взаимодействие ослабляется, так как усиление теплового движения молекул нарушает их ориентацию. 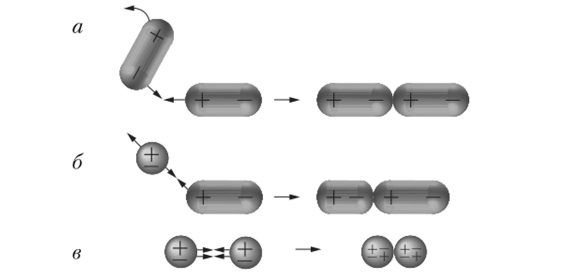 Индукционное взаимодействие — это взаимодействие между полярными и неполярными молекулами. При этом полярные молекулы деформируют электронное облако неполярных молекул, вызывая возникновение у них временного (наведенного или индуцированного) электрического момента диполя. Способность молекул (и других химических частиц) к поляризации за счет смещения электронов и атомов иод воздействием внешнего электрического поля определяется их поляризуемостью (а), которая измеряется относительной деформацией частицы, отнесенной к единице напряженности электрического поля. Впоследствии молекулы взаимодействуют по механизму ориентационного взаимодействия как диполи (рис. 3.22, б). Энергия этого взаимодействия значительно меньше энергии ориентационного (диполь-дипольного) взаимодействия. Дисперсионное взаимодействие — это взаимодействие между неполярными молекулами. Механизм этого взаимодействия может быть описан следующим образом. Вследствие движения электронов у некоторых молекул может происходить небольшая мгновенная деформация электронного облака, создающая асимметрию в распределении зарядов. Возникает небольшой, существующий очень короткое время, диполь. Между этим диполем и соседней молекулой возникает взаимодействие, приводящее к появлению в ней мгновенного наведенного (индуцированного) диполя. Впоследствии образовавшиеся таким образом диполи взаимодействуют между собой (рис. 3.22, в). Все три типа межмолекулярного взаимодействия часто называют вандерваальсовыми силами (по имени голландского ученого Я. Д. Ван-дер-Ваальса, который впервые принял их во внимание для объяснения свойств реальных газов) Донорно-акцепторное взаимодействие, как отмечалось ранее, приводит к образованию ковалентной полярной связи, т.е. относится к химическим видам взаимодействия. Донорно-акцепторное взаимодействие объясняет образование комплексных соединений. Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений. |
