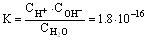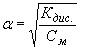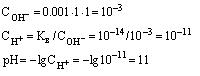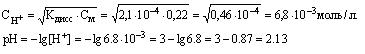Рн. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ. Водородный показатель (РН)
 Скачать 101.78 Kb. Скачать 101.78 Kb.
|
УчительскаяМетодические находкиВ школьной программе появилось новое понятие. Это pH - водородный показатель кислотности среды. Ну и правильно, ведь про этот загадочный "пэ аш" то и дело вещает телевизор - то в рекламе зубной пасты, то в сообщениях о самой лучшей косметике, то в экологических новостях ("кислотные дожди"). Важнейшее понятие химии, количественно описывающее кислотность или щелочность растворов... Конечно, школьники должны знать, что это такое. Вот только незадача: для определения рН требуется знание логарифмов. А в программе по математике эта тема отнесена обычно на второе полугодие 11-го класса. Ну как тут быть учителю химии??? Возможный выход указывает глава из учебника химии Савинкиной и Логиновой, который скоро выйдет в свет в издательстве АСТ-ПРЕСС. Эта глава так и называется: Водородный показатель (рН)В воде всегда присутствует немного катионов водорода и гидроксид-ионов, которые образуются в результате обратимой диссоциации: H2O В 1 л чистой воды при комнатной температуре содержится 1 .10-7 моль катионов водорода и 1 .10-7 моль гидроксид-ионов. Поскольку оперировать числами такого порядка неудобно, для количественной характеристики кислотности среды используют так называемый водородный показатель рН ("пэ аш", от латинского "pundus hydrogenium" - "вес водорода"). Каждое значение рН отвечает определенному содержанию катионов водорода в 1 л раствора. В чистой воде и в нейтральных растворах, где в 1 л содержится 1 .10-7 моль катионов водорода, значение рН равно 7. В растворах кислот содержание катионов водорода увеличивается, а содержание гидроксид-ионов уменьшается, в растворах щелочей наблюдается обратная картина. В соответствии с этим меняется и значение водородного показателя (рН). Кислоты, попадая в воду, диссоциируют, и содержание катионов водорода в расчете на 1 л раствора становится больше 1 .10-7 моль. Сильные кислоты в водной среде диссоциируют необратимо. Например, хлороводородная кислота полностью превращается в катионы водорода H+ и хлоридные анионы Cl-: HCl = H+ + Cl- Если в 1 л водного раствора содержится 1 .10-2 моль HCl, то катионов водорода H+ в этом объеме тоже 1 .10-2 моль. Значение водородного показателя (рН) для этого раствора оказывается равным 2. Когда в том же объеме раствора содержится 1 .10-3 моль HCl, то катионов H+ становится уже 1 .10-3 моль (рН = 3), если хлороводородной кислоты 1 .10-4 моль, то содержание H+ - 1 .10-4 моль (рН = 4), и т.д. Диссоциация слабых кислот, например угольной, протекает обратимо: H2CO3 Далеко не все присутствующие в растворе молекулы H2CO3 превращаются в катионы H+ и анионы HCO3-. Тем не менее катионов H+ в растворах таких кислот больше, чем в чистой воде (например, 1 .10-5 или 1 .10-6 моль в каждом литре раствора). Таким образом, в растворах кислот катионов водорода в 1 л раствора содержится всегда больше, чем 1 .10-7, а рН оказывается меньше 7. Водородный показатель рН, меньший 7, отвечает кислотной среде раствора. Если рН находится в интервале 5-7, то среда раствора считается слабокислотной, если рН меньше 5, то сильнокислотной: чем сильнее кислота, тем ниже значение рН. В результате диссоциации оснований в водном растворе появляются гидроксид-ионы, которые связывают катионы водорода, присутствующие в чистой воде, и уменьшают их количество в щелочном растворе: NaOH = Na+ + OH- H+ + OH- = H2O Растворение в 1 л воды 1 .10-2 моль сильного основания - гидроксида натрия NaOH - приводит к появлению 1 .10-2 моль гидроксид-ионов. Содержание катионов водорода в полученном растворе оказывается равным 1 .10-12 моль, а рН принимает значение 12. Если в 1 л воды растворить 1 .10-3 моль NaOH, то гидроксид-ионов получится 1 .10-3 моль (1 .10-11 моль катионов H+, рН = 11). Растворение в том же объеме 1 .10-4 моль NaOH даст 1 .10-4 моль OH- (1 .10-10 моль катионов H+, рН = 10), и т.д. Таким образом, в растворах оснований содержание катионов водорода всегда меньше 1 .10-7 моль в 1 л, а водородный показатель (рН) - больше 7. Среда в таких растворах щелочная. Для растворов сильных оснований, диссоциация которых идет необратимо, значение рН будет существенно выше 7. Диссоциация слабых оснований, например, гидрата аммиака, протекает лишь частично, гидроксид-ионов в этом случае образуется меньше, и рН не столь заметно превышает значение, характерное для нейтральной среды. Раствор считается слабощелочным при рН от 7 до 9 и сильнощелочным при рН выше 9. Значения водородного показателя (рН) водных растворов распространенных веществ обычно находятся в интервале от 1 до 13. Приближенно оценить рН растворов можно с помощью кислотно-основных индикаторов. Для более точного измерения водородного показателя используют приборы - рН-метры. Упражнения 1. Каковы значения рН а) в нейтральных; б) слабокислотных; в) слабощелочных; г) сильнокислотных; д) сильнощелочных растворах? 2. Какова среда а) в растворе шампуня (рН 5,5); б) в крови здорового человека (рН 7,4); в) в желудочном соке человека (рН 1,5); г) в слюне (рН 8,0)? 3. Напишите уравнения реакций, протекающих при растворении в воде а) угольной кислоты; б) серной кислоты; в) гидроксида натрия; г) аммиака. В каком из полученных растворов значение рН должно быть больше (при одинаковых молярных содержаниях растворенных веществ)?
Водородный показатель , pH, отрицательный десятичный логарифм концентрации (точнее, активности) ионов водорода (в г-ион/л) в данном растворе: В. п. служит количественной характеристикой кислотности растворов, которая оказывает существенное влияние на направление и скорость многих химических и биохимических процессов. При обычных температурах (точнее, при 22 °С) pH = 7 для нейтральных, pH < 7 для кислых и pH > 7 для щелочных растворов. Точное измерение и регулирование pH необходимо как при лабораторных химических и биохимических исследованиях, так и в многочисленных промышленных технологических процессах, а также при оценке свойств почвы и проведении мероприятий по повышению её плодородия. Вода диссоциирует на ионы по уравнению По действующих масс закону: где с — молярные концентрации, а К — постоянная при данной температуре величина (1,8·10-16 г-ион/л при 22 °С). В 1 л воды содержится (количество диссоциировавших молекул настолько мало, что его можно не учитывать). Поэтому Константу КВ называют ионным произведением воды. Поскольку в чистой воде (и в любой нейтральной среде) то При добавлении к воде кислот cH+ возрастает, а pH соответственно уменьшается. Так, для 0,01 молярного (М) раствора HCl концентрация cH+ = 10-2 и pH = —lgcH+ = 2. Наоборот, при добавлении щелочей возрастает cOH-; тогда уменьшается и соответственно возрастает pH. Например, в 0,01 М растворе NaOHcOH- = 10-2. Это значит, что и pH = 12. Для точных определений pH используют преимущественно методы потенциометрии (см. Электрохимические методы анализа). При определениях, не требующих высокой точности, pH измеряют б. ч. с помощью набора индикаторов, меняющих свою окраску каждый при определённом pH. Шкала pH обычно используется для растворов, имеющих концентрации ионов водорода от 1 г-ион/л и меньше. Нейтральным водным растворам отвечает pH = 7 лишь при комнатных температурах. При повышении температуры диссоциация воды усиливается, KB возрастает, и при 100 °С чистая вода имеет pH " 6. При температурах ниже 22 °С в чистой воде pH > 7. При этом во всех случаях в нейтральной среде cH+ = cOH-. |