Вопросы к экзамену Неорганика 1-9. Вопросы к экзамену первой части курса Общая и неорганическая химия
 Скачать 39.9 Kb. Скачать 39.9 Kb.
|
|
Вопросы к экзамену первой части курса «Общая и неорганическая химия» 1. Атом – наименьшая частица химического элемента. Число Авогадро. Относительные массы атомов. Углеродная шкала атомных масс. Абсолютные массы атомов. Атом — мельчайшая химически неделимая электронейтральная частица вещества, состоящая из положительного ядра и отрицательных электронов. Ядро состоит из +протонов и 0нейтронов. Ядра не изменяются в химических реакциях. Атомы редко встречаются в изолированном виде. Обычно они соединяются друг с другом в молекулы или более крупные структуры. Число Авогадро – это постоянная, которая обозначает сколько содержится частиц (молекул, формульных единиц, атомов, ионов) в 1 моль любого вещества (6,02*1023). Моль – количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода. Относительная атомная масса (Ar) – это безразмерная величина, которая показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода. Абсолютная масса атома (m) – произведение относительной атомной массы на а.е.м. (1/12 массы свободного покоящегося изотопа углерода с массовым числом 12 = 1,66057*10-27кг). Именно поэтому шкала атомных масс называется углеродной, так как новый расчёт абсолютных атомных масс идёт по углероду. 2. Составные части атомов – электроны и ядро, их заряды и массы. Состав атомного ядра – протоны и нейтроны, их заряд и масса. Понятие об изотопах и изобарах. Атом – электронейтральная система, состоящая из ядра и электронной оболочки. Ядро состоит из +заряженных протонов и 0заряженных нейтронов. Ядро находится в центре атома, маленькое по сравнению с ним, имеет высокую плотность и в химических реакциях неизменно. Ядро атом составляет всю массу атома, так как масса протонов равна массе нейтронов и составляет 1,6726*10-27кг. Вокруг ядра вращаются –заряженные электроны, которые. Они находятся в постоянном движении вокруг ядра и образую электронную оболочку (электронное облако). Все e-ны распределены по энергетическим уровням, а начиная со второго энергетические уровни делятся на подуровни (орбитали), по которым непосредственно движутся электроны. Изотопы - разновидности атомов одного и того же химического элемента, имеющие одинаковый заряд ядра (число протонов), но разное число нейтронов. (Водород: протий – 1 p, дейтерий – 1 p, 1 n, тритий – 1 p, 2 n). Изобары – это нуклиды, имеющие одинаковые массовые числа, но различное число протонов (то есть относящиеся к различным химическим элементам). 40Ar (изотоп), 40K (изотоп), 40Ca. 3. Неприменимость законов классической физики к описанию движения микрочастиц. Двойственная природа света. Фотоны. Взаимосвязь массы и энергии. Уравнение Эйнштейна. Корпускулярно-волновой дуализм материи. Уравнение де-Бройля. Классическая электродинамика постулирует, что движущийся с ускорением заряд является источником «уносящих» энергию электромагнитных волн. Проводя опыт Резерфорда с потоком альфа-частиц, и основываясь на законах классической электродинамики электроны должны «растерять» энергию, что привело бы к нарушению устойчивости атомных систем без излучения электромагнитных волн. Но этого не происходит. Данный факт отражает ограниченность применения законов классической физики к описанию микромира. В основе современной теории строения атома лежит представление о двойственной природе микрообъектов — они могут проявлять себя как частицы и как волны, т.е. микрообъекты обладают корпускулярными и волновыми свойствами. В этом и заключается также двойственная природа света. Основополагающей в квантовой механике есть идея о том, что корпускулярно-волновая двойственность свойств, установленная для света, проявляется и для любых частиц, обладающих импульсом (p). Все частицы, имеющие конечный импульс (p), обладают волновыми свойствами, и их движение сопровождается некоторым волновым процессом. Формула де Бройля устанавливает зависимость длины волны 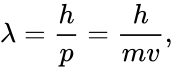 где С помощью теории относительности Эйнштейн вывел формулу связи массы и энергии. 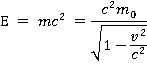 Энергия тела или системы тел равна массе, умноженной на квадрат скорости света. Таким образом, изменение энергии системы приводит к изменению массы системы. Важно отметить, что небольшие изменения энергии влекут за собой такие же малые изменения массы. Корпускулярно - волновой дуализм света. Свет представляет собой совокупность различных волн, но в большей степени электромагнитных. Электромагнитное излучение имеет квантовый характер, т. е. излучается и поглощается веществом в виде отдельных частиц электромагнитного поля – фотонов. Поэтому свет проявляет свойства как частицы, так и волны. Т.к. фотон всегда движется, причем только со скоростью света, мы можем на основе уравнений де-Бройля и Эйнштейна найти массу и энергию фотона. Масса фотона: Согласно теории относительности E=mc2, E=hν, где E – полная энергия объекта, m – его масса, c – скорость света в вакууме А энергия фотона: 4. Характеристика энергетического состояния электрона в атоме четырьмя квантовыми числами. Главное квантовое число как основная энергетическая характеристика электрона в атоме. Главное квантовое число и размеры электронного облака. Любой электрон в атоме и его энергетической состояние можно описать четырьмя квантовыми числами: главным кв.ч.(n), побочным (орбитальным) кв.ч.(l), магнитным (ml) и спиновым (ms). Главное квантовое число (n) принимает значение целых чисел (1-7+∞), характеризует номер энергетического уровня и запас энергии электрона: чем дальше e от ядра, тем запас энергии больше и тем больше по размеру орбиталь этого электрона. Т.к. размер орбиталей зависит от энергии электрона. Чем больше энергия электрона (т.е. главное кв.ч.), тем больше по размеру его орбиталь. 5. Орбитальное квантовое число, его физический смысл и возможные значения. Форма электронного облака для s-, p- и d-состояний электрона. Орбитальное квантовое число (или побочное - l) – принимает значения от 0 до (n-1) и характеризует форму электронного облака. Существует 4 формы электронных облаков: s – шарообразная (имеет 1 пространственную ориентацию и соответствует побочному кв. ч. l=0), p – гантелеобразная (3 прост. ор.; l=1), d – четырёхлопостная (5 прост. ор.; l=2), f – имеет сложно строение (7 прост. ор.; l=3). 6. Магнитное квантовое число, его физический смысл и возможные значения. Ориентация p- и d-электронных облаков в пространстве. Магнитное квантовое число (ml) – принимает значения от –l до +l, характеризует пространственную ориентацию электронного облака. s (1 прост. ор.; ml = 0), p (3; ml = -1,0,+1), d (5; ml = -2,-1,0,+1,+2), f (7; ml = -3,-2,-1,0,+1,+2,+3). 7. Спиновое квантовое число, его физический смысл и возможные значения. Спиновое квантовое число (ms) – принимает значения +1/2 и -1/2, характеризует направление вращения электрона. Если электрон вращается по часовой стрелке, то его спиновое кв.ч. будет равно +1/2 и в электронной диаграмме он будет обозначаться стрелкой вверх. Если e вращается против часовой стрелки, то его спиновое кв.ч. будет равно -1/2 и в электронной диаграмме он будет обозначаться стрелкой вниз. 8. Многоэлектронные атомы. Принцип Паули. Максимальное число электронов в энергетических ячейках (атомных орбиталях), в электронных оболочках и слоях. Правило Хунда. Многоэлектронный атом - это атом отличный от атома водорпода (т.е. в котором 2 и более электронов). При этом в таких атомах отсутствует вырождение электронов, т.е. они не одинаковы по энергии в пределах одного значения главного квантового числа, потому что электроны, занимающие различные подуровни, отличаются друг от друга по энергии. Заполнение электронных оболочек атомов определяется, главным образом, принципом Паули и правилом Хунда. Принцип Паули. В атоме нет хотя бы 2-ух электронов, у которых все кв. числа совпадают. В атоме будут заполняться все орбитали в порядке увеличения энергии электрона. Принцип Паули дает возможность рассчитать «емкость» электронных уровней и подуровней, которая оказывается равной числу соответствующих электронных состояний. Правило Хунда. В пределах одного подуровня электроны размещаются так, чтобы их суммарный спин был максимальным. Определяет порядок заполнения подуровней Максимальное число электронов на подуровне определяется количеством пространственных ориентаций данной орбитали. Соответственн, одна орбиталь вмещает в себя 2 электрона, тогда на s уровне макс. 2 электрона, на p – 6 электронов, на d – 10, на f – 14. Максимальное число электронов в электронном слое определяется по формуле  , где n – номер периода. , где n – номер периода.9. Периодическая система элементов и ее связь со строением атомов. Периодические и непериодические свойства элементов. Физический смысл порядкового номера элемента в системе. Современная формулировка периодического закона. Главной характеристикой атома является не атомная масса, а величина положительного заряда ядра. Это более точная характеристика атома, а значит, и элемента. От величины заряда ядра атома зависят все свойства элемента и его положение в периодической системе. Таким образом, порядковый номер химического элемента численно совпадает с зарядом ядра его атома, а периодическая система элементов является графическим изображением периодического закона и отражает строение атомов элементов (количество валентных электронов, энергетических уровней, зависимость атомного радиусов, кислотно-основных свойств, ЭО и т.д.). Современная формулировка периодического закона гласит: «Свойства химических элементов и их соединений находятся в периодической зависимости от зарядов атомных ядер». Периодические свойства элементов: - атомный радиус (→уменьш., ↓увеличив.) - ЭО (→ увел., ↓уменьш.) - неметал. св-ва (→ увел., ↓уменьш.) - метал. св-ва (→уменьш., ↓увеличив.) - кислотные (→ увел., ↓уменьш.) - основные (→ уменьш., ↓увеличив.) - энергия ионизации - величина энергии, которая затрачивается для отрыва одного электрона от нейтрального атома в основном состоянии (→ увел., ↓уменьш.) - сродство к электрону (энергия сродства к электрону) – энергия, выделяющаяся в процессе присоединения электрона к атому, молекуле, радикалу (→ увел., ↓уменьш. также как и окислительные св-ва) Непериодический свойства - это свойства элементов, которые с порядковым номером изменяются монотонно. К их числу относятся, например, удельная теплоемкость простых веществ, частоты линий рентгеновского спектра 10. Последовательность заполнения электронных оболочек и слоев в атомах. Принцип наименьшей энергии, правило Клечковского. Способы изображения электронных структур атомов. 11. Периоды, группы, подгруппы и семейства s-, p-, d- и f-элементов с точки зрения электронного строения атомов. Объяснение различной длины периодов. Длинно- и короткопериодный варианты системы. 12. Периодические свойства атомов. Радиусы (размеры) атомов и ионов и их изменение по периодам и группам периодической системы. d- и f-сжатие. 13. Энергия ионизации атомов и ее изменение по периодам и группам периодической системы. 14. Сродство к электрону, электроотрицательность атомов, их изменение по периодам и группам периодической системы. 15. Основные характеристики химической связи (энергия, длина, валентные углы). 16. Основные положения метода валентных связей (метода ВС). Типы перекрываний электронных облаков при образовании - и -связей. 17. Донорно-акцепторный механизм образования ковалентной связи. Строение ионов NH4+ и BF4-. Максимальная ковалентность атомов элементов II и III периодов периодической системы и d-элементов. 18. Направленность ковалентной химической связи. Образование связей за счет s- и p-электронных облаков. Строение молекул H2S и PH3. Углы связей в этих молекулах. 19. sp-, sp2 и sp3-гибридизации. Форма и пространственное расположение гибридных электронных облаков. Строение молекул BeH2, BF3, CH4. Углы связей в этих молекулах. 20. Участие неподеленных электронных пар в гибридизации. Строение молекул NH3 и H2O. Углы связей в этих молекулах. Гибридизация с участием d-орбиталей. Строение молекул PF5 и SF6. Углы связей в этих молекулах. 21. Одинарные и кратные химические связи. - и -связи. Строение молекул C2H6, C2H4, C2H2, N2. Влияние кратности связи на ее энергию и межъядерное расстояние. 22. Ионная химическая связь. Ненаправленность и ненасыщаемость ионной связи. Структура ионных соединений. Простейшие типы взаимной координации ионов в кристаллах. 23. Ковалентная химическая связь. Неполярная ковалентная связь и ионная связь как крайние случаи полярной ковалентной связи. 24. Металлическая связь. Межмолекулярное взаимодействие (ориентационное, индукционное, дисперсионное). Примеры. 25. Водородная связь как особый случай межмолекулярного взаимодействия. 26. Энергетика химических процессов. Внутренняя энергия и энтальпия. Тепловой эффект реакции. Теплота (энтальпия) образования химического соединения. Закон Гесса и следствия из него. 27. Понятие об энтропии. Изменение энтропии при фазовых превращениях (испарении, конденсации, плавлении, кристаллизации) и в химических реакциях. 28. Понятие о свободной энергии Гиббса (изобарно-изотермическом потенциале). Связь свободной энергии Гиббса с тепловым эффектом реакции и изменением энтропии. Критерии возможности и невозможности протекания химической реакции. 29. Химическая кинетика. Скорость химической реакции. Средняя и истинная (мгновенная) скорость. Единицы измерения. Факторы, влияющие на скорость химической реакции. 30. Зависимость скорости химической реакции от концентраций реагирующих веществ. Закон действия масс. Константа скорости реакции. Молекулярность и порядок реакции. Влияние давления на скорость реакции. 31. Зависимость скорости химической от температуры. Правило Вант-Гоффа. Температурный коэффициент скорости реакции. Энергия активации. Уравнение Аррениуса. 32. Явление катализа. Катализаторы и ингибиторы. Механизм гомогенного катализа (теория образования промежуточных соединений). 33. Обратимые и необратимые реакции. Химическое равновесие. Константа равновесия. Вывод выражения для Кр и ее физический смысл. Равновесные концентрации компонентов, их расчет. 34. Сдвиг (смещение) химического равновесия. Принцип Ле-Шателье, его формулировка и применение для объяснения смещения химического равновесия при изменении концентраций веществ, температуры и давления. 35. Степень диссоциации электролита и ее зависимость от природы электролита, концентрации раствора и температуры. Сильные и слабые электролиты. 36. Диссоциация слабых электролитов. Константа диссоциации. Закон разбавления Оствальда. Ступенчатая диссоциация. Влияние одноименного иона на диссоциацию слабого электролита. 37. Электролитическая диссоциация молекул воды. Ионное произведение воды. Нейтральные, кислые и щелочные растворы. Водородный и гидроксильный показатели рН и рОН. Буферные растворы. Способы выпажения концентрвции растворов 38. Гетерогенные равновесия в растворах электролитов. Произведение растворимости малорастворимого электролита. Расчет ПР по растворимости и наоборот. Влияние одноименного иона на растворимость малорастворимого электролита. Условие образования и растворения осадков. 39. Гидролиз солей. Типичные случаи гидролиза (привести примеры). Степень гидролиза соли, ее зависимость от природы соли, концентрации раствора и температуры. 40. Особые случаи гидролиза солей (полный гидролиз, совместный гидролиз двух солей). Привести примеры. константы гидролиза со степенью гидролиза соли и концентрацией раствора. 41. Окислительно-восстановительные реакции. Степень окисления атомов в соединениях, ее вычисление. Процессы окисления и восстановления. Окислители и восстановители и их классификация. 42. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Реакции в кислых, нейтральных и щелочных растворах. Составление уравнений окислительно-восстановительных реакций методом электронного баланса. Привести примеры. 43. Типы окислительно-восстановительных реакций (межмолекулярного окисления-восстановления, диспропорционирования, внутримолекулярного окисления-восстановления). Привести примеры. 44. Комплексные соединения. Строение. Номенклатура. Классификация. |
