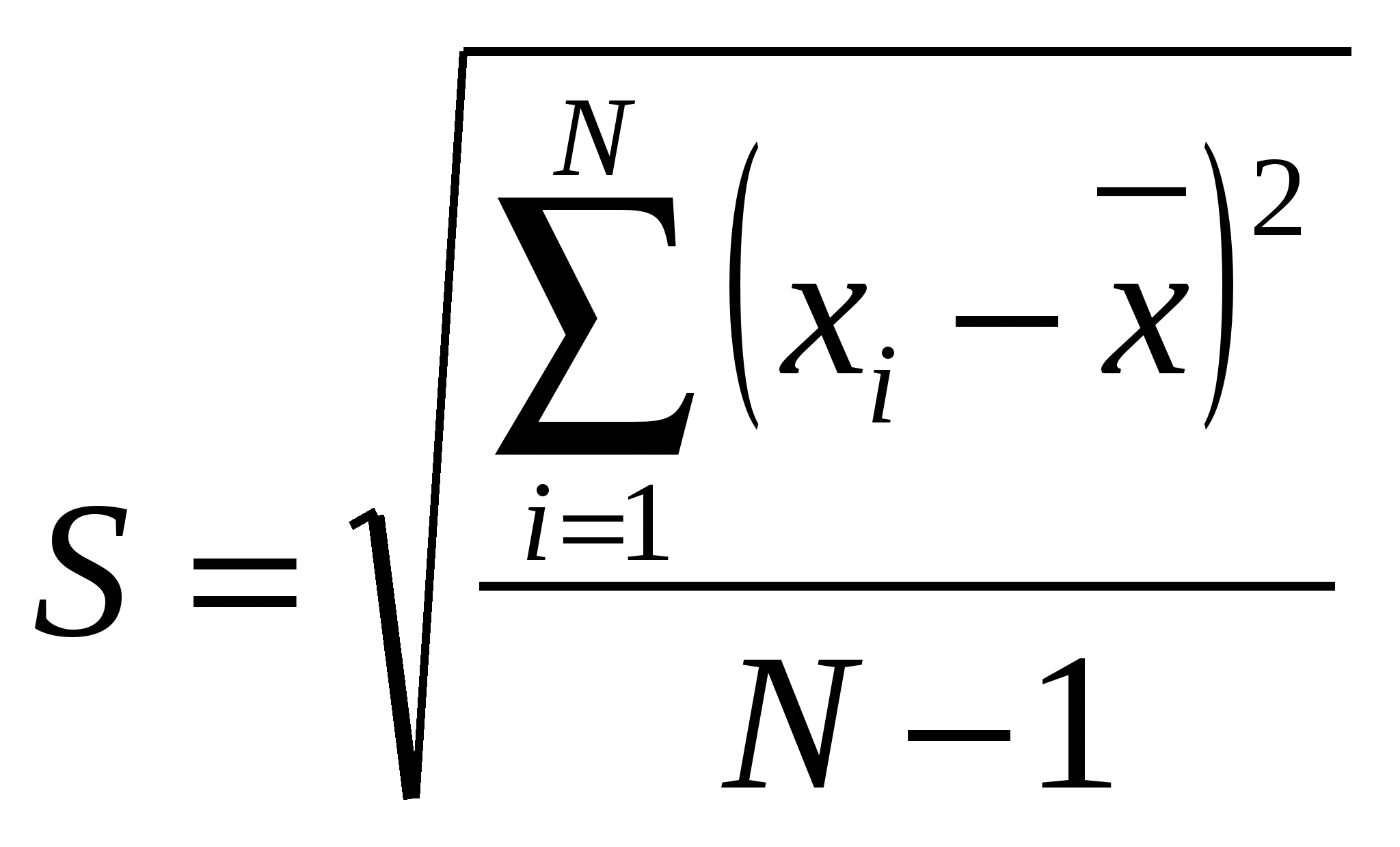вопросы по дисциплине методам для среза. Вопросы по дисциплине Методы средства контроля ос
 Скачать 212 Kb. Скачать 212 Kb.
|
1 2
S , |
| Спектральный диапазон поглощённой части, нм | Цвет поглощённой части света | Кажущийся цвет (дополнительный) |
| 400 - 450 | Фиолетовый | Жёлто-зелёный |
| 450 - 480 | Синий | Жёлтый |
| 480 - 490 | Зелёно-синий | Оранжевый |
| 490 - 500 | Сине-зелёный | Красный |
| 500 - 560 | Зелёный | Пурпурный |
| 560 - 575 | Жёлто-зелёный | Фиолетовый |
| 575 - 590 | Жёлтый | Синий |
| 590 - 625 | Оранжевый | Зелёно-синий |
| 625 - 750 | Красный | Сине-зелёный |
Фотометрические методы анализа высоко чувствительны и избирательны, а используемая в них аппаратура разнообразна. Эти методы широко применяются:
в системах автоматического контроля технологических процессов и готовой продукции;
при анализе исходных материалов в химической и металлургической промышленности, а также горных пород и природных вод;
при контроле продукции в сертификационных лабораториях,;
при экологической проверке состояния окружающей среды (воздуха, почвы, воды);
при диагностировании состояния людей и животных;
при определении примесей (10-4 – 10-6 %) в веществах высокой чистоты.
6. Хроматографические методы анализа. Хроматография
1. Хроматография (от греч. chroma, chromatos - цвет, краска), физико-химический метод разделения и анализа смесей, основанный на распределении их компонентов между двумя фазами - неподвижной и подвижной (элюент), протекающей через неподвижную. Хроматографический анализ является критерием однородности вещества: если каким-либо хроматографическим способом анализируемое вещество не разделилось, то его считают однородным (без примесей).
Принципиальным отличием хроматографических методов от других физико-химических методов анализа является возможность разделения близких по свойствам веществ. После разделения компоненты анализируемой смеси можно идентифицировать (установить природу) и количественно определять (массу, концентрацию) любыми химическими, физическими и физико-химическими методами.
История метода:
Хроматографический метод анализа был впервые применён русским учёным-ботаником Михаилом Семеновичем Цветом в 1900 году. Он использовал колонку, заполненную карбонатом кальция для разделения пигментов растительного происхождения.
Хроматография широко применяется в лабораториях и в промышленности для качественного и количественного анализа многокомпонентных систем, контроля производства, особенно в связи с автоматизацией многих процессов, а также для препаративного (в т. ч. промышленного) выделения индивидуальных веществ (например, благородных металлов), разделения редких и рассеянных элементов.
В некоторых случаях для идентификации веществ используется хроматография в сочетании с другими физико-химическими и физическими методами, например с масс-спектрометрией, ИК-, УФ-спектроскопией и др. Для расшифровки хроматограмм и выбора условий опыта применяют ЭВМ.
Основные достоинства хроматографического анализа:
экспрессность; высокая эффективность; возможность автоматизации и получение объективной информации;
сочетание с другими физико-химическими методами;
широкий интервал концентраций соединений;
возможность изучения физико-химических свойств соединений;
осуществление проведения качественного и количественного анализа;
применение для контроля и автоматического регулирования технологических процессов.
В зависимости от природы взаимодействия, обусловливающего распределение компонентов между элюентом и неподвижной фазой, различают следующие основные виды хроматографии - адсорбционную, распределительную, ионообменную, эксклюзионную (молекулярно-ситовую) и осадочную.
Адсорбционная хроматография основана на различии сорбируемости разделяемых веществ адсорбентом (твёрдое тело с развитой поверхностью);
- распределительная хроматография - на разной растворимости компонентов смеси в неподвижной фазе (высококипящая жидкость, нанесённая на твёрдый макропористый носитель) и элюенте;
- ионообменная хроматография - на различии констант ионообменного равновесия между неподвижной фазой (ионитом) и компонентами разделяемой смеси;
- эксклюзионная (молекулярно-ситовая) хроматография - на разной проницаемости молекул компонентов в неподвижную фазу (высокопористый неионогенный гель).
- Осадочная хроматография основана на различной способности разделяемых компонентов выпадать в осадок на твёрдой неподвижной фазе.
В соответствии с агрегатным состоянием элюента различают:
газовую хроматографию ГХ (GC)
жидкостную хроматографию ВЭЖХ (HPLC).
Газовая хроматография применяется для газов разделения, определения примесей вредных веществ в воздухе, воде, почве, промышленных продуктах; определения состава продуктов основного органического и нефтехимического синтеза, выхлопных газов, лекарственных препаратов, а также в криминалистике и т.д.
Жидкостная хроматография используется для анализа, разделения и очистки синтетических полимеров, лекарственных препаратов, детергентов, белков, гормонов и др. биологически важных соединений. Использование высокочувствительных детекторов позволяет работать с очень малыми количествами веществ (10-11-10-9 г), что исключительно важно в биологических исследованиях.
В зависимости от агрегатного состояния неподвижной фазы газовая хроматография ГХ (GC) бывает газо-адсорбционной (неподвижная фаза - твёрдый адсорбент) и газожидкостной (неподвижная фаза - жидкость), а жидкостная хроматография - жидкостно-адсорбционной (или твёрдо-жидкостной) и жидкостно-жидкостной.
Различают колоночную и плоскостную хроматографию. В колоночной сорбентом заполняют специальные трубки - колонки, а подвижная фаза движется внутри колонки благодаря перепаду давления. Разновидность колоночной хроматографии - капиллярная, когда тонкий слой сорбента наносится на внутренние стенки капиллярной трубки.
Плоскостная хроматография подразделяется на тонкослойную и бумажную.
- в тонкослойной хроматографии тонкий слой гранулированного сорбента или пористая плёнка наносится на стеклянную или металлическую пластинки;
- в случае бумажной хроматографии используют специальную хроматографическую бумагу. Тонкослойная (ТСХ) и бумажная хроматография используются для анализа жиров, углеводов, белков и др. природных веществ и неорганических соединений.
Ряд видов хроматографии осуществляется с помощью приборов, называемых хроматографами, в большинстве из которых реализуется проявительный вариант хроматографии. Хроматографы используют для анализа и для препаративного (в т. ч. промышленного) разделения смесей веществ. При анализе разделённые в хроматографической колонке вещества вместе с элюентом попадают в установленное на выходе из колонки специальное устройство – детектор, регистрирующее их концентрации во времени.
Полученную в результате этого выходную кривую называют хроматограммой.
Для качественного хроматографического анализа определяют время от момента ввода пробы до выхода каждого компонента из колонки при данной температуре и при использовании определённого элюента.
Для количественного анализа определяют высоты или площади хроматографических пиков с учётом коэффициентов чувствительности используемого детектирующего устройства к анализируемым веществам.
Принципы и классификация
Хроматографический метод основан на распределении вещества между двумя несмешивающимися фазами, одна из фаз подвижна — ПФ, а другая неподвижна — НФ. Метод можно представить как процесс многократного повторения фактов сорбции и десорбции вещества при движении его в потоке ПФ вдоль неподвижного сорбента — НФ, это наблюдается при прохождении потока газов, паров, жидкостей через колонку, содержащую зернённый слой сорбента.
Подвижной фазой является смесь, она может быть жидким раствором или газовой смесью, неподвижной фазой является сорбент твёрдый с большой поверхностью, сорбент может быть жидким, нанесённый тонкой плёнкой на поверхность твёрдого носителя.
Хроматографические методы анализа получили широкое распространение благодаря соей универсальности, экспрессивности и высокой чувствительности. Применяется широко в различных областях промышленности, науки и техники, в экологии, медицине, биологии, криминалистке и т.д.
Классификация хроматографических методов анализа
I. По агрегативному состоянию подвижной фазы:
А) Газовая хроматография — подвижная жидкость – газ.
Б) Жидкостная хроматография — подвижная фаза — жидкость.
При этом возможны следующие варианты:
| № п/п | Наименование метода | Неподвижная фаза | Подвижная фаза |
| 1 | Газо-адсорбционная хроматография | Твёрдая | Газовая |
| 2 | Газо-жидкостная хроматография | Жидкая на твёрдом носителе | Газовая |
| 3 | Жидкостная адсорбционная хроматография | Твёрдая | Жидкая |
| 4 | Жидкостная распределительная хроматография | Жидкий поглотитель на твёрдом носителе | Жидкая |
П. По механизму разделения смеси:
а) Адсорбционная хроматография основана на различной адсорбционной способности веществ на данной адсорбенте.
б) Ионно-обменная хроматография основана на способности веществ обмениваться ионами друг с другом.
в) Осадочная хроматография основана на различной растворимости осадков.
г) Распределительная хроматография основана на различном распределении веществ (с разными коэффициентами распределения).
Ш. В зависимости от способа относительного перемещения фаз — подвижной фазы вдоль неподвижной различают следующие виды хроматографии:
1. Проявительная (элюентная) хроматография.
При работе по этому методу разделяемая смесь переносится потоком вещества (элюента), который сорбируется хуже, чем любой компонент смеси.
Через слой сорбента, находящийся в хроматографической колонке, непрерывно пропускают поток элюента, называемого носителем (он может быть газообразным или жидким). В поток носителя на входе в колонку вводят небольшой объём разделяемой смеси, содержащей компоненты А и В, которая увлекается потоком носителя и продвигается по колонке через слой сорбента.
Газовая хроматография (ГХ). Её виды
Подвижная фаза — газ или пар (газ-носитель).
В зависимости от состояния неподвижной фазы различают газо-адсорбционную (ГХ) и газо-жидкостную (ГЖХ) хроматографию.
В ГХ — неподвижной фазой является твёрдый адсорбент.
В ГЖХ — неподвижной фазой является жидкость, плёнка жидкости на поверхности частиц твёрдого сорбента.
Газовая хроматография основана на различной сорбируемости компонентов смеси, применима для анализа смеси газов, легколетучих жидкостей и некоторых твёрдых веществ, способных переходить в паро- или газообразное состояние.
В качестве газа-носителя используют инертные газы — Не, Ne, Ar, а также N2, H2, CO2 и др. Скорость газа-носителя поддерживают постоянной.
Требования к газу-носителю:
Должен быть инертен по отношению к определяемым компонентам.
Должен быть химически чистым.
Быть дешёвым и легкодоступным.
Подходить к детектору.
Принципиальная схема газового хроматографа







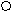

 4
4 






 5
5 
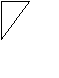



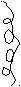 2 3 10
2 3 101


6
1. Баллон с газом-носителем Р = 100 атм.
2
 . Редуктор
. Редуктор3
 . Ротаметр, для измерения объёма газа (расход)
. Ротаметр, для измерения объёма газа (расход) 4

 . Осушительная колонка
. Осушительная колонка 5
 . Испаритель – дозирующее устройство 8 7
. Испаритель – дозирующее устройство 8 7 6
 . Хроматографическая колонка
. Хроматографическая колонка7. Детектор
8
 . Регистратор - самописец
. Регистратор - самописец9. Конденсационные ловушки 9
1
 0. Термостат
0. Термостат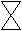
Подвижная фаза в виде газа-носителя непрерывно подаётся из баллона, анализируемая проба с помощью микрошприца вводится в испаритель в поток газа-носителя и попадает в хроматографическую колонку – 6. Объём вводимой пробы от 0,0001 – 0,1 мл.
Жидкостная хроматография
Среди хроматографических методов анализа наиболее разработанным является газовая хроматография, однако при некоторых анализах этот метод малоэффективен (малолетучих, химически и термически нестойких, высокореакционноспособных и др. веществ), поэтому целесообразнее применять жидкостную хроматографию.
Жидкостная хроматография основана на взаимодействии, возникающем при движении жидкой фазы сквозь неподвижный слой сорбента, обладающего большой суммарной поверхностью.
Особенностью хроматографического метода является распределение компонентов разделяемой смеси между фазами, одна из которых неподвижная большая поверхность, а другая — поток, фильтрующийся через неподвижный слой, в жидкостной хроматографии этот поток — жидкость (подвижная фаза).
Во всех случаях, когда подвижная фаза является жидкостью, мы имеем дело с жидкостной хроматографией, независимо от того, в каком состоянии находится неподвижная фаза.
Жидкостная хроматография получает всё большее развитие и применение с внедрением новых селективных адсорбентов на основе полимеров и становится высокочувствительным методом анализа многокомпонентных смесей в растворах.
Элюент — жидкость движется под воздействием силы тяжести, скорость движения элюента можно регулировать.
Пробу анализируемой смеси помещают в верхнюю часть колонки, по мере продвижения пробы по колонке происходит разделение компонентов и через определённые промежутки времени отбирают фракции элюента, которые подвергают анализу с целью определения концентраций анализируемых компонентов.
7. Показатели качества воды и их определение
В различных аналитических лабораториях нашей страны специалисты ежегодно выполняют не менее 100 млн анализов качества воды, причем 23% определений заключается в оценке их органолептических свойств, 21% - мутности и концентрации взвешенных вешеств, 21 % составляет определение общих показателей - жесткости, солесодержания, ХПК, БПК, 29 % - определение неорганических веществ, 4% - определение отдельных органических веществ.
Температура
Температура является важной гидрологической характеристикой водоема, показателям возможного теплового загрязнения. Тепловое загрязнение водоема происходит обычно в результате использования воды для отвода избыточного тепла и сбрасывания воды с повышенной температурой в водоем. При тепловом загрязнении происходит повышение температуры воды в водоеме по сравнению с естественными значениями температур в тех же точках в соответствующие периоды сезона. Основные источники промышленных тепловых загрязнений - тепловые воды электростанций. Тепловое загрязнение опасно тем, что вызывает интенсификацию процессов жизнедеятельности и ускорение естественных жизненных циклов водных организмов, изменение скоростей химических и биохимических циклов водных организмов, протекающих в водоеме.
Последствия:
при повышенной температуре многие водные организмы, и в частности рыбы, находятся в состоянии стресса, что снижает их естественный иммунитет, происходит массовое размножение сине-зеленых водорослей, образуются тепловые барьеры на путях миграций рыбы, уменьшается видовое разнообразие.
Специалисты установили: чтобы не допускать необратимых нарушений экологического равновесия, температура воды в водоеме летом в результате спуска загрязненных вод не должна повышаться более чем на 3 оС по сравнению со среднемесячной температурой самого жаркого года за последние 10 лет.
Органолептические показатели
К органолептическим показателям относятся цветность, мутность, запах, вкус и привкус, пенистость. Органолептическая оценка качества воды - обязательная начальная процедура санитарно-химического контроля воды. Ее правильному проведению специалисты придают большое значение.
Международные стандарты ИСО 6658 и другие устанавливают специальные требования к дегустаторам и методам проведения дегустации. Например, установлено, три квалификационных уровня дегустаторов: консультант, квалификационный консультант и эксперт. Перед исследованием запаха и вкуса проводят предварительные испытания образца, свободного от посторонних запаха или привкуса, и такой образец шифрованным образцом включается в серию анализируемых проб.
Цветность - естественное свойство природной воды, обусловленное присутствием гуминовых веществ и комплексных соединений железа. Цветность воды может определяться свойствами и структурой дна водоема, характером водной растительности, прилегающих к водоему почв, наличием в водосборном бассейне болот и торфяников. Цветность воды определяется визуально или фотометрически, сравнивая окраску пробы с окраской условной 100-градусной шкалы цветности воды, приготавливаемой из смеси K2Cr2O7 и CoSO4. Для воды поверхностных водоемов этот показатель допускается не более 20 градусов по шкале цветности. Если окраска воды не соответствует природному тону, а также при интенсивной естественной окраске, определяют высоту столба жидкости, при котором обнаруживается окраска, а также качественно характеризуют цвет воды.
Соответствующая высота столба не должна превышать для воды водоемов хозяйственно -бытового назначения - 20 см, культурно - бытового назначения - 10 см. Можно определять цветность и качественно (ГОСТ 1030). Стеклянная пробирка заполняется водой до высоты 10 - 12 см. Цветность воды определяют, рассматривая пробирку на белом фоне.
Различают следующие оттенки:
Слабо - желтоватая, светло - желтоватая, желтая, коричневая, красно - коричневая, другая (укажите какая).
Запах
Запах воды обусловлен наличием в ней летучих пахнущих веществ, которые попадают в воду естественным путем либо со сточными водами. Практически все органические вещества имеют запах и передают его в воде. Обычно запах определяют при нормальной (20 0С) и при повышенной (60 0С) температуре воды.
Запах по характеру подразделяют на две группы, описывая его субъективно по своим ощущениям:
естественного происхождения (от живущих и обмерших организмов, от влияния почв, водной растительности),
искусственного происхождения. Такие запахи обычно значительно изменяются при обработке воды.
Характер запаха:
| Естественного происхождения: | Искусственного происхождения: |
| землистый | нефтепродуктов |
| гнилостный | хлорный |
| торфяной | уксусный |
| плесневый | фенольный |
| травянистый | др. |
Для питьевой воды допускается запах не более 2 баллов.
Количественно интенсивность запаха оценивают, определяя «пороговое число» запаха N - степень разбавления анализируемой воды водой, лишенной запаха (обрабатывают активированным углем (0,6 г на 1 л), либо пропустив воду через бытовой фильтр для очистки воды).
N = V0/Va,
где V0 - суммарный объем воды (с запахом и без запаха), Va - объем анализируемой воды (с запахом), мл.
Если анализируемая вода содержит какое - либо пахнущее вещество, то описанным способом можно определить его концентрацию в пробе.
Cx = C0·(N0/Nx),
С0 - концентрация определяемого вещества в стандартном растворе, мг/л, N0 и Nx - «пороговое число» запаха стандартного раствора и пробы соответственно.
Определение порогового числа избавляет от необходимости определять количественное содержание в воде тех веществ, для которых ПДК установлено по органолептическому показателю - запаху (например, для фенолов и хлорфенолов).
Вкус и привкус
Различают 4 вкуса: соленый, кислый, горький, сладкий.
Остальные вкусовые ощущения считаются привкусами: (солоноватый, горьковатый, металлический, хлорный и т. д.). Интенсивность вкуса и привкуса оценивают по 5 - бальной шкале. Для питьевой воды допускаются значения показателей вкус и привкус не более 2 баллов.
Мутность
Мутность воды обусловлена содержанием взвешенных в воде мелкодисперсных примесей - нерастворимых или коллоидных частиц различного происхождения. Мутность воды обуславливает и некоторые другие характеристики воды - такие как:
Наличие осадка, который может отсутствовать, быть незначительным, заметным, большим, очень большим (в мм).
Взвешенные вещества, или грубодисперсные примеси определяются гравиметрически после фильтрования пробы, по привесу высушенного фильтра. Этот показатель обычно мало информативен и имеет значение, главным образом, для сточных вод.
Прозрачность, измеряется как высота столба воды, при взгляде сквозь который на белой бумаге можно различать стандартный шрифт.
Мутность определяют фотометрически, либо визуально по степени мутности столба высотой 10-12 см. В последнем случае пробу описывают качественно следующим образом: прозрачная, слабо опалесцирующая, опалесцирующая, слабо мутная, мутная, очень мутная (ГОСТ 1030).
Пенистость
Пенистостью считается способность воды сохранять искусственно созданную пену. Данный показатель может быть использован для качественной оценки присутствие таких веществ как поверхностно-активные вещества природного и искусственного происхождения. Пенистость определяют, в основном, при анализе сточных и загрязненных природных вод. Проба положительна, если пена сохраняется больше 1 мин (рН 6,5 - 8,5).
Водородный показатель
Для всего живого в воде минимально возможная величина рН=5, дождь, имеющий рН<5,5, считается кислотным. В питьевой воде допускается рН= 6,0-9,0, в воде водоемов хозяйственно-бытового и культурно-бытового водопользования - 6,5-8,5.
Щелочность и кислотность
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксо-анион.
К таким соединениям относятся:
сильные щелочи (КОН, NaOH) и летучие основания (например, NH4OH), а также анионы, обуславливающие высокую щелочность в результате гидролиза в водном растворе при рН>8,4 (CO32-, S2-, PO43-, SiO32- и др.);
слабые основания и анионы летучих и нелетучих слабых кислот (НСО3-, Н2РО4-, НРО42-, СН3СОО-, HS-, анионы гуминовых кислот и др.).
Щелочность пробы воды измеряется в моль-экв/л или ммольэкв/л и определяется количеством сильной кислоты (обычно используют соляную кислоту с концентрацией 0,05 или 0,1 мольэкв/л), израсходованной на нейтрализацию раствора. При нейтрализации до значений рН 8,0 - 8,2 в качестве индикатора используют фенолфталеин. Определяемая таким образом величина называется свободной щелочностью. При нейтрализации до значений рН 4,2 - 4,5 в качестве индикатора используют метиловый оранжевый. Определяемая таким образом величина называется общей щелочностью.
При рН=4,5 проба воды имеет нулевую щелочность.
Соединения первой группы из приведенных выше определяются по фенолфталеину, второй - по метилоранжу. Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками, обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды.
Соединения первой группы могут содержаться также в сточных и загрязненных поверхностных водах. Аналогично щелочности, иногда, главным образом при анализе сточных и технологических вод, определяют кислотность воды.
Кислотность воды обусловлена содержанием в воде веществ, реагирующих с гидроксо-анионами. К таким соединениям относятся:
сильные кислоты: соляная (НСl), азотная (HNO3), серная (H2SO4);
слабые кислоты: уксусная (СН3СООН); сернистая (H2SO3); угольная (H2CO3), сероводородная (H2S) и т.п.
катионы слабых оснований: аммоний (NH4+); катионы органических аммонийных соединений.
Общая жесткость
Жесткость воды представляет собой свойство природной воды, зависящее от наличия в ней главным образом растворенных солей кальция и магния. Суммарное содержание этих солей называют общей жесткостью.
Общая жесткость подразделяется на карбонатную, обусловленную концентрацией гидрокарбонатов (и карбонатов при рН 8,3) кальция и магния, и некарбонатную - концентрацию в воде кальциевых и магниевых солей сильных кислот.
Жесткость воды колеблется в широких пределах. Вода с жесткостью менее 4 ммоль-экв/л считается мягкой, от 4 до 8 ммоль-экв/л - средней жесткости, от 8 до 12 ммоль-экв/л - жесткой и выше 12 ммоль-экв/л - очень жесткой. Общая жесткость колеблется от единиц до десятков, иногда сотен ммоль-экв/л, причем карбонатная жесткость составляет до 70-80% от общей жесткости. Обычно преобладает жесткость, обусловленная ионами кальция (до 70%); однако в отдельных случаях магниевая жесткость может достигать 50-60%. Жесткость морской воды и океанов значительно выше (десятки и сотни ммоль-экв/л). Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего в период половодья.
Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая действие на органы пищеварения. Величина общей жесткости в питьевой воде не должна превышать 10,0 ммоль-экв/л. Жесткость воды выражается числом ммоль-экв кальция и магния в 1 л воды.
Общая жесткость определяется методом комплексонометрического титрования. Комплексонометрическое титрование основано на образовании комплексных соединений металлоионов с неорганическими и органическими лигандами. Наибольшее распространение получило комплексонометрическое титрование, в котором используют специальные реагенты - комплексоны - производные -аминополикарбоновых кислот. Чаще всего в качестве титранта применяют комплексон III - динатриевую соль этилендиаминтетрауксусной кислоты Na2H2Y - ЭДТА (торговое название - трилон Б).
Схематически образование комплексного соединения можно представить следующим образом:
Me2+ + H2Y2- = MeY2- + 2H+;
Me3+ + H2Y2- = MeY- + 2H+;
Me4+ + H2Y2- =MeY + 2H+.
Эти уравнения показывают, что один атом металла, независимо от его валентности, связывает одну молекулу комплексона.
Сухой остаток
Сухой остаток - это масса остатка, получаемого выпариванием профильтрованной пробы воды высушиванием при 103-105 0С или 178-182 0С.
Величина эта должна выражать суммарное количество растворенных в пробе веществ, неорганических и органических. Получаемые результаты, однако, удовлетворяют этому требованию лишь приближенно, при какой бы из указанных двух температур ни проводилось высушивание остатка.
Если остаток высушивали при 103-105 0С, то в нем сохранится вся или почти вся кристаллизационная вода солей, образующих кристаллогидраты, а также частично и окклюдированная вода. С другой стороны, при выпаривании и высушивании удаляются все летучие с водяным паром органические вещества, растворенные газы, а также СО2 из гидрокарбонатов, которые при этом превратятся в карбонаты.
Если остаток высушивали при 178-182 0С, то окклюдированная вода будет удалена полностью. Кристаллизационная вода также удалится, но некоторое количество может остаться, особенно когда в пробе присутствуют сульфаты. Гидрокарбонаты превратятся в карбонаты, но последние могут частично разложиться с образованием оксидов или окси-солей. Может произойти незначительная потеря нитратов. Органические вещества теряются в большей мере, чем в первом случае.
1 2