Вопросы |
|
Сульфидом Na является соединение Na2S
|
|
Перманганатом калия является соединение KMnO7 |
|
| |
|
В атомах какого элемента заполняется подуровень 3d? |
|
Строению атома какого элемента отвечает электронная конфигурация 1s22s22p63s23p64s2 Ca |
|
Ангидридом какой кислоты является Cl2O7 ? |
|
Карбонатом Mg является Mg2CO3 |
|
Из перечисленных соединений кристаллогидратом является
|
|
Эвивалентная масса едкого натра равна 28
|
|
Кислотным оксидом является
|
|
Степень окисления P в ряду соединений P2O5, P, H3PO4 равна
|
|
Из перечисленных соединений к основаниям относятся
|
|
Ортофосфат натрия – это H3PO4
|
|
Из перечисленных соединений к солям относятся
|
|
Манганат натрия –это Na2MnO4
|
|
Гидроксохлорид меди (II) – это Cu(OH)2
|
|
Кислой солью является
|
|
Основной солью является
|
|
Эквивалентная масса кислоты зависит от
|
|
Эквивалентная масса водорода (г/моль) 1
|
|
Эквивалентная
масса оксида элемента составляет 27. Чему равна эквивалентная масса элемента? 19
|
|
Амфотерным не является оксид
|
|
Жесткость воды обусловлена наличием солей
|
|
К группе галогенов относится
|
|
Параметр, определяющий пространственную ориентацию данной атомной орбитали и отчасти её форму m
|
|
Параметр, характеризующий собственный магнитный момент электрона ms
|
|
Формулировка «электрон может вращаться вокруг ядра только по некоторым определенным круговым орбитам»относится к
|
|
Какая из перечисленных электронных конфигураций возможна?
|
|
Сколько электронов в атоме скандия находится на подуровне 4 s? 2
|
|
Среди перечисленных реакцией гидролиза является
|
|
Кислую реакцию имеет раствор
|
|
В присутствии основания лакмус становится ,\blue
|
|
Щелочную реакцию имеет раствор
|
|
Среди
перечисленных реакцией
нейтрализации является
|
|
Окислительно-восстановительной
реакцией является
|
|
Cо щелочами реагирует оксид
|
|
При взаимодействии Са + Н2О образуется
|
|
Царская водка - это HCl*H2SO4
|
|
Формулировка «невозможно создать тепловую машину при наличии единственного источника тепла» относится к
|
|
Энтальпия - это
|
|
Формулировка «энтропия идеального кристалла чистого
вещества при 0 К равна нулю» относится к
|
|
Энергия Гиббса – это термодинамический потенциал в
|
|
Формулировка «тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от пути реакции и ее промежуточных стадий» относится к
|
|
Изобарическим называется процесс,протекающий в системе при постоянном
|
|
Уравнение Q=dU+W является математическим выражением
|
|
Изменение энтропии для реакции:NH3 (газ.) + HCl(газ.) = NH4Cl (тв.)
|
|
Химический процесс называется экзотермическим, если он протекает с выделением тепла
|
|
Неэлектролитами являются
|
|
Свойство растворов, являющееся коллигативным
|
|
Нормальная концентрация есть отношение
|
|
Моляльная концентрация есть отношение
|
|
Мольная доля есть отношение
|
|
Молярная концентрация есть отношение
|
|
Процентная концентрация есть отношение
|
|
50% раствор H2SO4 содержит
|
|
1 М раствор едкого натра содержит(объем 1 л)
|
|
1 N раствор соляной кислоты содержит
|
|
Концентрация (CM) раствора серной кислоты равна 0,5 М. Какова масса
кислоты в данном растворе?
|
|
Осмосом называют
|
|
Раствор содержит 10 г Na2SO3 и 90 г воды. Какова процентная концентрация раствора?
|
|
Дана реакция: H2 + J2 = 2HJ. Написать выражение для скорости прямой реакции.
|
|
Константа равновесия химической реакции: СО2 + С = 2СО имеет вид
|
|
Возможные степени окисления Сl +-1 3 5и 7
|
|
Элемент, имеющий степень окисления,равной 0
|
|
К группе благородных газов не относится
|
|
Закон Рауля формулируется следующим образом
|
|
Повышение температуры кипения раствора можно найти как
|
|
Понижение температурызамерзания раствора можно найти как
|
|
Один из продуктов реакции KMnO4+MnSO4+H2O=
|
|
Один из продуктов реакции KMnO4+Na2SO3+KOH=
|
|
Один из продуктов окислительно-восстановительной реакции FeCl3+KJ=
|
|
Ионное произведение чистой воды при 250 С равно
|
|
Водородный показатель (рН) - это
|
|
Значение рН раствора, содержащего
[Н+]=10-6 моль/л:
|
|
Если рН раствора равен 12, то реакция среды
|
|
Эквивалентный объем кислорода составляет
|
|
Эквивалентная масса металла составляет 12. Чему равна
эквивалентная масса его оксида?
|
|
Эквивалентная масса сульфата хрома равна
|
|
При взаимодействии оксида
кальция с водой образуется
|
|
К группе галогенов относится
|
|
Какой из указанных
гидроксидов может образовать основную соль
|
|
Какая из данных кислот может образовать кислую соль
|
|
Ангидридом какой кислоты является Cl2O5
|
|
В каком из этих соединений больше массовая доля водорода
|
|
Сильной кислотой является
|
|
Ангидридом какой кислоты является оксид фосфора (v)?
|
|
Хлорат кальция есть следующая
|
|
Царская водка - это
|
|
В теории Бора электрон может вращаться
|
|
Атом поглощает или излучает энергию при
|
|
Максимальное число электронов на одной орбитали равно
|
|
Побочное (орбитальное) число l характеризует
|
|
Главное квантовое число определяет
|
|
Правило Хунда гласит:
|
|
Магнитное квантовое число характеризует
|
|
Спиновое квантовое число определяет
|
|
Главное квантовое число может принимать значения
|
|
К s-элементам относятся
|
|
К p-элементам относятся
|
|
Спиновое квантовое число может принимать значения
|
|
Cтепень окисления хрома в бихромате аммония равна
|
|
Максимальная степень
окисления марганца равна
|
|
В атоме серы число неспаренных электронов равно
|
|
Среди перечисленных элементов наименьшую электроотрицательность имеет
|
|
Химическая кинетика – это наука
|
|
Кинетическое уравнение химической реакции записывается в следующем виде:
|
|
Для реакции:
H2 + I2 = 2HI скорость обратного процесса определяется уравнением:
|
|
Константа скорости химической реакции зависит от
|
|
По правилу Вант-Гоффа при повышении температуры на 100 скорость реакции увеличивается
|
|
Уравнение Аррениуса имеет вид:
|
|
Для реакции: aA+bBcC+dD закон действующих масс выражается уравнением:
|
|
Величина К в выражении закона действующих масс называется
|
|
Принцип Ле Шателье заключается в следующем: если на систему, находящуюся в равновесии, оказать какое-либо внешнее воздействие, то равновесие в системе
|
|
В молекуле Н2 связь:
|
|
В молекуле хлорида калия связь
|
|
Для реакции: CaCO3 = CaO + CO2 при понижении давления равновесие сместится в
сторону:
|
|
Константа равновесия реакции: Fe3O4 + CO 3FeO + CO2 равна:
|
|
Раствором называется:
|
|
Растворимостью вещества
называется
|
|
Молярность раствора – это число молей растворенного вещества, приходящееся на
|
|
Единицы измерения нормальной концентрации (СN) -
|
|
Мольная доля растворенного вещества показывает:
|
|
Термодинамика - наука, изучающая
|
|
Теплотой процесса фазового превращения является количество тепла, которое
|
|
Изменение температуры кипения раствора рассчитывается по формуле:
|
|
Под первым началом термодинамики понимают
|
|
Критерием принципиальной осуществимости процесса является
|
|
Электролиз - это
|
|
Температура замерзания раствора
|
|
Энтропия имеет размерность
|
|
При р, Т = const изменение энергии Гиббса вычисляется по формуле:
|
|
Найдите формулу комплексного соединения с химическим названием: хлорид
диакватетраамминплатины (IV)?
|
|
Чему равен заряд комплексного иона в соединении – гексацианоферрат калия (III)?
|
|
Молярная концентрация 0,06 N раствора серной кислоты равна:
|
|
40 г гидроксида натрия содержится в следующем количестве 5 % раствора:
|
|
Процентная концентрация нитрата натрия в растворе, содержащем 25г нитрата натрия и 75 г воды:
|
|
В растворе содержится 1 кг воды и 56 г KOH. Моляльная концентрация раствора равна
|
|
Присутствие сульфатов в водном растворе можно определить по образованию
белого осадка в присутствии
|
|
Электролитами называются:
|
|
Слабые электролиты – это вещества
|
|
Для слабых бинарных электролитов выражение 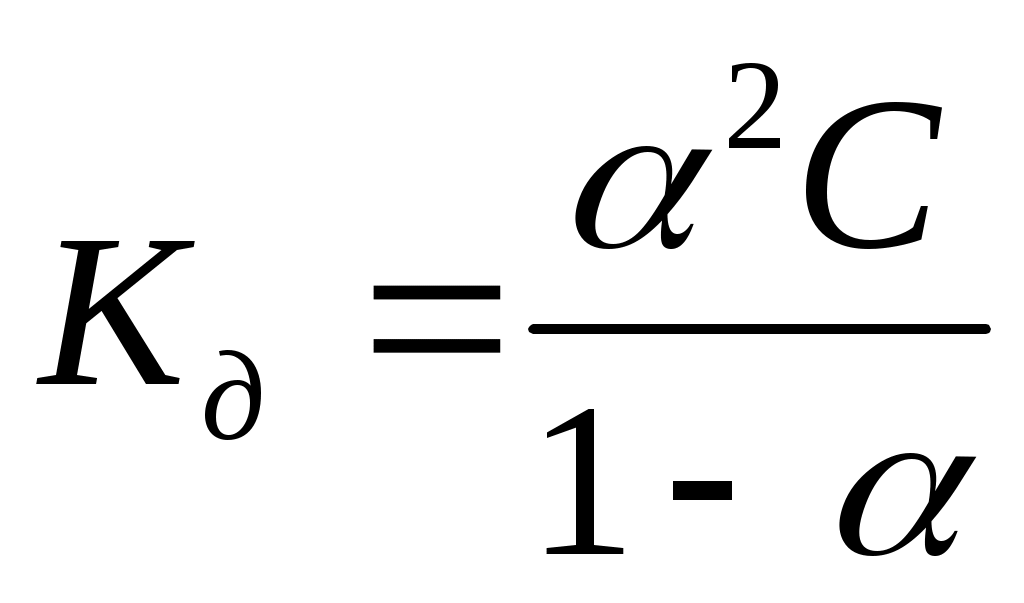 носит название носит название
|
|
Степень диссоциации - это
|
|
При 250С константа диссоциации уксусной кислоты равна 1,810-5. Степень диссоциации кислоты в 1 N водном растворе равна
|
|
Данные соединения не могут находиться совместно в растворе
|
|
Гидролизу не подвергается
|
|
В присутствии кислоты лакмус становится
|
|
Сильную кислоту можно отличить от слабой по:
|
|
Среда водного раствора, водородный показатель которого рН = 13,2 -
|
|
В результате реакции:K2Cr2O7+Na2SO3+H2SO4 образуется следующее вещество:
|
|
Значение электродного потенциала рассчитывается по уравнению:
|
|
Тиосульфатом натрия является соединение |
Хлоратом калия является соединение
|
В атомах какого элемента заполняется подуровень 3р
|
Строению атома
какого элемента отвечает электронная конфигурация
1s22s22p63s23p64s1
|
Какое число электронов находится на подуровне 3d у атома Ti
|
Нашатырный спирт – это
|
Карбонатом кальция является
|
Из перечисленных соединений кристаллогидратом является
|
Мольная масса
ортофосфата калия равна (г/моль)
|
Аммиаком является
|
Степень окисления S в ряду соединений H2S, S, SO2, H2SO4 равна
|
Из перечисленных соединений к кислотам относятся
|
Из перечисленных соединений к основаниям относятся
|
Метаалюминат кальция - это
|
Какова формула гидроксохлорида магния?
|
Эквивалентный объем Cl2 составляет (л/моль)
|
Эквивалентная масса металла составляет 21. Чему равна
эквивалентная масса его оксида?
|
Главное квантовое
число определяет
|
Магнитное
квантовое число характеризует
|
Спиновое квантовое число определяет
|
Основное следствие запрета Паули
|
Какая из перечисленных электронных конфигураций
возможна?
|
В молекуле Н2 связь
|
Гидролизом называется
|
Соль, не подвергающаяся гидролизу
|
Соль, гидролизующаяся только по катиону
|
Соль, гидролизующаяся только по аниону
|
В присутствии кислоты лакмус становится
|
В присутствии основания лакмус становится
|
В присутствии кислоты фенолфталеин становится
|
Термодинамика - это наука, изучающая
|
Под первым началом термодинамики понимают
|
Под вторым началом термодинамики понимают
|
Под третьим началом термодинамики (постулатом Планка) понимают
следующую формулировку:
|
Внутренняя энергия равна
|
Изохорическим называется процесс, протекающий в системе при постоянном
|
Химический процесс называют эндотермическим, если он протекает с
|
Закон Гесса необходим для
|
Стандартная энтальпия (теплота) образования - это
|
Электролиты - это
|
Слабые электролиты – это
|
Растворами называются
|
Свойство растворов, не являющееся коллигативным
|
Криоскопическая константа необходима для расчета
|
Процесс осмоса характеризуется
|
Размерность нормальной концентрации
|
Размерность молярной концентрации
|
Размерность моляльной концентрации
|
Размерность мольной доли растворенного вещества
|
20% раствор Na2SO4 содержит
|
1 М раствор H2SO4 содержит (объём 1 л)
|
1 N раствор H2SO4 содержит (объём 1 л)
|
Раствор HCl c моляльной концентрацией (Cm ), равной 1, содержит
|
Какая масса ( г ) LiBr содержится в 5 л 1 N раствора?
|
Объемы растворов реагирующих веществ
|
На нейтрализацию 50 мл 0,2 N раствора
HCl потребовалось 10 мл раствора NaOH. Какова CN NaOH?
|
Данные соединения не могут находиться совместно в растворе
|
Химическая кинетика – это наука
|
Кинетическое уравнение химической реакции записывается в следующем виде:
|
Для реакции aA+bBÛcC+dD закон действующих масс выражается уравнением:
|
Окислителями называются
|
Восстановителем является
|
Элемент, имеющий в соединениях степень окисления, равную (- 2)
|
Один из продуктов реакции KMnO4+FeSO4+ +H2O=
|
Один из продуктов реакции: KMnO4+FeSO4+ KOH=
|
Максимальная степень окисления селена
|
Ионное произведение воды
|
Водородным показателем (рН) является
|
Значение рН раствора, содержащего [ОН-]=10-2 моль/л
|
Если рН раствора равен 8.2, то реакция среды
|
Чему равен рН 0,001 N раствора NaOH
|
Концентрация раствора гидроксида бария 0,05 М. Чему равен рН данного раствора?
|
Реакция среды в дистиллированной воде
|
Уравнение Нернста
|
Малахит - это
| | |
 Скачать 356 Kb.
Скачать 356 Kb.