V группа катионов при действии на нее группового реактива выводится из смеси в виде:
|
IV группа при действии на нее группового реактива выводится из смеси в виде:
|
Метод количественного анализа, основанный на точном измерении массы исследуемого вещества, называется:
|
Реактив Чугаева – реагент для определения катиона
|
Метод количественного анализа, основанный на точном измерении объема реагента, называется:
|
Объем раствора, взятый для титрования, называется:
|
В точке эквивалентности соблюдается закон:
|
Точку эквивалентности можно установить с помощью:
|
Реакция нейтрализации лежит в основе:
|
Окислительно-восстановительная реакция лежит в основе:
|
Реакции образования комплексных
coединений лежат в основе:
|
Пример косвенного титрования:
|
Основой объемного анализа является процесс
|
В основе гравиметрического анализа находится процесс
|
Пример безиндикаторного титрования:
|
Йод в качестве индикатора используется при определении:
|
Фенолфталеин и метилоранж используются одновременно в методе:
|
Рабочим раствором при определении Cu (II) йодометрией является:
|
Этилендиаминтетрауксусной кислоты двунатриевая соль используется в:
|
Эриохром и мурексид в качестве индикаторов используются в:
|
Растворы, сохраняющие постоянный pH, называются:
|
Жесткость воды определяют ионы:
|
Жесткость воды определяется методом:
|
Качественная реакция на ионы Fe (III):
|
Качественная реакция на ионы Zn (II):
|
Реакции диспропорционирования относятся к реакциям:
|
Взаимодействие кислоты и основания относятся к реакциям:
|
Присутствие ионов меди (II) можно определить реакцией:
|
Дигидрофосфат калия получается в следующей реакции:
|
Эта кислота образует два типа кислых солей:
|
Укажите формулу дигидрофосфата:
|
Укажите, нейтрализация какой кислоты и основания отражается сокращенным ионным уравнением:
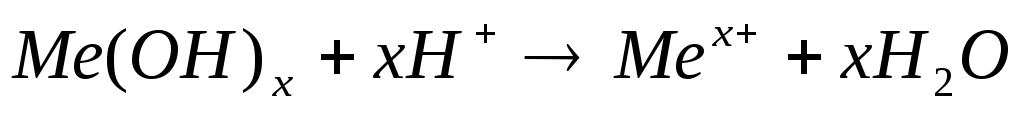
|
Закон PV=RT носит имя:
|
Закон эквивалентов записывается как:
|
К нормальным условиям относятся:
|
Номенклатурное название AlOHSO4
|
Следующая группа катионов не имеет группового реактива:
|
Номенклатурное название 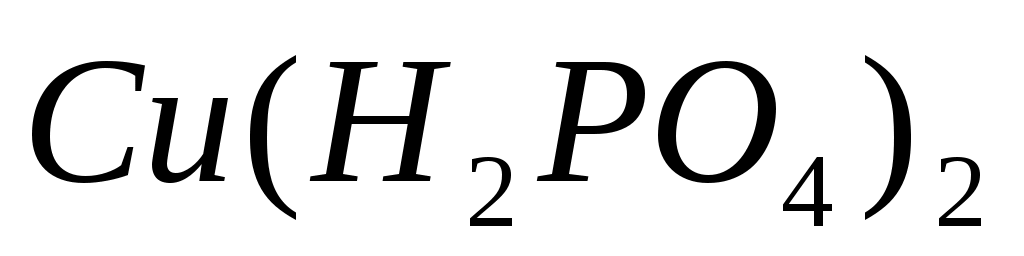 : :
|
К классу солей относится следующее соединение:
|
Рабочим раствором в перманганатометрии служит раствор:
|
При взаимодействии 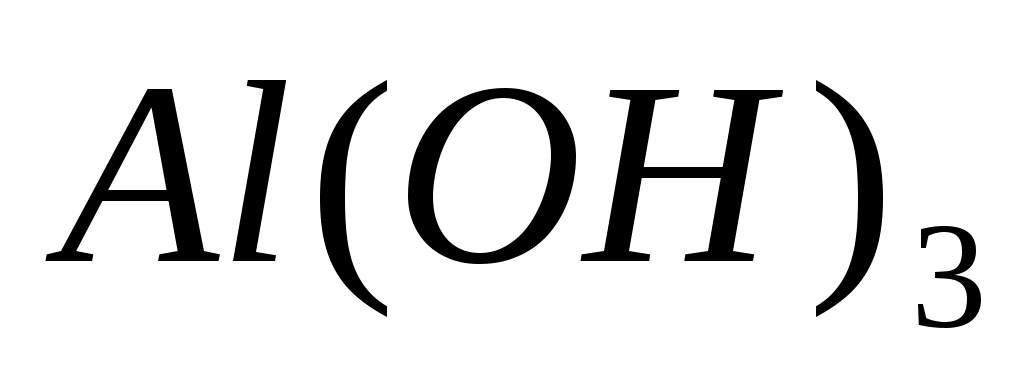 с с 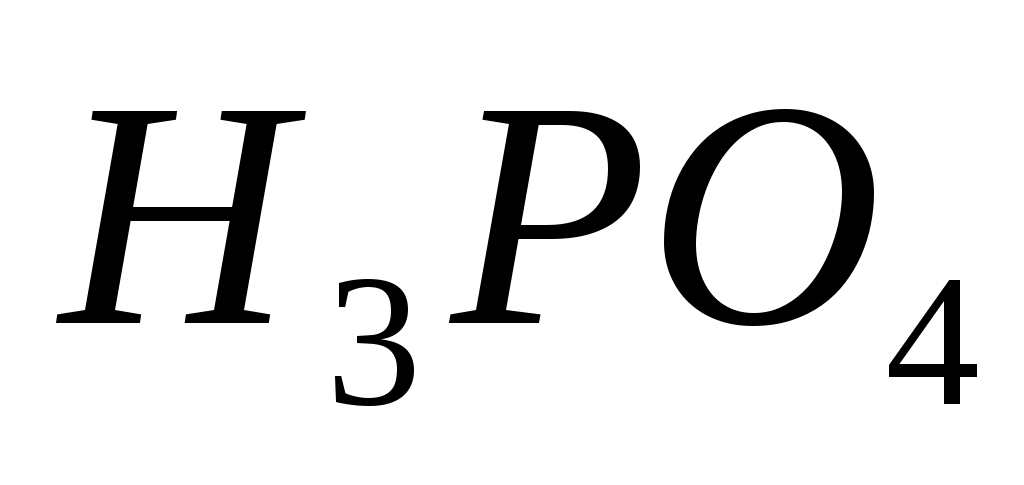 возможно образование максимально: возможно образование максимально:
|
При взаимодействии 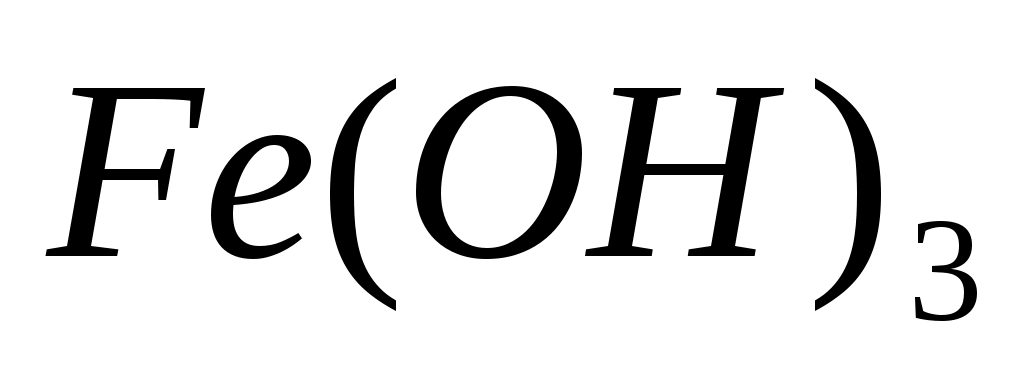 с с 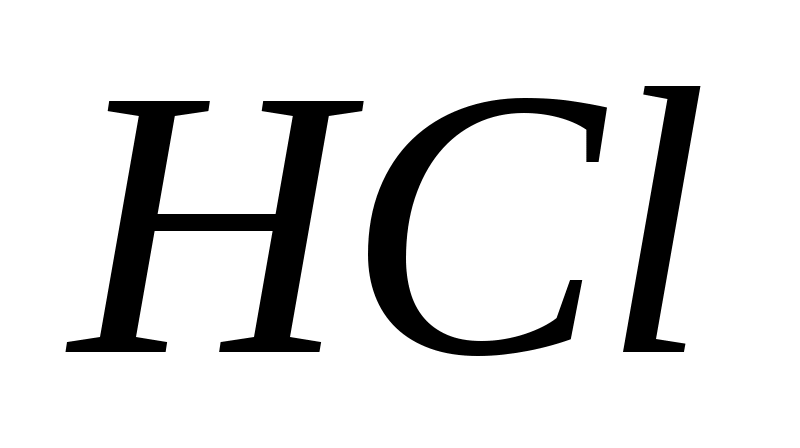 кроме средней соли могут образоваться и: кроме средней соли могут образоваться и:
|
Рабочим раствором в йодометрии служит раствор:
|
Эквивалентный объём кислорода равен:
|
Реакция
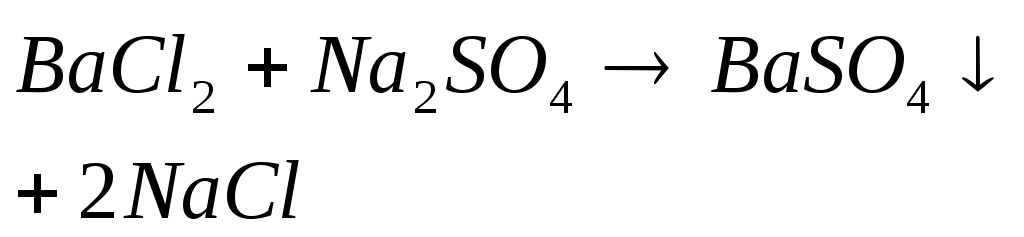
относится к типу:
|
Реакция
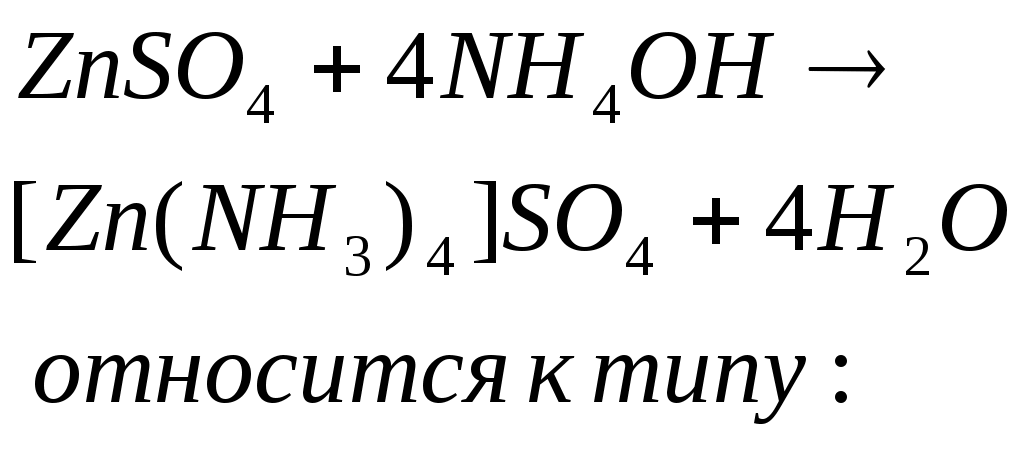
|
Невозможна следующая электронная конфигурация:
|
Литий относится к элементам типа:
|
Приведенная электронная конфигурация соответствует следующему элементу 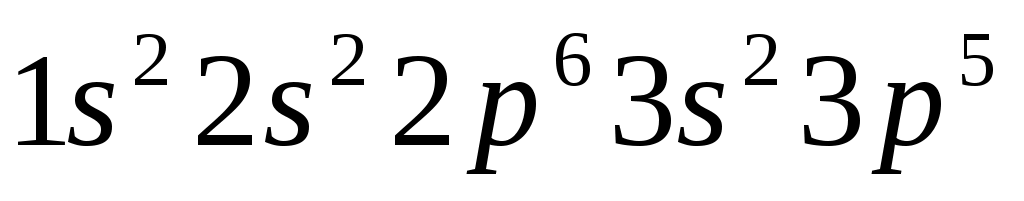 : :
|
Элемент, валентные электроны которого имеют следующую конфигурацию 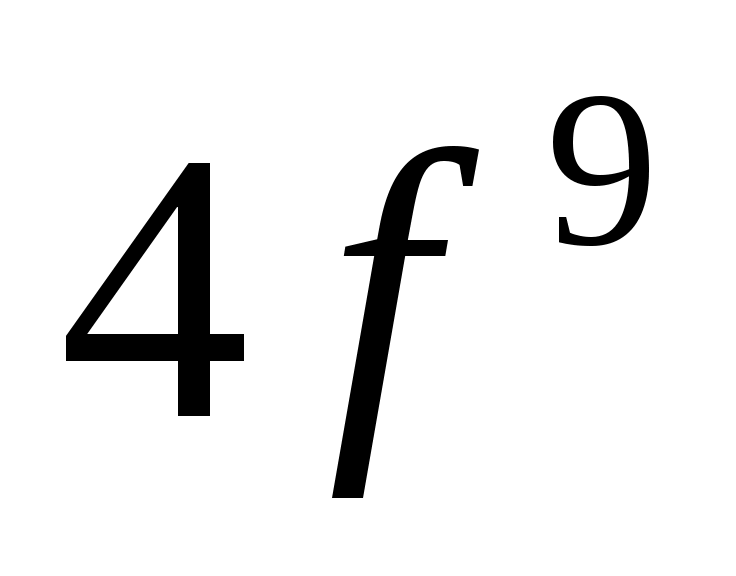 , относится к: , относится к:
|
Элемент, валентные электроны которого имеют следующую конфигурацию
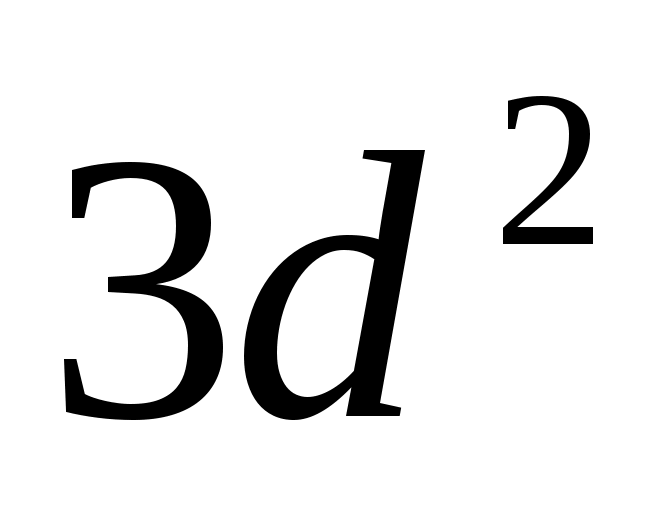 , относится к: , относится к:
|
Молекула следующего соединения образована ковалентной неполярной связью:
|
В молекуле хлорида натрия химическая связь:
|
Пример безиндикаторного титрования:
|
Водородная связь присутствует в молекуле:
|
В основе расчетов количественного анализа, выполненных объемным методом, лежит закон:
|
Степень окисления комплексообразователя в соединении 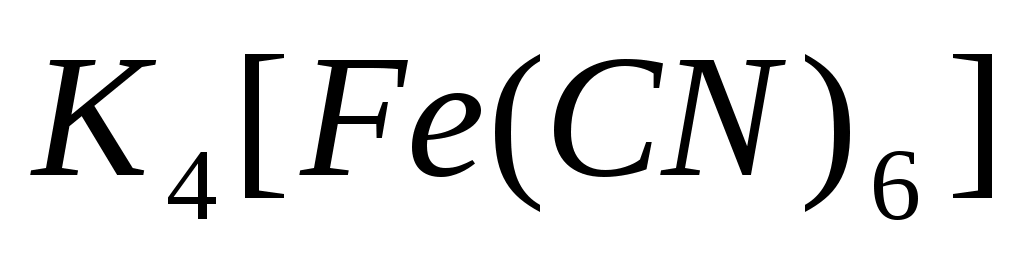 , равна: , равна:
|
Степень окисления комплексообразователя в соединение 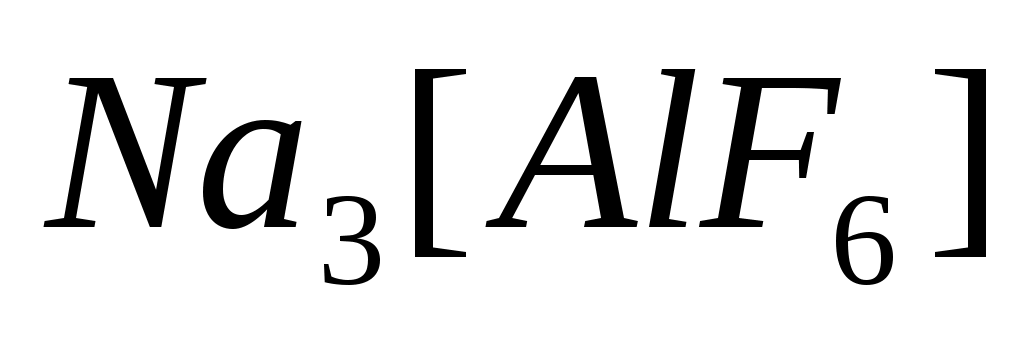 , равна: , равна:
|
Формула хлорида гексоакваалюминия (III):
|
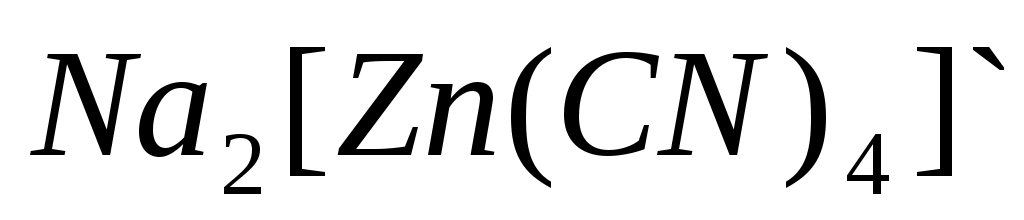 - это - это
|
Для приготовления 200 мл
0,5 М раствора потребуется серной кислоты:
|
Нормальность 1 л раствора, содержащего 4г гидроксида натрия составляет:
|
Массовая доля раствора, содержащего 40 г
йодида калия в 60 г воды, составляет:
|
Нормальность одномолярного раствора 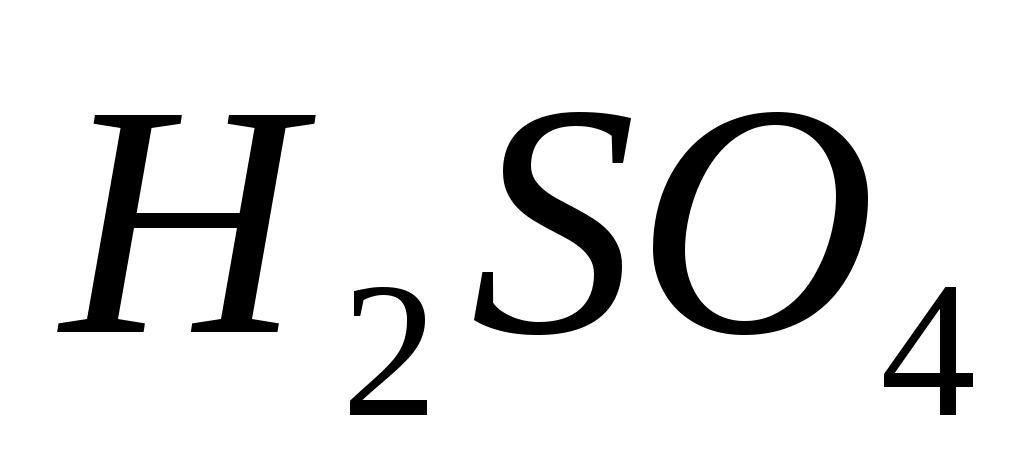 равна равна
|
Гидроксоортофосфат бария - это
|
В основе объемного метода анализа вещества лежит точное определение:
|
рН раствора Ba(OH) 2 , концентрация которого
0,05 моль/л, равен:
|
Групповым реактивом для III аналитической группы катионов служит:
|
Ионы двухвалентной меди в растворе можно обнаружить с помощью:
|
рН раствора, полученного разбавлением в 100 раз раствора рН = 2, равен:
|
К VI аналитической группе катионов относятся ионы:
|
Водородный показатель равен:
|
Ионное произведение воды равно:
|
Молярная концентрация раствора определяется количеством:
|
Нормальная концентрация раствора определяется:
|
Гидролизу подвергается следующая соль:
|
При гидролизе соли 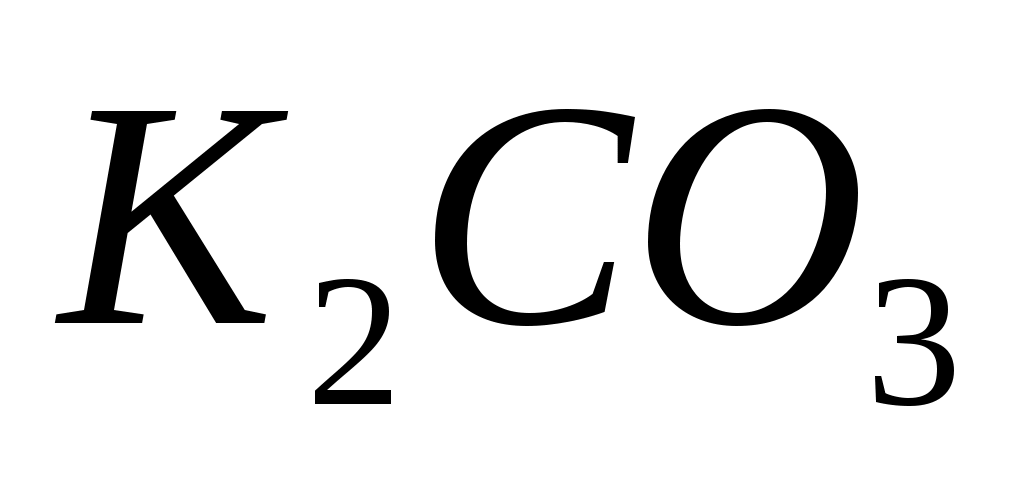 по первой ступени образуются ионы: по первой ступени образуются ионы:
|
При гидролизе соли 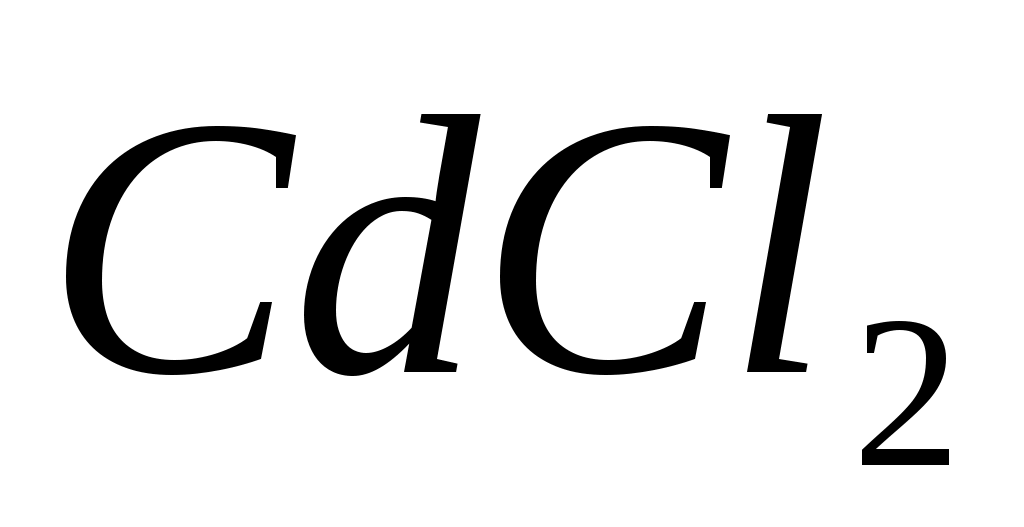 по первой ступени образуются ионы: по первой ступени образуются ионы:
|
Растворимость бромида серебра в воде при 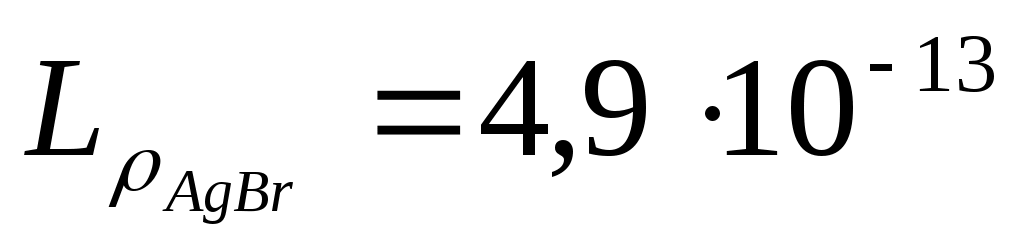 равна: равна:
|
Растворимость – это концентрация раствора
|
Буферный раствор – это смесь:
|
Следующим фактором можно усилить гидролиз хлорида железа (III)
|
Электролиты – вещества: |
Кислотно – щелочной индикатор диссоциирует по уравнению: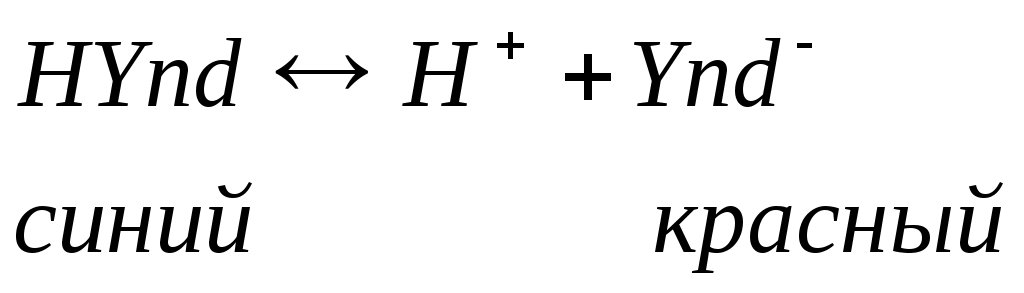 Окраска индикатора в кислом растворе будет: Окраска индикатора в кислом растворе будет:
|
Окислительно–восстановительным является процесс:
|
Укажите правильное выражение для скорости реакции А : :
|
Зависимость скорости реакции от температуры - это
|
На состояние равновесия экзотермической реакции 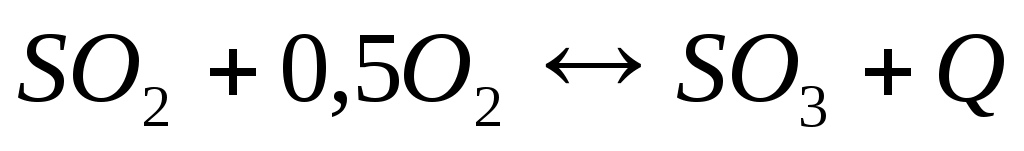 понижение температуры повлияет следующим образом: понижение температуры повлияет следующим образом:
|
На скорость реакции не влияет:
|
Средняя соль цинка имеет вид
|
Принцип Ле–Шателье относится к разделу:
|
Рабочим раствором в комплексонометрии служит:
|
Реакция замещения – это следующая реакция:
|
Реакцией разложения является следующая реакция:
|
Гидролиз хлорида железа(III) можно усилить:
|
Продуктами гидролиза по реакции:
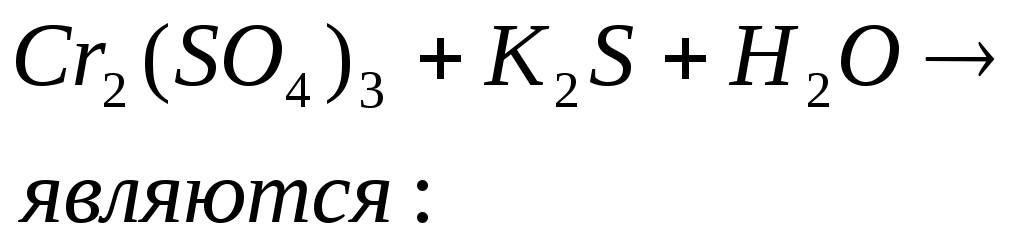
|
Гидролизу подвергается
|
В присутствии кислоты лакмус становится
|
В присутствии основания фенолфталеин становится
|
Какой из металлов - Fe или
Hg - способен вытеснить
водород из растворов кислот
|
Электролиз – это
|
Коррозия – это
|
Значение электродного потенциала рассчитывается по уравнению:
|
Величина рН следующего
0,1 М раствора после разбавления в 1000 раз будет равна 4
|
Величина рН следующего 0,01 М раствора после разбавления в 100 раз будет равна 10
|
Гидролиз гидрофосфата натрия протекает
|
Гидролиз сульфида алюминия протекает
|
Фенолфталеин в кислой среде
|
Буферными свойствами обладает следующий раствор
|
В 0,005 М растворе Ва(ОН)2 рН равен
|
В 5104 N растворе серной кислоты рН равен:
|
Величина рН раствора щелочи равна 11. После разбавления в 100 раз она станет равной:
|
Величина рН следующего раствора больше 7:
|
Величина рН раствора NaОН после разбавления в 100 раз
|
Формула 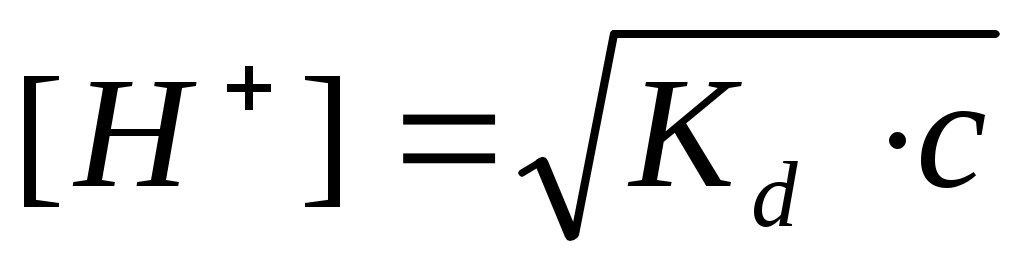 подходит для следующего раствора: подходит для следующего раствора:
|
Качественная реакция на NH4+ идет с
|
К первой группе катионов относится
|
Ко второй группе катионов относится
|
При определении иона Ni+2 используют:
|
Методом перманганатометрии определяют
|
Качественная реакция на Pb2+ идет с
|
Сода - это
|
К аммиакатам относится
|
Процесс коррозии металлов
|
На скорость коррозии металла не влияет
|
Реактив Несслера является реагентом для определения
|
Групповым реактивом для третьей аналитической группы катионов служит:
|
Жесткость воды зависит от присутствия катионов:
|
Аликвота - это:
|
В методе иодометрии
используется следующий
индикатор:
|
Ацетон используют в анализе для определения ионов:
|
Понятие «молекула» применимо к:
|
Сколько моль вещества содержится в 64 г кислорода?
|
Растворимость- это концентрация раствора
|
К простым веществам относятся
|
Количество вещества рассчитывается по формуле:
|
Хлороводородная кислота - это
|
Реагенты -
|
В 98 г серной кислоты содержится водорода:
|
Степень окисления серы в сульфите калия
|
Тип реакции
NH3 + HCl NH4Cl
|
Тип реакции
(NH4)2Cr2O7 N2 + Cr2O3 + 4H2O
|
Тип реакции
CuS04 + Fe FeSO4 + Cu
|
m1/m2 = э1/э2
|
Эквивалентная масса серы в H2S равна
|
Эквивалентная масса хлора в HCl равна
|
Один моль фтора при н.у. занимает объем, равный
|
Эквивалентный объем водорода составляет
|
Эквивалентная масса сульфат-иона составляет
|
Эквивалентная масса хлорида магния равна (при образовании средней соли)
|
Элементом с конфигурацией внешнего слоя 5s25p5 является
|
Элементом с конфигурацией внешнего слоя 3d34s2 является
|
Элементом с электронной конфигурацией внешнего слоя 4f76s2 является
|
Элементом с конфигурацией внешнего слоя 3d104s1 является
|
Элементом с конфигурацией внешнего слоя 4p4 является
|
Максимальное число электронов на одной орбитали равно
|
Молекула KCl образована следующей химической связью
|
Водородная связь присутствует в
|
В молекуле Н2 связь
|
Тиосульфатом натрия является
|
Сода - это
|
Царская водка - это
|
CaWO4 – это шеелит. Химическое название минерала:
|
В соединении [Zn(NH3)4]SO4
комплексообразователем служит
|
В соединении K4[Fe(CN)6] лигандом служит
|
В соединении Na+[B3+F4] координационное число равно
|
Внутренняя сфера комплексного соединения связана с внешней
|
Формула тетрахлораурата (III) водорода
|
Основная соль алюминия имеет вид
|
Кислая соль меди имеет вид
|
Средняя соль цинка имеет вид
|
Соединение CuOHCl относится к классу
|
Степень окисления Mn в соединении K2MnO4 равна
|
Степень окисления Mn в ионе [MnF6]4- равна
|
Степень окисления Mn в ионе [Mn(H2O)6]2+ равна
|
Для смещения химического равновесия реакции
FeCl3 + KCNS Fe(CNS)3 + KCl
в сторону образования продуктов необходимо
|
Закон разведения Оствальда
|
Количество молей растворенного вещества в одном литре раствора определяет
|
Количество молей растворенного вещества в одном килограмме растворителя определяет
|
Количество эквивалентов растворенного вещества в одном литре раствора определяет
|
К сильным электролитам относится
|
Амфотерными свойствами обладает
|
Объемный анализ основан на точном измерении
|
Медный купорос - это
|
Аликвота - это количество исследуемого вещества, взятого для
|
Гидролизу подвергается
|
Выражение произведения растворимости для Ag2CrO4 имеет вид
|
Растворимость AgCl увеличится в присутствии
|
Растворимость BaSO4 уменьшится в присутствии
|
Продуктом атмосферной коррозии железа является
|
Водородный показатель водного раствора роданида аммония
|
Водородный показатель водного раствора карбоната калия
|
Водородный показатель водного раствора сульфата калия
|
Водородный показатель водного раствора нитрата аммония
|
Буферные растворы - это растворы
|
Реакция нейтрализации лежит в основе метода
|
При увеличении температуры на 10 градусов скорость химической реакции увеличивается в
|
При химическом равновесии соблюдается следующее правило
|
Гидролиз - это химическое взаимодействие с водой
|
В водном растворе гидролизуется только по аниону соль
|
В водном растворе гидролизуется по аниону и катиону соль
|
Гидролиз соли можно усилить
|
Ступенчато диссоциирует электролит
|
Величина рН соляной кислоты после разбавления в 100 раз
|
При диссоциации в водном растворе ионы водорода образует
|
Сила кислот как электролитов сначала растет, затем уменьшается в ряду
|
Величина рН 0,1 М раствора после разбавления в 1000 раз будет равна 4
|
Величина рН 0,01 М раствора после разбавления в 100 раз будет равна 10
|
В присутствии кислоты лакмус
становится
|
Буферными свойствами обладает следующий раствор
|
В 0,005 М растворе Ва(ОН)2 рН равен
|
В присутствии оснований
фенолфталеин становится
|
Величина рН раствора щелочи равна 11. После разбавления в 100 раз она станет равной:
|
Величина рН следующего раствора больше 7:
|
Окислительно-восстановительные реакции лежат в основе метода
|
Величина рН раствора Na2S после
разбавления в 100 раз
|
Иодометрия – это метод для определения
|
Методом косвенного титрования определяют
|
Методом перманганатометрии определяют
|
Произведение растворимости фосфата кальция выражается формулой
|
Реактив Чугаева является реагентом
для определения иона
|
Весовой анализ основан на
|
К первой группе катионов относится
|
Качественная реакция на ион аммония идет с
|
Ацетон добавляют в анализируемую смесь для определения
|
При определении соды и щелочи в совместном присутствии с индикатором метиловым оранжевым оттитровывается
|
Катион бария относится к аналитической группе катионов:
|
Раствор Ni+2 имеет цвет:
|
Катион алюминия относится к
|
Групповым реактивом для шестой группы является
|
Качественная реакция на катион железа (3+) идет с
|
Раствор Co+2 имеет цвет:
|
 Скачать 356 Kb.
Скачать 356 Kb.