Все вещества состоят из молекул, а молекулы состоят из атомов. Между молекулами есть промежутки
 Скачать 1.05 Mb. Скачать 1.05 Mb.
|
|
1. Основные положения молекулярно-кинетической теории и их опытное подтверждение. Диффузия (определения, от каких величин и как зависит скорость дифузии). Броуновское движение. 1) Первое положение: Все вещества состоят из молекул, а молекулы состоят из атомов. Между молекулами есть промежутки. Опытным обоснованием служит наблюдение в микроскоп, смешивание веществ, сжимаемость веществ, их делимость. 2) Второе положение: Молекулы в любом веществе непрерывно и хаотически движутся. Опытным обоснованием послужит Диффузия (взаимное проникновение одного вещества в другое) и опыта Штерна (доказал существование быстрых и медленных молекул, большинство молекул движутся со средними скоростями, при увеличении температуры средняя скорость растёт), Броуновское движение (беспорядочное движение микроскопических видимых взвешенных в жидкости или газе частиц твёрдого вещества, вызываемое тепловым движением частиц жидкости или газа. Было открыто в 1827 году Робертом Броуном. Броуновское движение никогда не прекращается.) 3) Третье положение: Частицы взаимодействуют друг с другом силами, имеющую электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало. Опытным обоснованием может послужить смачивание, возникновение силы упругости при растяжении, сохранение формы твёрдого вещества. Диффзуия — взаимное проникновение одного вещества в другое при соприкосновении. Броуновское движение — беспорядочное движение частиц в газе или в жидкости твёрдого вещества. Атом — наименьшая частица химического элемента, которая является носителем его химических свойств. Молекула — наименьшая устойчивая частица вещества, обладающая всеми химическими свойствами, состоящая из разных атомов, объединенных химическими связями. 2. Температура (сравнение шкалы Цельсия и Кельвина, формула перевода). Идеальный газ (определение, свойства, формула давления). Плотность и концентрация (определения и формулы). Температура — величина характеризующая тепловое состояние тел. Измеряют с помощью термометров. Температура является мерой средней кинетической энергии частиц тела, чем больше энергия, тем больше температура. Шкала Цельсия открыта в 1742 году. Точка замерзания воды 0 градусов, кипения 100. Шкала Кельвина открыта в 1848 году. Точка замерзания замерзания воды 273,15 К, точка кипения 373,15 К. Перевод из одной в другой с помощью + или - 273-ти. Идеальный газ — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах. Свойства: 1. Молекулы — материальные точки. 2. Только движутся, не взаимодействуют друг с другом. 3. Только кинетическая энергия. Формулы: (написать) Концентрация — число молекул в одном кубичсеком метре. n=N/V Плотность — масса тела в единице его объёма. p(она как буква о с закорючкой)=m/v 3. Уравнение состояния идеального газа. Изопроцессы (определение, формула, графики) Уравнение идеального газа:  PV/T — const ( постоянна ), справедливо если m — const. Изопроцессы — процессы, в которых один из термодинамических параметров (давление, газ или темература) не изменяются. 1. Изотермический m = const T = const => PV - const Закон Вайля-Мариота: Для газа данной массы произведение давления на объем не меняется при неизменной температуре. Изотермы: 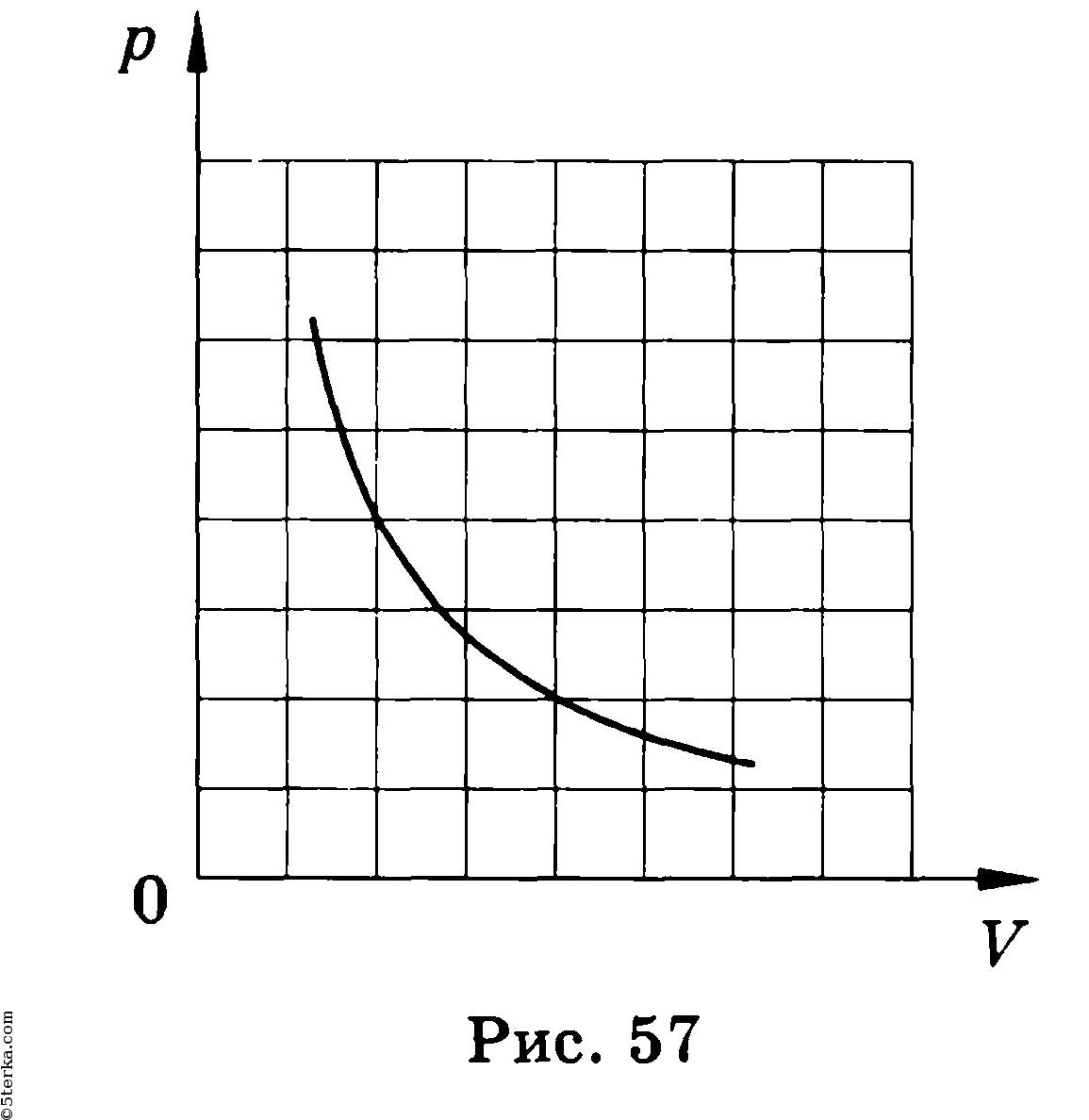  2. Изопарный v = const m = const => P/T = const ( P пропорционально Т ) Закон Шарля: Для газа данной массы отношение давления к температуре не изменяется при постоянном объёме. Изохоры: ( верхние стрелочки не учитывать ) 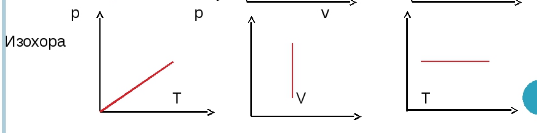 2. Изопарный p = const m = const => V/T = const Закон Шарля: Для газа данной массы отношение объема к температуре не изменяется при постоянном давлении. Изобары:  4. Внутреняя энергия (определение, формулы). Работа (формула, график). Теплопередача(определения, виды) Количество теплоты (Определения, формулы нагревания, плавления, парообразования) Удельная теплоёмкость, удельная теплота плавления и парообразования.  Обозначается буквой «U», единица измерения Дж. U = Eк + Еп  i = 3 i = 5 Работа A (Дж) = F (Н) * S (метры, иногда обозначается «r»)  I — сила тока, U — напряжение, t — время.  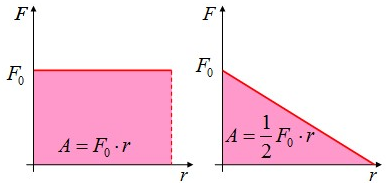 Графики:  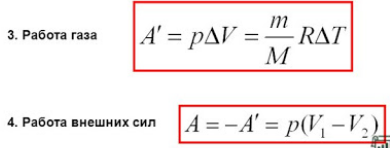 Теплопередача Теплопередача — физический процесс передачи тепловой энергии от более горячего к менее горячему. Виды: 1. Теплопроводность — переход внутренней энергии от частиц более нагретого тела, к менее нагретого. 2. Конвекция — вид, при котором внутренняя энергия переносится струями газа и жидкости. 3. Излучение — вид, при котором передача происходит электромагнитными волнами.  Единицей измерения удельной теплоёмкости в СИ является Дж/(кг.град).  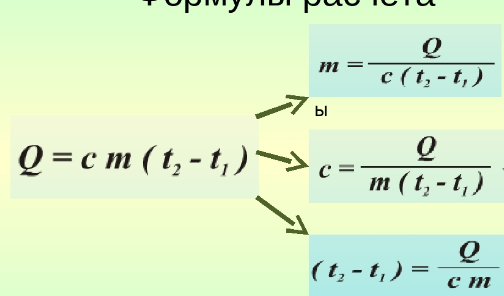 Удельная теплота парообразования и конденсации — физическая величина, показывающая, какое количество теплоты необходимо, чтобы обратить количество жидкости с единичной массой в пар, при данной температуре жидкости и без её изменения (температуры) в процессе испарения. Удельная теплота плавления — количество теплоты, которое необходимо сообщить одной единице массы кристаллического вещества в равновесном изобарно-изотермическом процессе, чтобы перевести его из твёрдого состояния в жидкое. Единица измерения — Дж/кг. 5. Первый закон термодинамики и его применение к изопроцессам. Адиабатный процесс. Примеры процессов. Тогда закон сохранения энергии для тепловых процессов, который называется первым законом термодинамики, можно записать так: Q = A' + дельта U , т. е. количество теплоты, переданное системе, идет на совершение системой работы и изменение ее внутренней энергии. При изобарном нагревании газ совершает работу над внешними силами A' = p(V2 - V1) = p * дельта V , где V1 и V2 — начальный и конечный объемы газа. Применения: В изотермическом процессе температура постоянная, => внутренняя энергия не меняется. Тогда уравнение первого закона термодинамики примет вид: При изохорном процессе газ не меняет своего объема, => работа им не совершается, т.е. В изобарном процессе газ расширяется и количество теплоты, переданное газу, идет на увеличение его внутренней энергии и на совершение им работы: А  диабатным называют процесс, протекающих без теплообмена с окружающей средой. диабатным называют процесс, протекающих без теплообмена с окружающей средой.  6. Тепловые двигатели (определения, виды, основные части, КПД, экологические проблемы и пути их решения). Пути решения в гугле поискать, там ваще на логике всё. Тепловые двигатели - машина, в которой внутренняя энергия топлива превращается в механическую энергию Виды: 1. Паровая машина — Низкий КПД, большой вес, малая скорость. 2. ДВС: карбюраторный, дизельный — шум и выхлопные газы. 3. Грузовая и паровая турбина — шумовое загрязнение. 4. Реактивный двигатель — шумовое загрязнение. Основные части К 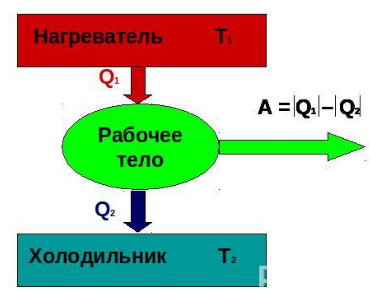 ПД — Коэффициент полезного действия теплового двигателя — отношение работы, совершаемое двигателем за цикл к количеству теплоты полученной от нагревателя. ПД — Коэффициент полезного действия теплового двигателя — отношение работы, совершаемое двигателем за цикл к количеству теплоты полученной от нагревателя.  |
