решение задач по теме Строение атома. Периодическая система химических элементов. Введение в основы химии
 Скачать 23.07 Kb. Скачать 23.07 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное автономное образовательное учреждение высшего образования «Южно-Уральский государственный университет (Национальный исследовательский университет)» Институт открытого и дистанционного образования Кафедра «Техники, технологий и строительства» Ответы на вопросы по теме «Введение в основы химии» Вариант № 6 КОНТРОЛЬНАЯ РАБОТА ЮУрГУ – 22.03.02.2020.12345 РГР
Челябинск 2020 1. 7s 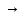 6p 6p2. 4 3. Электронная формула атома: Cd - 1s22s22p63s23p63d104s24p64d105s2. +48Cd)2)8)18)18)2; Относится к элементам d-семейства. Металл. Обозначение – Cd. Порядковый номер – 48. 4.
1s22s22p63s23p63d104s24p64f145s25p65d106s1.. 10 электронов на 5d-подуровне Ковалентность? Известны два ряда соединений золота, отвечающие степеням окисления +1 и +3. Так, золото образует два оксида - оксид золота (I) Au2O и оксид золота (III) Au2O3. Более устойчивы соединения, в которых золото имеет степень окисления +3. Электронная формула атома: Mg - 1s 2 2s 2 2p 6 3s 23P0 +12Mg)2)8)2 Из электронной формулы, например, атома магния l2Mg— 5 2з 2р >8 следует, что наружный Зх -уровень его имеет два электрона. Однако его атом в нормальном состоянии содержит два парных Зх-электрона, вследствие чего валентность равна 0. Ее можно довести до двух, если атом возбудить. 1S2 2S2 2P6 3S1 3P1- электронная формула возбуждённого атома. +49In)2)8)18)18)3; Валентные электроны атома индия можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое). В нормальном состоянии-1s22s22p63s23p63d104s24p64d105s25p1. в возбужденном состоянии - 1s22s22p63s23p63d104s24p64d105s1 5p2 Валентность (+1), (+2), +3 8. B: 1s2 2s2 2p1 → B3+: 1s22s02p0 9. Какой из элементов 2-го периода имеет наибольший радиус атома? +3 Li +6C +8O +9F Решение. Радиус атома растет по группе сверху вниз и по периоду справа налево. Поэтому во 2 периоду наибольший радиус имеет литий. 10. Гафний, потому что чем больше радиус, тем легче атом отдает электроны, тем в большей степени он проявляет металлические свойства. У гафния более выраженные свойства, потому что он в VI группе, а Титан в IV группе. По химической активности титан несколько превосходит цирконий и гафний. Сходство между свойствами этих металлов обусловлено одинаковым строением их внешних электронных оболочек и близкими размерами атомов и ионов. Изменение атомных радиусов элементов IV группы с возрастанием атомного номера обнаруживает тот же характер, что и смещение их в табл. И. Ковалентный радиус резко возрастает при переходе от углерода к кремнию, а затем при движении к олову обнаруживается зигзагообразный характер кривой. Те же зигзагообразные отклонения обнаруживают металлические радиусы. Ветвь кривой для -переходных металлов (титан, цирконий, гафний) располагается левее ветви для элементов главной подгруппы, причем цирконий и гафний имеют близкие атомные радиусы, а титан значительно меньший, вследствие чего точка для титана сильно отклонена вправо. Ветвь /-переходных металлов (церий, тербий, торий) расположена слева от кривой для титана, циркония и гафния п обнаруживает характерный излом. |

