южный федеральный университет химический факультет кафедра органической химии
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Федеральное государственное образовательное учреждение высшего профессионального образования «ЮЖНЫЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» ХИМИЧЕСКИЙ ФАКУЛЬТЕТ КАФЕДРА ОРГАНИЧЕСКОЙ ХИМИИ А.В. Гулевская, А.Ф. Пожарский МЕТОДИЧЕСКИЕ УКАЗАНИЯк курсу “Химия гетероциклических соединений” Часть I. Упражнения Ростов-на-Дону2007“Упражнения” предназначены для закрепления теоретического материала специализированного курса лекций “Химия гетероциклических соединений”, читаемого на кафедре органической химии ЮФУ. Большое количество задач различной сложности по каждой теме предполагает их решение как на семинарских занятиях, так и во внеаудиторное время (в виде индивидуальных домашних заданий). Задачи к главе “Гетероароматичность” Азепин может существовать в двух таутомерных формах. Какая из них преобладает и почему ?  Тиофен не вступает в реакцию Дильса-Альдера с малеиновым ангидридом даже в жестких условиях. В то же время бензо[c]тиофен легко реагирует с малеиновым ангидридом, давая продукт [4+2]-циклоприсоединения. Почему ? Какое из двух соединений N-метилизоиндол или N-метилиндола будет с большей вероятностью реагировать с малеиновым ангидридом ? Напишите уравнение соответствующей реакции. Какие из приведенных ниже гетероциклов можно отнести к: а) ароматическим; б) антиароматическим; в) неароматическим ? 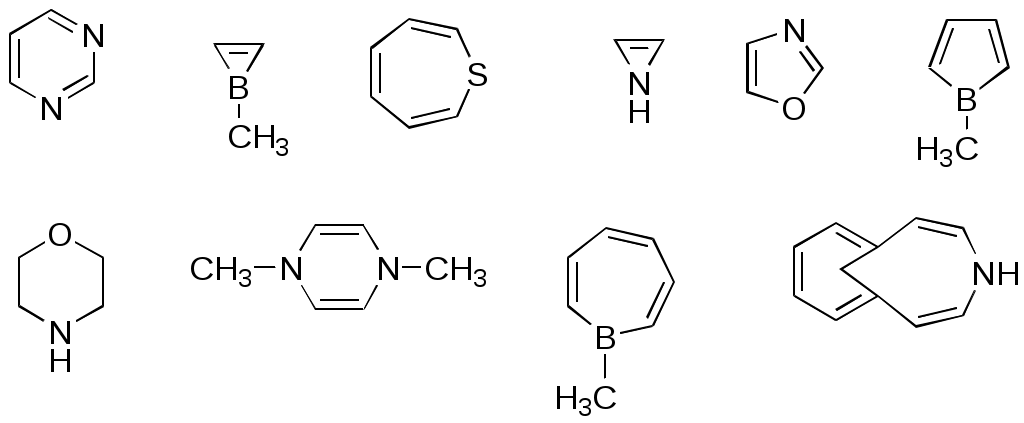 Объясните различие в поведении пиррола и фурана в следующих реакциях:  Как объяснить, что оксепин крайне неустойчив, в то время как бензоксепины и дибензоксепины, особенно с акцепторными заместителями, достаточно стабильны (например, бензоксепиндикарбоновая кислота) ? 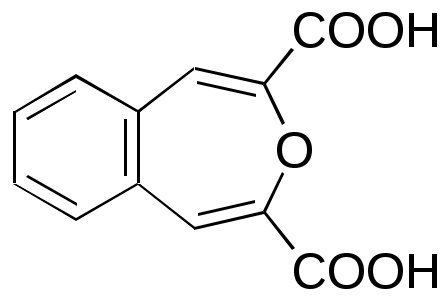 Что, по-Вашему мнению, является движущей силой следующих превращений ? К какому типу реакций относится каждое из них ?  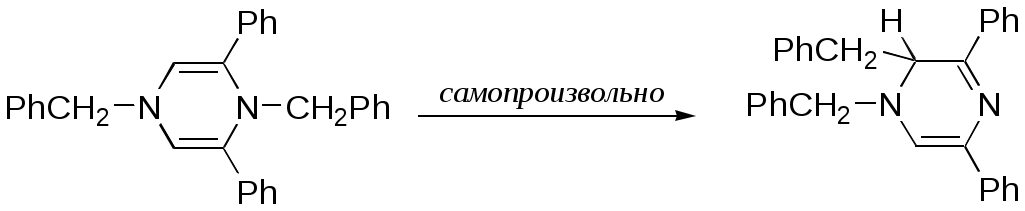 В отличие от ароматического 1Н-азонина бензо[d]-1Н-азонин проявляет свойства полиена. Почему ? Соединение А быстро окисляется при обработке хлорной кислотой и образует перхлорат [C20H12O4]2+ 2ClO4¯ . В ПМР спектре этой соли наблюдаются сигналы при 11.17 м.д. и 12.13 м.д. с соотношением интегральных интенсивностей 2:1. Приведите структурную формулу перхлората и объясните его быстрое образование. 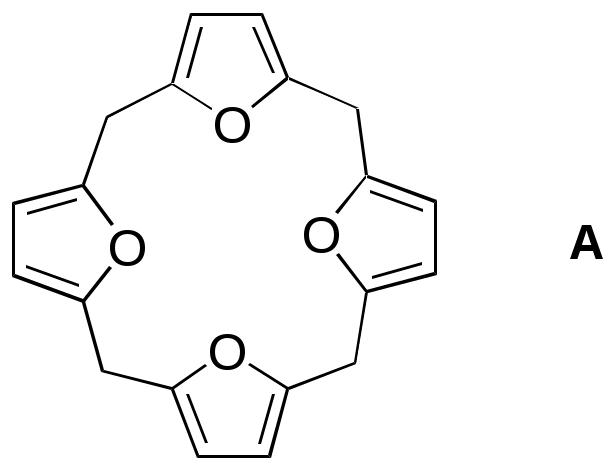 10. Из тиофена и дицианоацетилена в две стадии может быть получен фталодинитрил. Напишите уравнения соответствующих реакций с учетом механизма. Задачи к главе “Концепция -избыточности и -дефицитности в химии гетероароматических соединений” Охарактеризуйте тип гетероатомов в каждом из следующих соединений: 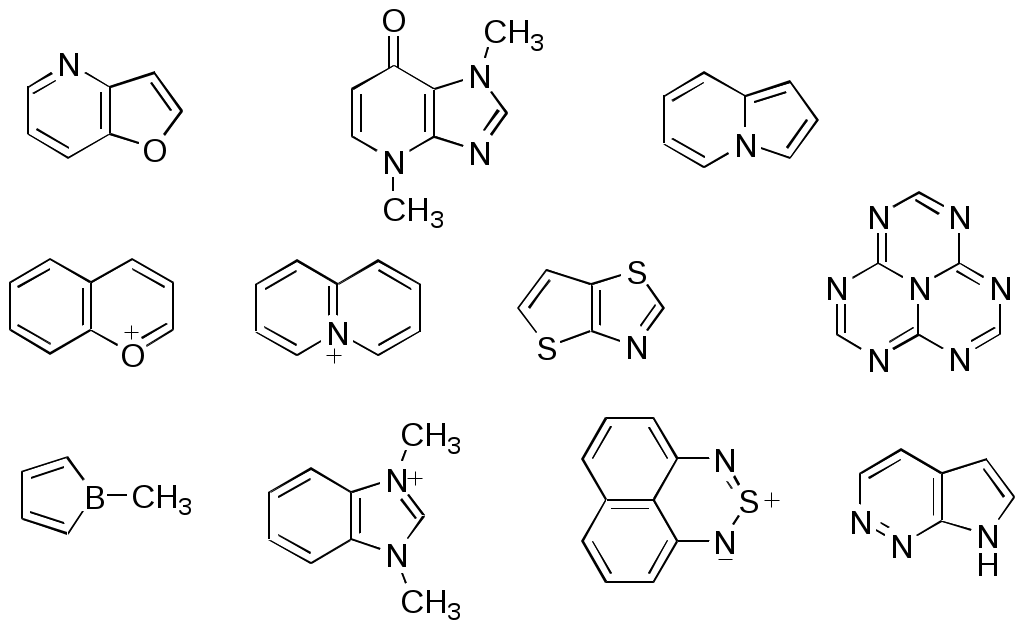 Какие из перечисленных гетероциклов относятся к -избыточным ? -дефицитным ? -амфотерным ? Почему ? 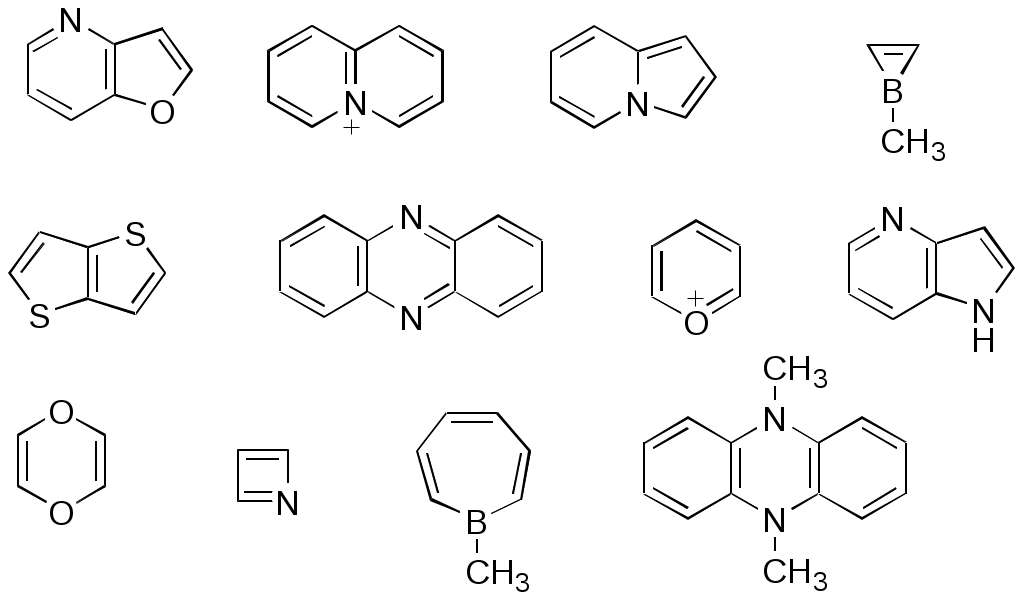 Используя концепцию -избыточности и -дефицитности, попытайтесь объяснить, почему реакции индолизина с электрофилами протекают в пятичленное, а не шестичленное кольцо. Задачи к главе “ Электронодонорные и электроноакцепторные свойства гетероциклов” Что образуется при одноэлектронном восстановлении 4,4’-биспиридиниевой соли А ? Напишите несколько резонансных структур этой частицы. Какова структура продукта двуэлектронного восстановления соли А ? Охарактеризуйте его с точки зрения ароматичности и -электронного распределения. 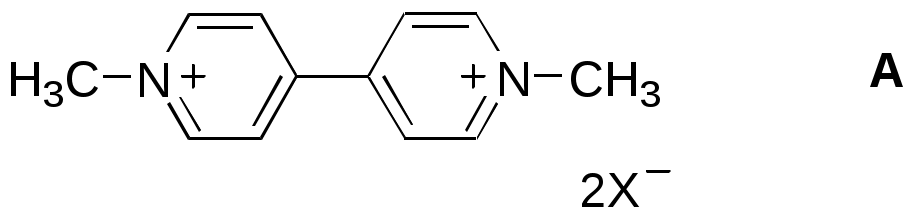 Анион-радикал пиридина в большинстве растворителей димеризуется практически мгновенно, а анион-радикал 3,5-диметилпиридина в большинстве растворителей не димеризуется вообще. Объясните различия в поведении двух анион-радикалов. Какую структуру должен иметь, на Ваш взгляд, продукт димеризации анион-радикала 4-метилпиридина ? Полоса переноса заряда в -комплексах 10-алкилфенотиазинов с электроноакцепторами заметно смещается в коротковолновую область по сравнению с аналогичными комплексами самого фенотиазина, хотя учитывая +I-эффект алкильных групп следовало ожидать смещения в противоположную сторону. Объясните этот факт.
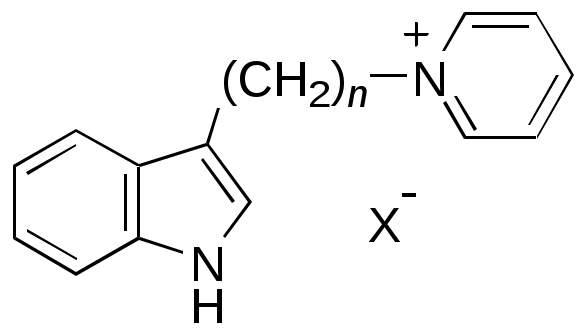
Как объяснить, что 2,3-дигидроперимидины бесцветны в отличие от желтого перимидина, а 2-(п-нитрофенил)-2,3-дигидроперимидин имеет оранжевую окраску ? Почему 2-аминоперимидин бесцветен, а 2-цианоперимидин – ярко-красный ? Объясните изменение окраски в следующем ряду соединений (обратите внимание, что соли N-алкилпиридиния и 3-алкилиндолы – бесцветны):
Дипольный момент бетаина А уменьшается при увеличении его концентрации в растворе диоксана. В то же время дипольный момент соединения В (18.7 D) остается неизменным при аналогичном увеличении концентрации. Почему ?  Задачи к главе “ Реакционная способность гетероатомов” Бензол (1 часть) растворяется при 20 оС в 600 частях воды, в то время как пиридин смешивается с водой в любых соотношениях. Объясните это различие. Период полураспада 1-ацетилимидазола в воде 41 мин при 20 оС, тогда как амиды карбоновых кислот в этих условиях не гидролизуются. Почему ? Почему пиридинсульфокислоты в отличие от пиколинов (метилпиридинов) не образуют N-оксидов при действии надуксусной кислоты ? Расположите приведенные соединения в ряд по увеличению их основности: 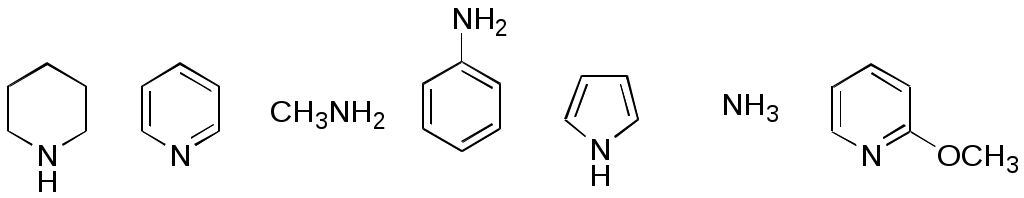 Хинолин и нафталин образуют молекулярные комплексы с бромом (1:1) с константами устойчивости 115 и 0.231 моль-1 (ССl4, 20 оС) и максимумами поглощения при 290 и 346 нм соответственно. Объясните причины этих различий. Акридин основнее пиридина, а бензо[h]хинолин наоборот. Чем это можно объяснить ? 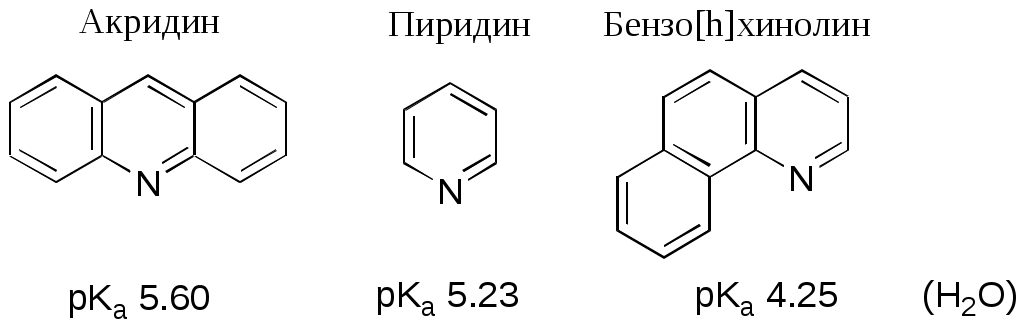 -Пирон проявляет более сильные основные свойства, чем ацетон или дивиниловый эфир. Почему ? Какой из атомов кислорода в молекуле -пирона более основен ? 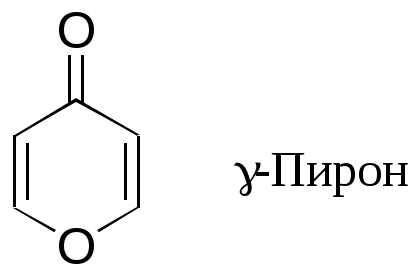 Почему 8-оксихинолин имеет весьма низкую т.пл. 75-76 оС и в отличие от -нафтола легко перегоняется с водяным паром ? В чем сущность аналитического метода определения ионов магния с использованием этого реагента ? Объясните изменение дипольных моментов и температур кипения для следующих 1,3-азолов. 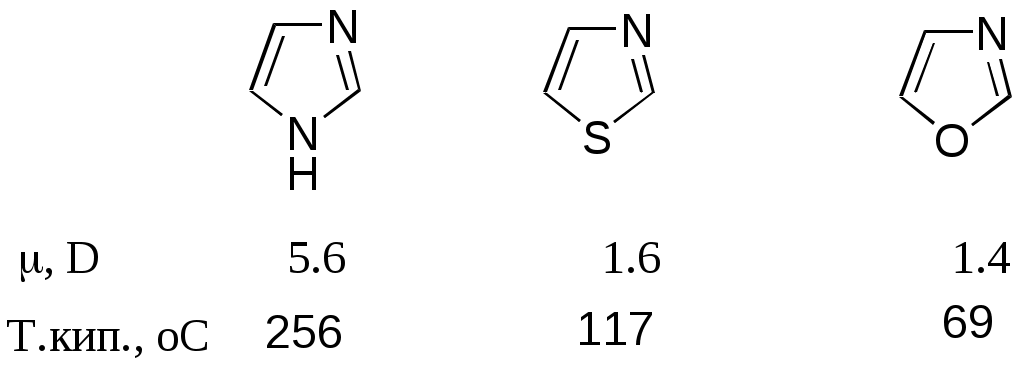 Объясните изменение длин связей в имидазоле при его протонировании (длины связей даны в Å): 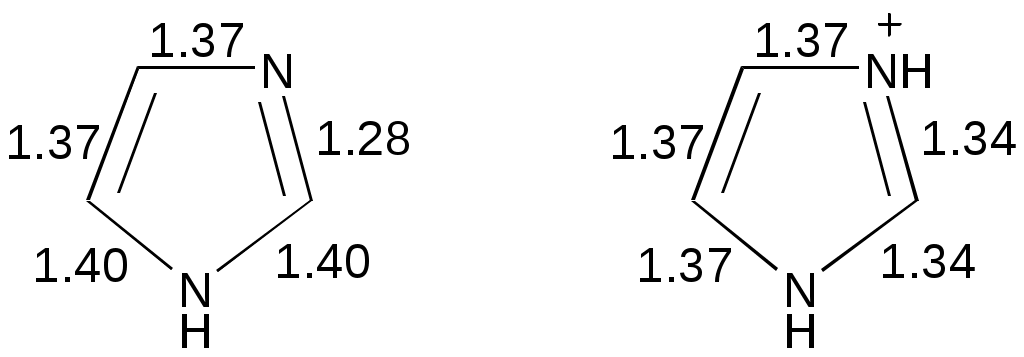 Объясните различную направленность следующих реакций. К какому типу относится каждая из них ? 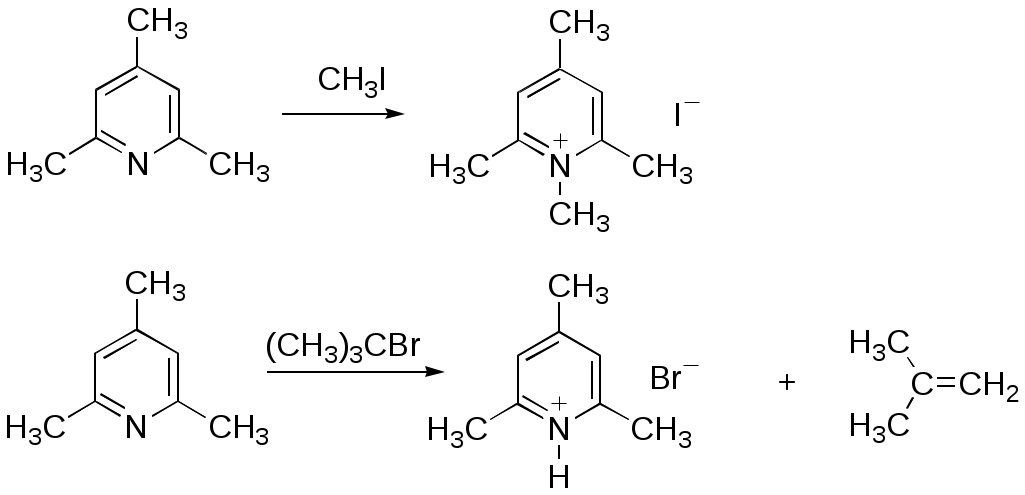 Хинолин и его производные образуют молекулярные комплексы с бромом. Ниже приведены величины констант устойчивости некоторых их них. Объясните причины различий. 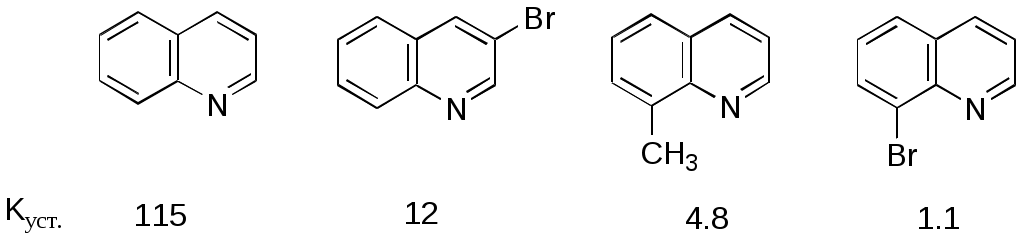 Объясните изменение основных свойств в следующем ряду соединений: 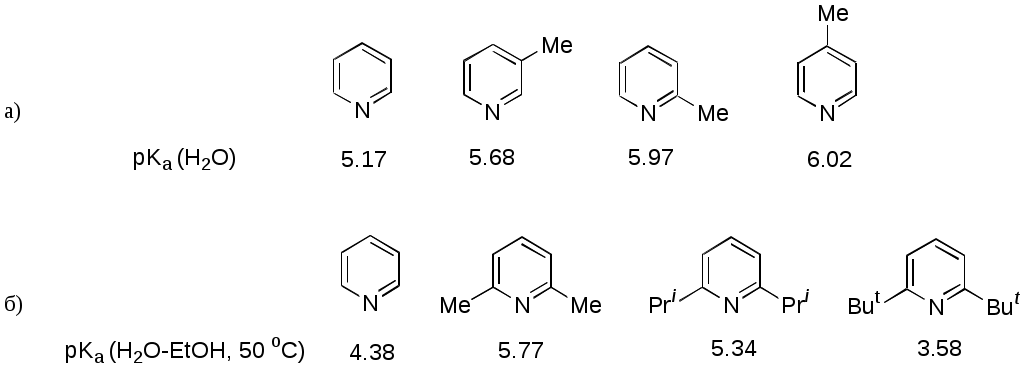 Расположите следующие соединения в порядке увеличения основности: 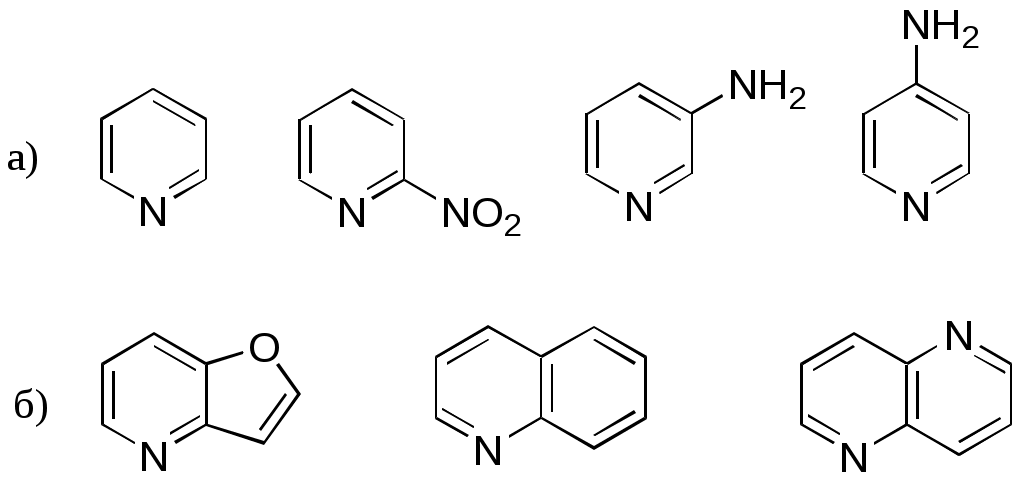 Объясните различия в значениях рКа для следующих соединений: а) 1-аминоизохинолин (рКа = 7.62) и 3-аминоизохинолин (рКа = 5.0); б) 3-аминоакридин (рКа = 8.04), 4-аминоакридин (рКа = 4.40) и 9-аминоакридин (рКа = 9.99). Расположите соединения в порядке увеличения NH-кислотности: 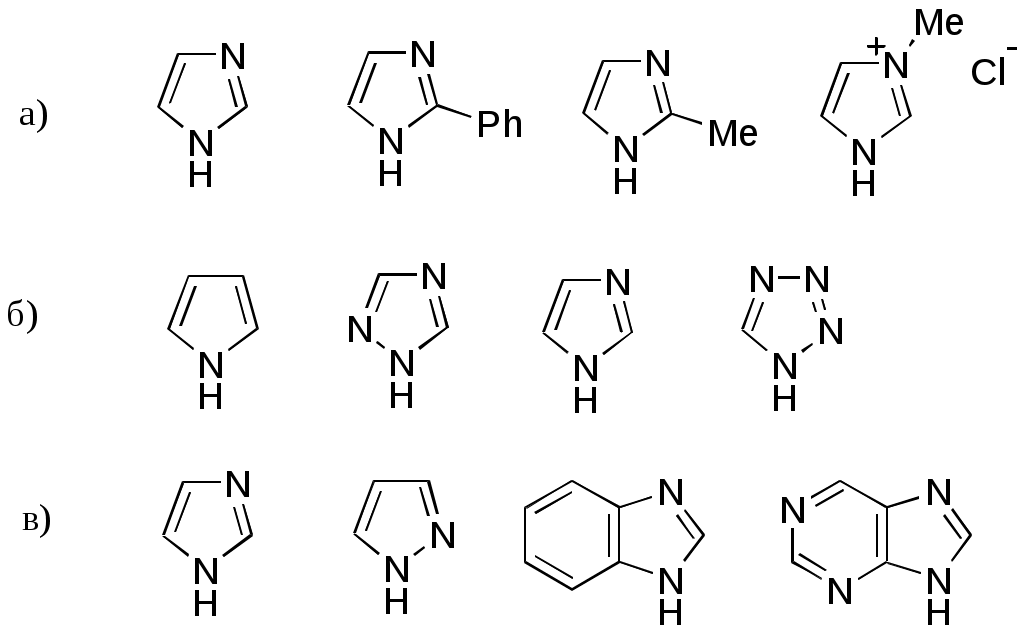 Напишите уравнения реакций бензимидазола со следующими реагентами: а) диметилсульфат в среде КОН – Н2О; б) ацетилхлорид в бензоле; в) триметилсилилхлорид в присутствии триэтиламина. Составьте уравнения реакций индазола со следующими реагентами: а) ацетилхлорид в бензоле; б) йодистый метил в среде КОН – этанол. Закончите уравнения следующих реакций: 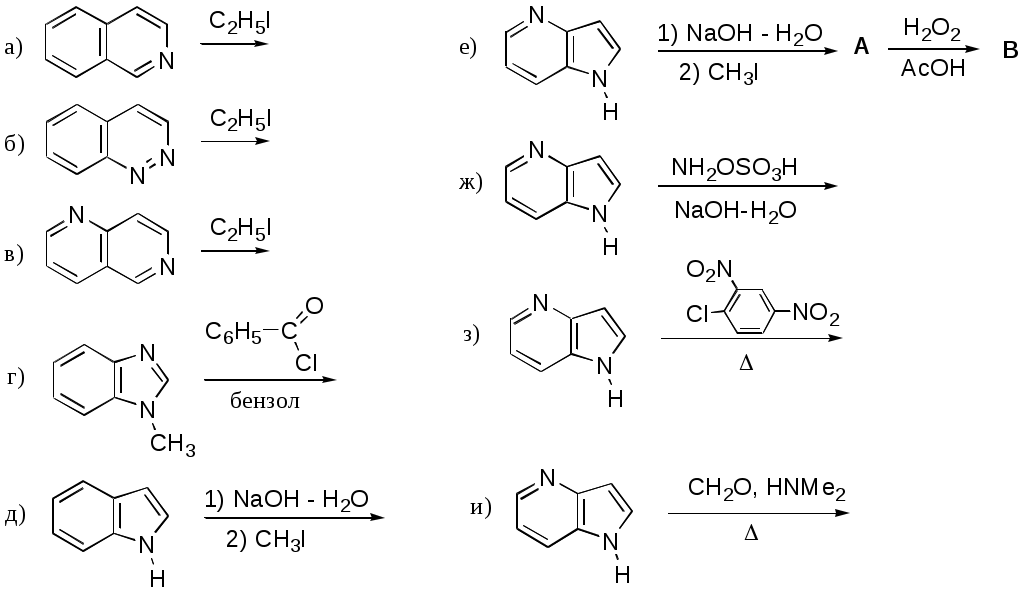 При действии на пиридин (2 моля) фосгена (1 моль) в пентане образуется аддукт состава 2:1 с выходом 92 %. Для него известны следующие спектральные данные: (KBr) 1752 см-1; 1Н ЯМР (CDCl3, -55 оС) 9.54 (2Н, д), 8.43 (1Н, т), 8.03 (2Н, дд), 7.51 (1Н, д), 7.46 (1Н, д), 7.33 (1Н, дд), 5.61 (1Н, дд), 5.55 (1Н, дд). В спектре ЯМР 13С , зарегистрированном при низкой температуре, присутствует сигнал при 64.3 м.д. Соединение легко разлагается в растворе с образованием пиридина и фосгена. Предложите структуру соединения и механизм его образования. Пентациклический амидин А – одно из наиболее сильных известных органических оснований (pKa в ацетонитриле 29.22). По какому атому азота происходит протонирование ? Какие факторы определяют его высокую основность ? Напишите несколько резонансных структур для катиона соединения А. 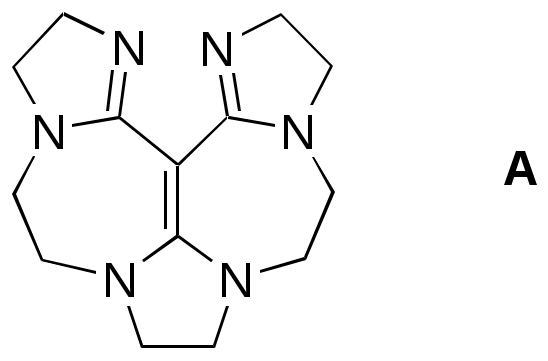 Почему данная реакция протекает слева направо ? 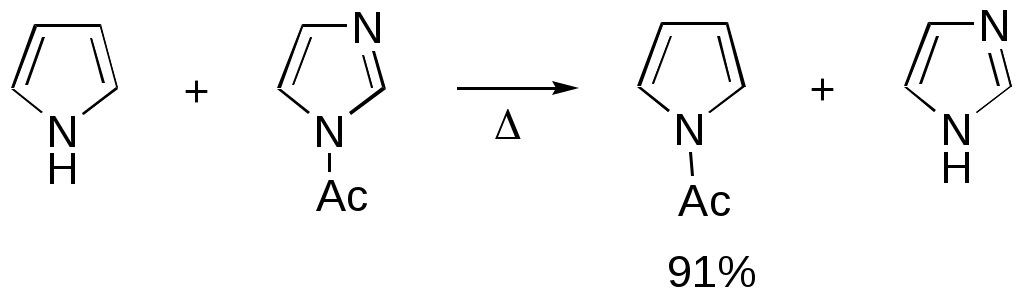 В молекуле пиррол-2-карбоксальдегида существует значительный барьер вращения формильной группы (11 ккал/моль) и частота валентных колебаний С=О группы понижена (1667 см-1). Наиболее стабилен син-конформер. Объясните эти факты. Почему это соединение не вступает в реакции, характерные для ароматических альдегидов ? При обработке 2-аминопиридина йодистым метилом образуется 1-метил-2-аминопиридиний йодид. В аналогичных условиях 3-аминопиридин кватернизуется по аминогруппе. Объясните различия в поведении этих соединений. Составьте уравнения соответствующих реакций. Предложите механизм следующих превращений: 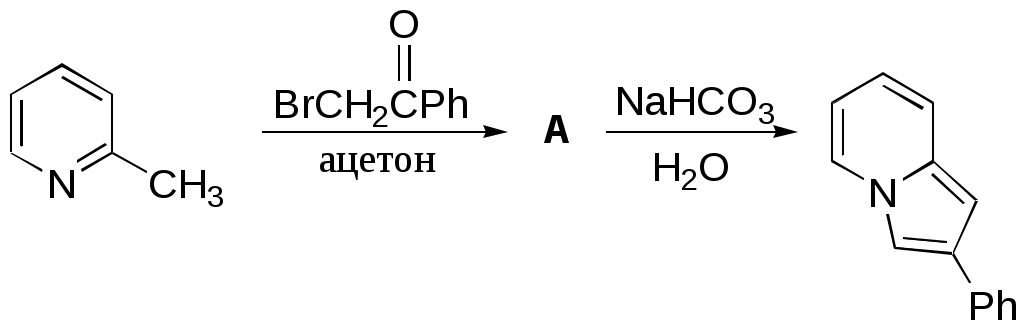 Задачи к главе “Таутомерия гетероароматических соединений” Нарисуйте наиболее вероятные таутомерные структуры следующих соединений: а) 1-гидроксиизохинолин; б) 3-аминохинолин; в) пиримидинтиол-4; г) 2-гидроксифуран; д) 2,4,6-тригидроксипиримидин. Какая из них должна преобладать в водном растворе ? Какие из перечисленных ниже соединений могут существовать в таутомерных формах, содержащих внутримолекулярные водородные связи ?  Сульфаниламидное производное пиримидина А существует преимущественно в иминоформе. Почему ? 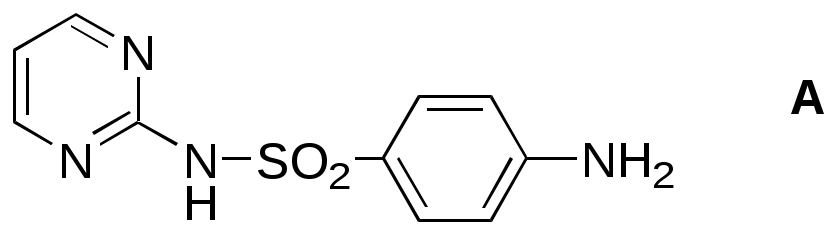 Какой из изомерных монометилптеридинов должен быть наименее реакционноспособным в реакции конденсации с бензальдегидом в условиях основного катализа ? Ответ поясните. Составьте соответствующие уравнения реакции. Приведите все возможные таутомерные формы 4-гидроксипиридазина, 2-гидроксипиразина и 2-амино-6-гидроксипурина. 1-Гидроксиизохинолин и 2-гидроксихинолин существуют в водном растворе преимущественно в оксо-форме. В отличие от этого содержание гидрокси- и оксо-форм в водном растворе 3-гидроксиизохинолина приблизительно одинаково. Объясните причины различий. 2-Гидроксипиридин в нейтральных растворах находится преимущественно в виде 2-оксо-формы. В то же время 6-гидрокси-7-азаиндол существует преимущественно в гидроксиформе. Как объяснить это различие ? В отличие от 2-(4-нитробензил)пиридина А, изомерное соединение В обладает фотохромными свойствами. Объясните причины его фотохромизма. 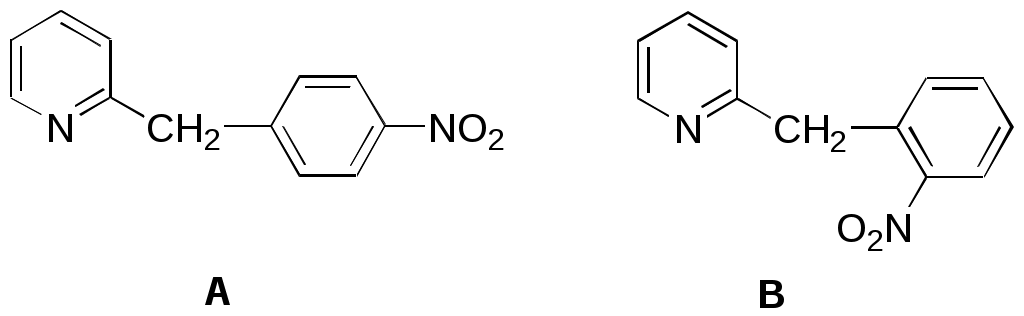 Почему в отличие от 3-гидроксифурана 2-ацетил-3-гидроксифуран существует в растворе преимущественно в гидрокси-форме ? Объясните изменение константы таутомерного равновесия (Н2О, 25 оС) в следующем ряду соединений:  Для приведенных ниже соединений были сняты УФ спектры. Оказалось, что два спектра практически одинаковы. Каким веществам они принадлежат ? 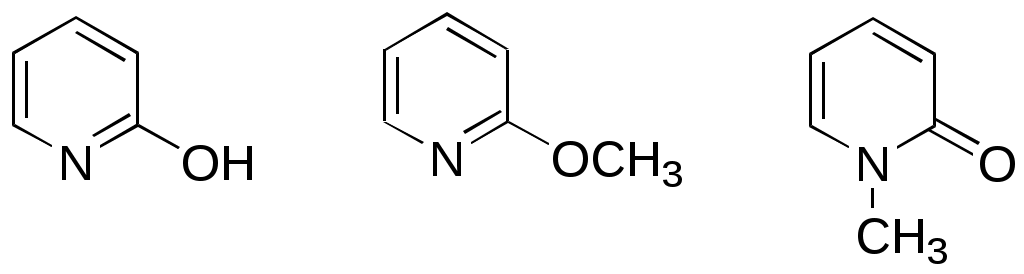 Напишите уравнения реакций 2-гидроксипиридина и 3-гидроксипиридина с йодистым метилом в щелочном растворе. Объясните различия в поведении изомерных молекул.. Расшифруйте продукты следующих превращений: 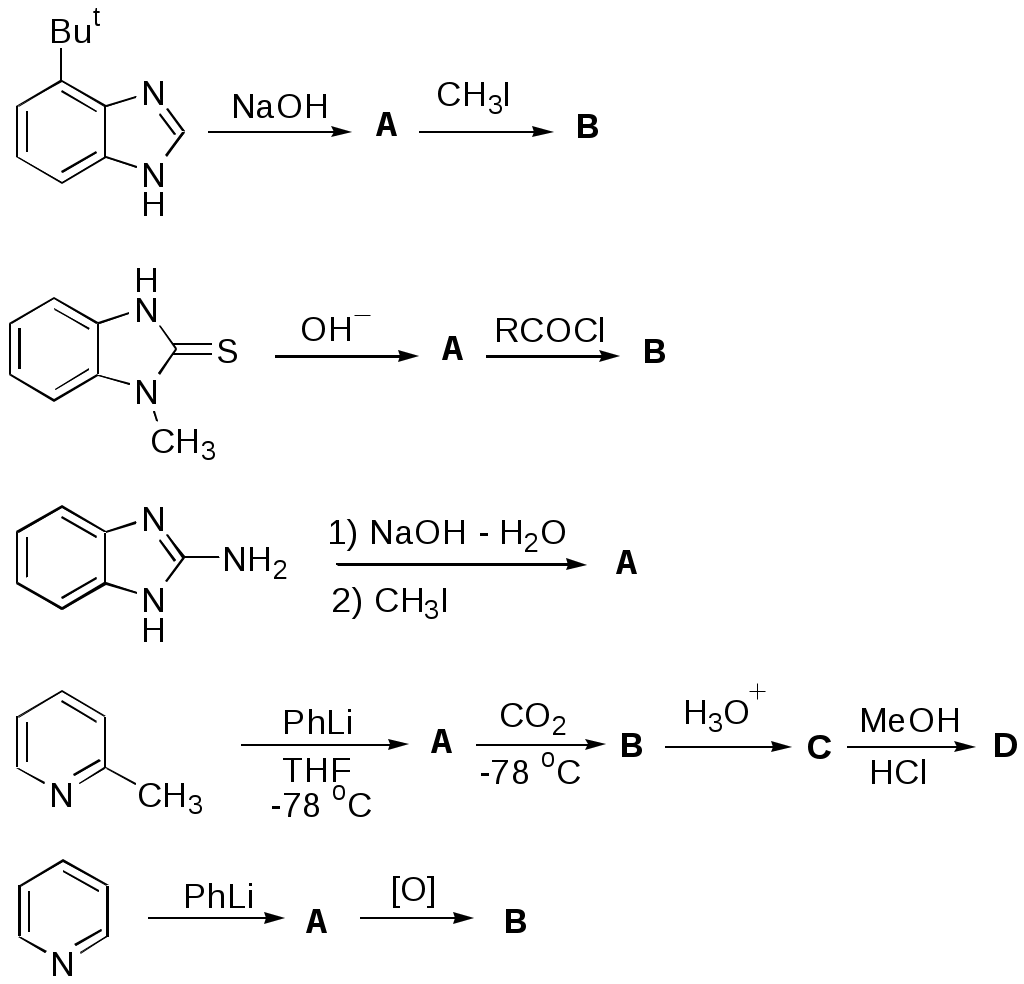 Какие продукты образуются в приведенных ниже реакциях ? 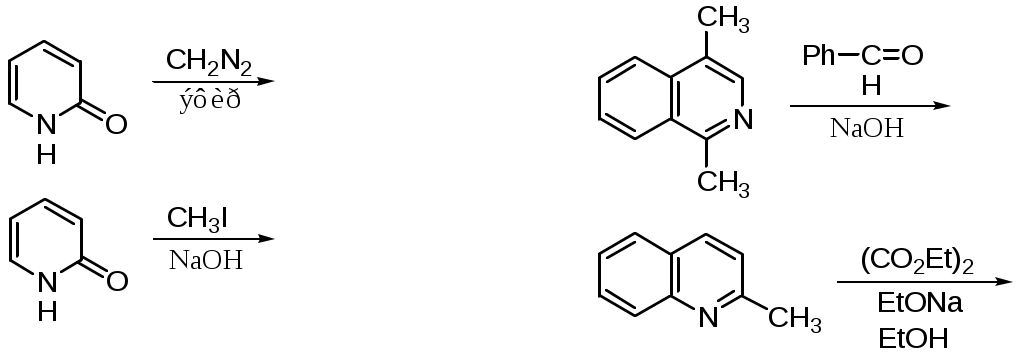 Закончите уравнения реакций конденсации бензальдегида с N-метилпиридиниевыми солями. 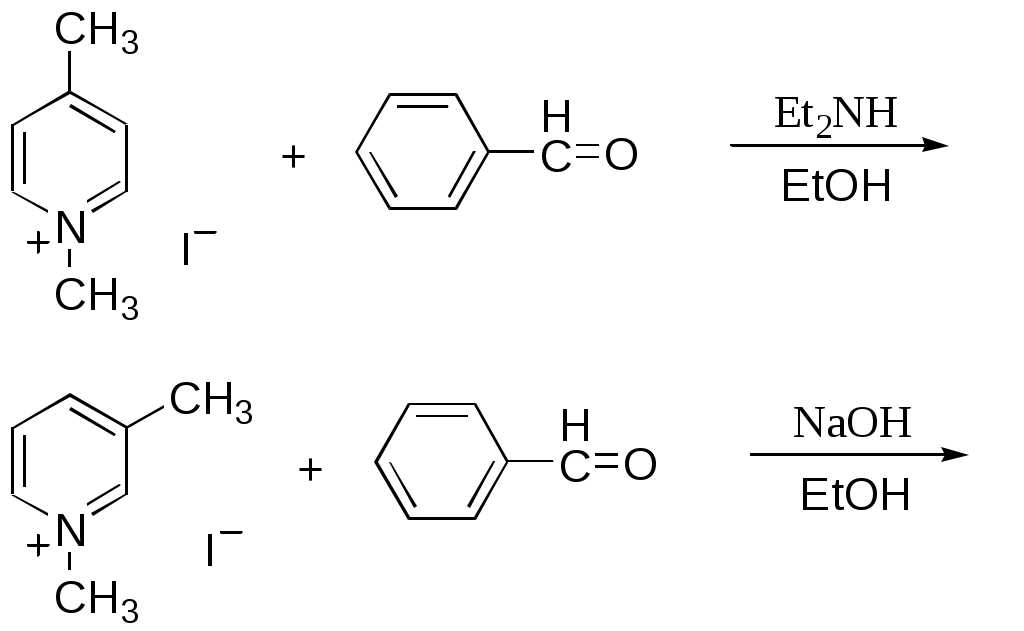 Задачи к главе “Гетероароматическое электрофильное замещение” Объясните различную направленность следующих реакций: 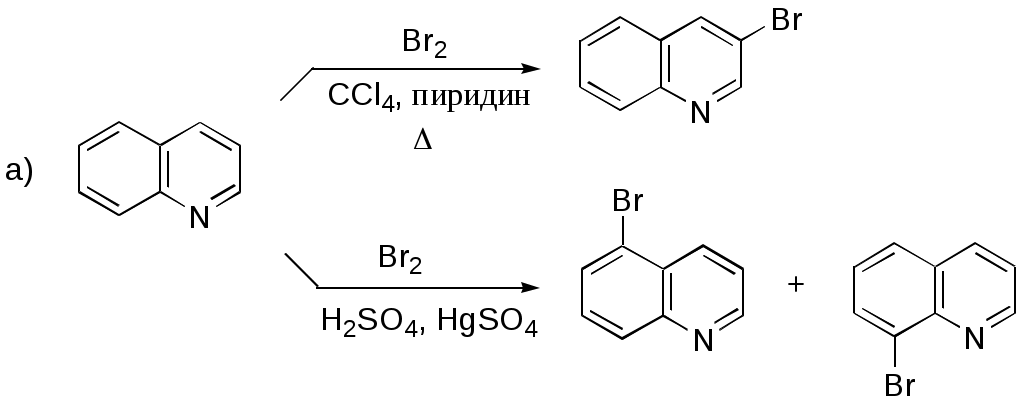 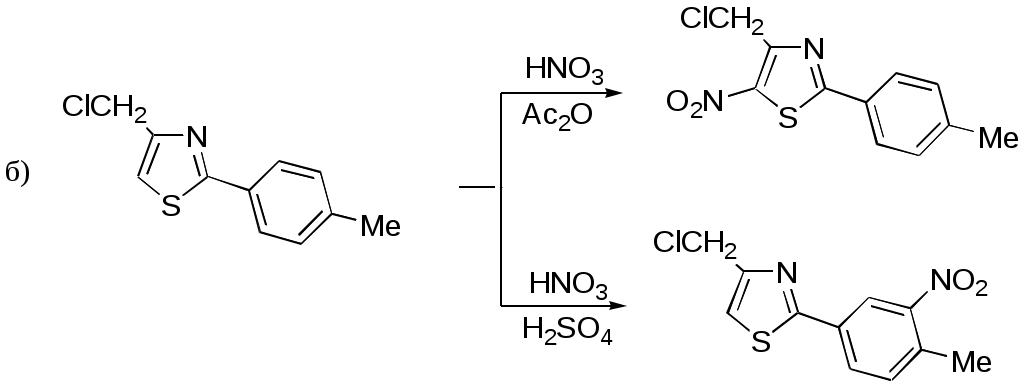 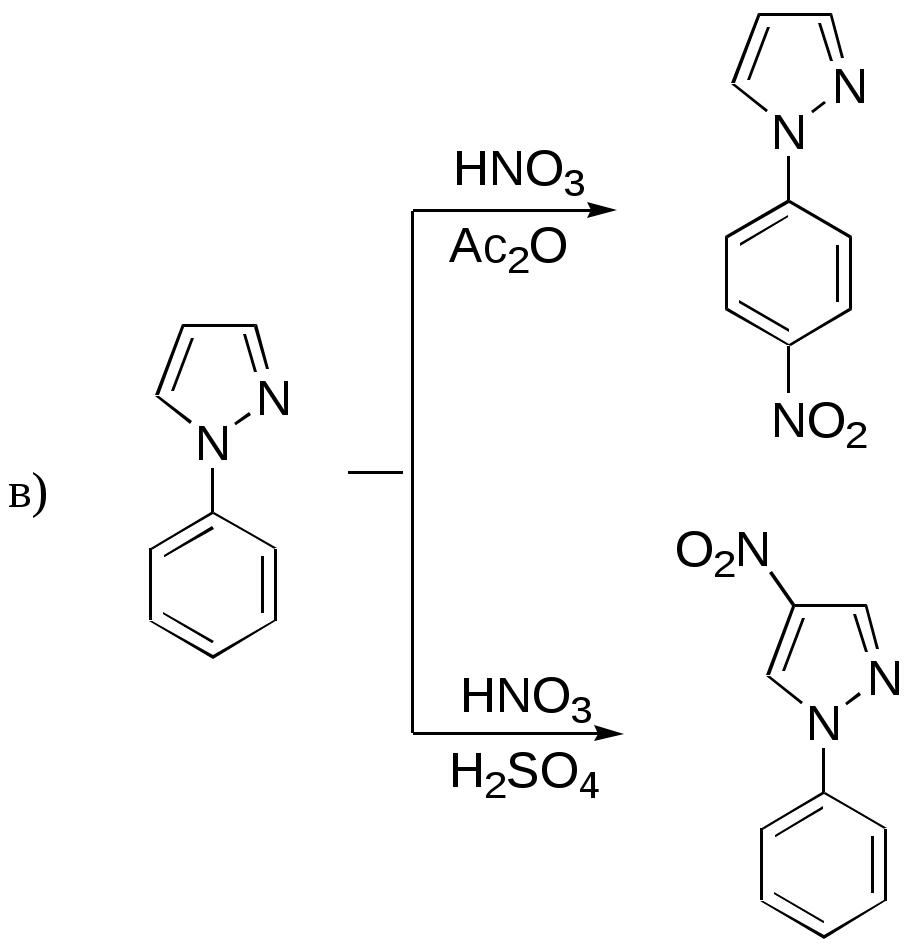 Предскажите наиболее вероятное направление электрофильной атаки в следующих соединениях: а) 1-метилпиррол; б) 2,4-диметилпиррол; в) 5-метилпиррол-2-карбоновая кислота; г) 2-формилфуран; д) 2-гидрокситиофен; е) бензотиофен-3-карбоновая кислота; ж) 1-фенилизоиндол. Пиридин инертен к действию серной кислоты или олеума и даже при длительном нагревании при 320 оС пиридин-3-сульфокислота образуется с низким выходом. С другой стороны, 2,6-ди-трет-бутилпиридин сульфируется по положению 3 в системе SO3 / SO2 уже при 60 оС на 74 %. Объясните это различие. Расшифруйте продукты следующих превращений: 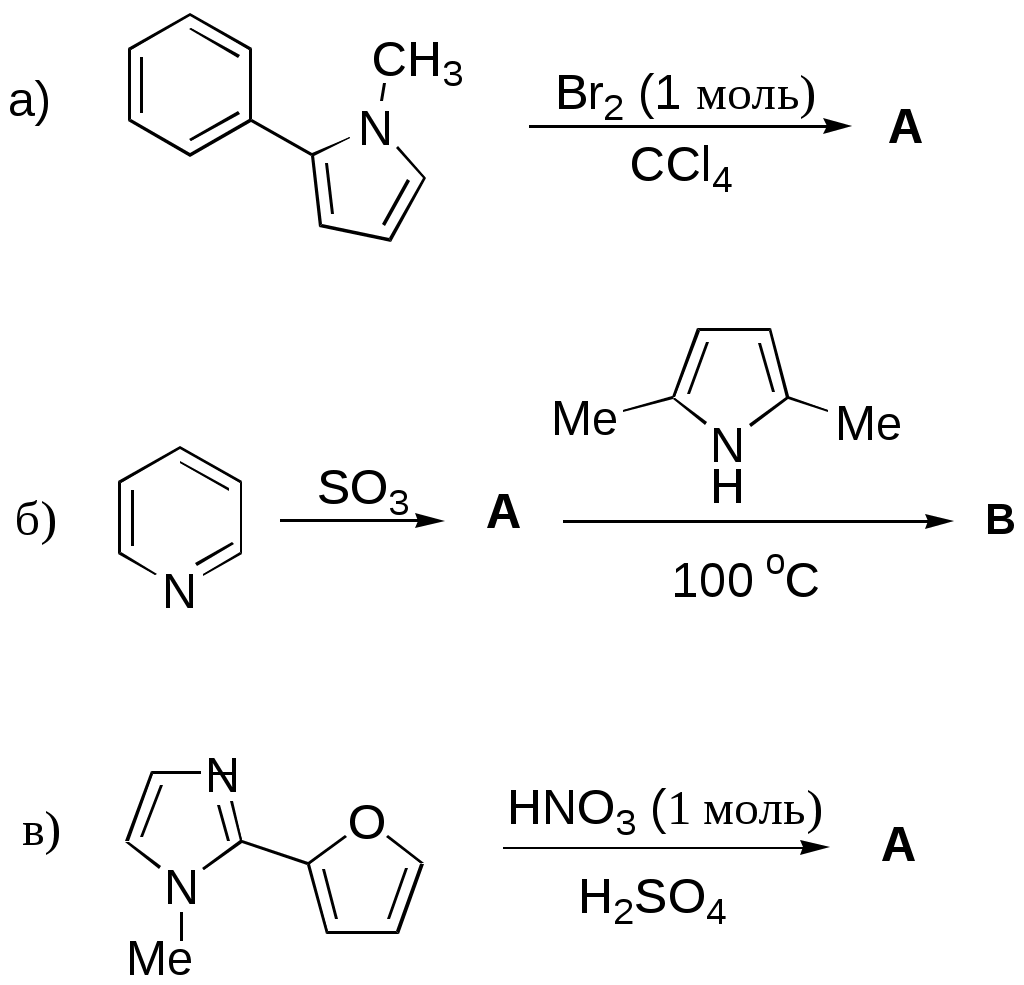 Технический бензол обычно загрязнен тиофеном, так как у этих веществ температуры кипения близки. Бензол, свободный от тиофена, можно получить встряхиванием его с дымящей серной кислотой. После отделения нижнего (кислотного) слоя верхний (органический) слой промывают водой. Затем органический слой отделяют, высушивают и перегоняют. Дистиллят полностью свободен от тиофена. Объясните роль серной кислоты, составьте уравнение реакции. При нитровании 2-метилтиофена азотной кислотой в уксусном ангидриде образуется 70 % 5-нитропроизводного и 30 % 3-нитропроизводного. Объясните направленность и соотношение изомеров в данной реакции. -Пирролальдегид может быть получен из пиррола по реакции Реймера-Тимана. Однако реакция протекает неоднозначно, наряду с -пирролальдегидом образуется некоторое количество 3-хлорпиридина. Предложите механизм образования основного и побочного продукта. Индол А нагревают с карбонатом калия в ацетонитриле и получают низкоплавкое кристаллическое соединение с брутто-формулой С10Н9N, в ИК спектре которого отсутствует полоса поглощения группы NH. Предложите структуру полученного соединения и объясните его образование. 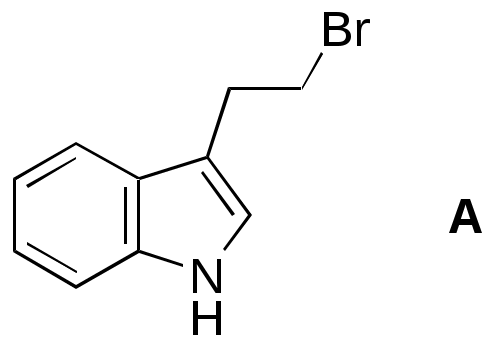 Почему фуран сульфируют пиридинсульфотриоксидом, а пирослизевую кислоту концентрированной серной кислотой ? Составьте уравнения соответствующих реакций. Допишите уравнения следующих реакций и объясните, почему вторая идет в 30 тыс. раз быстрее первой. 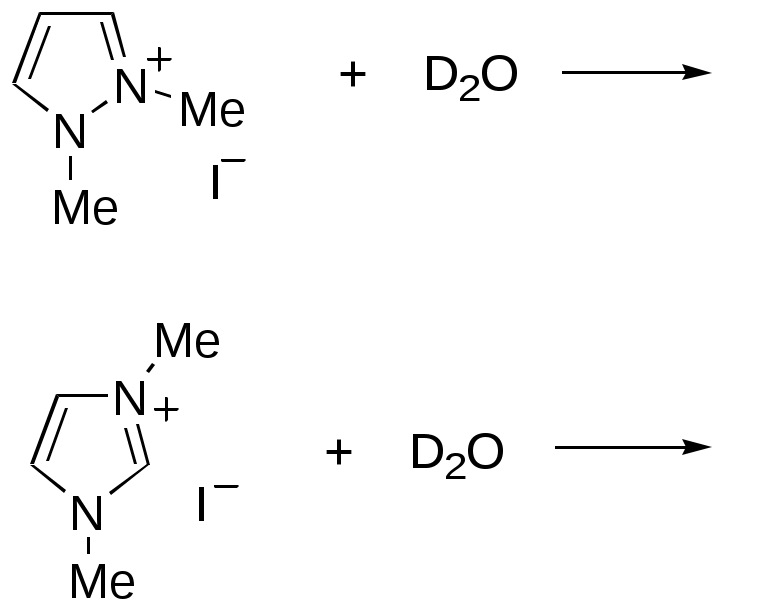 Составьте уравнения реакций тиофена со следующими реагентами: а) дымящая азотная кислота в среде уксусной кислоты; б) дымящая серная кислота; в) ацетилхлорид в присутствии хлорида алюминия; г) формальдегид в присутствии HCl. Имидазол нитруется нитрующей смесью при 100 оС, образуя 4(5)-нитроимидазол с выходом 75 %. Получить продукт монобромирования имидазола достаточно трудно: даже при комнатной температуре действие брома в хлороформе ведет к 2,4,5-трибромимидазолу. Почему ? При взаимодействии 4-диметиламинобензальдегида и соляной кислоты с пирролом (реакция Эрлиха) быстро развивается пурпурное окрашивание. Что образуется ? Напишите уравнение реакции и объясните наличие окраски. Почему 2-гидроксиметилпирролы неустойчивы в кислой среде ? Приведенные ниже соединения расположите в ряд по увеличению нуклеофильности в реакциях электрофильного замещения. 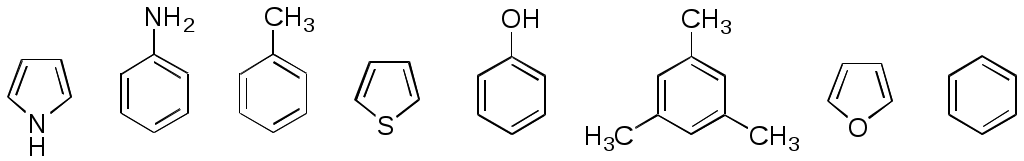 Как получить 2-амино-1-метилпиррол исходя из 1-метилпиррола ? Как получить 3-аминопиридин исходя из пиридина ? Определение тиофена в техническом бензоле основано на его реакции с изатином (индофениновая реакция), приводящей к появлению характерного синего окрашивания. Предложите свой вариант механизма этой реакции. Почему индофенин окрашен ? 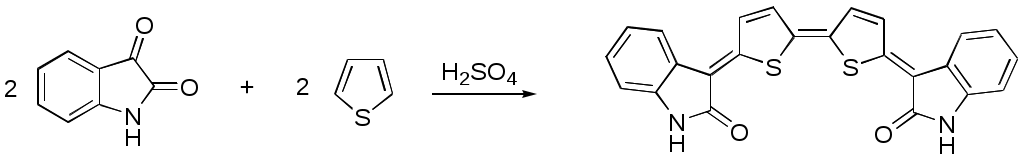 Формилирование пиррола по Гаттерману проводят по схеме: 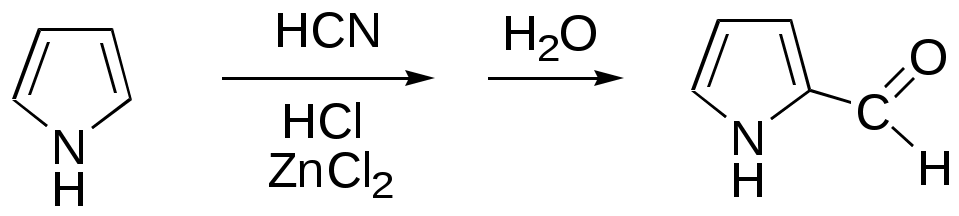 Напишите механизм реакции. Задачи к главе “Гетероароматическое нуклеофильное замещение” 3-Этинилпиридин при нагревании с амидом натрия в псевдокумоле с выходом 54 % дает кристаллическое соединение с брутто-формулой С7H6N2, не содержащее тройной связи и растворимое в щелочи. Предложите его структуру и напишите уравнение реакции. Как объяснить, что при действии на 3-хлорпиридин пирролидинидом лития образуется смесь 3- и 4-пирролидинопиридинов, в то время как 4-хлорпиридин в тех же условиях дает исключительно 4-пирролидинопиридин ? 2,6-Диметил--пирон при действии диметилсульфата и затем хлорной кислоты превращается в соединение с брутто-формулой [C8H11O2]+ ClO4¯. Простая перекристаллизация из этанола превращает эту соль в [C9H13O2]+ ClO4¯. Какова структура обоих перхлоратов ? Почему реакция с этанолом происходит с такой легкостью ? N-Метилпиридиний хлорид при действии водной щелочи и мягкого окислителя (ферроцианида калия) дает твердое вещество с брутто-формулой С6H7NO, в ИК спектре которого отсутствует полоса поглощения, соответствующая гидроксильной группе. Какова структура полученного соединения и как оно образуется ? Возможна ли аналогичная реакция в случае пиридина ? Предложите механизмы следующих реакций: 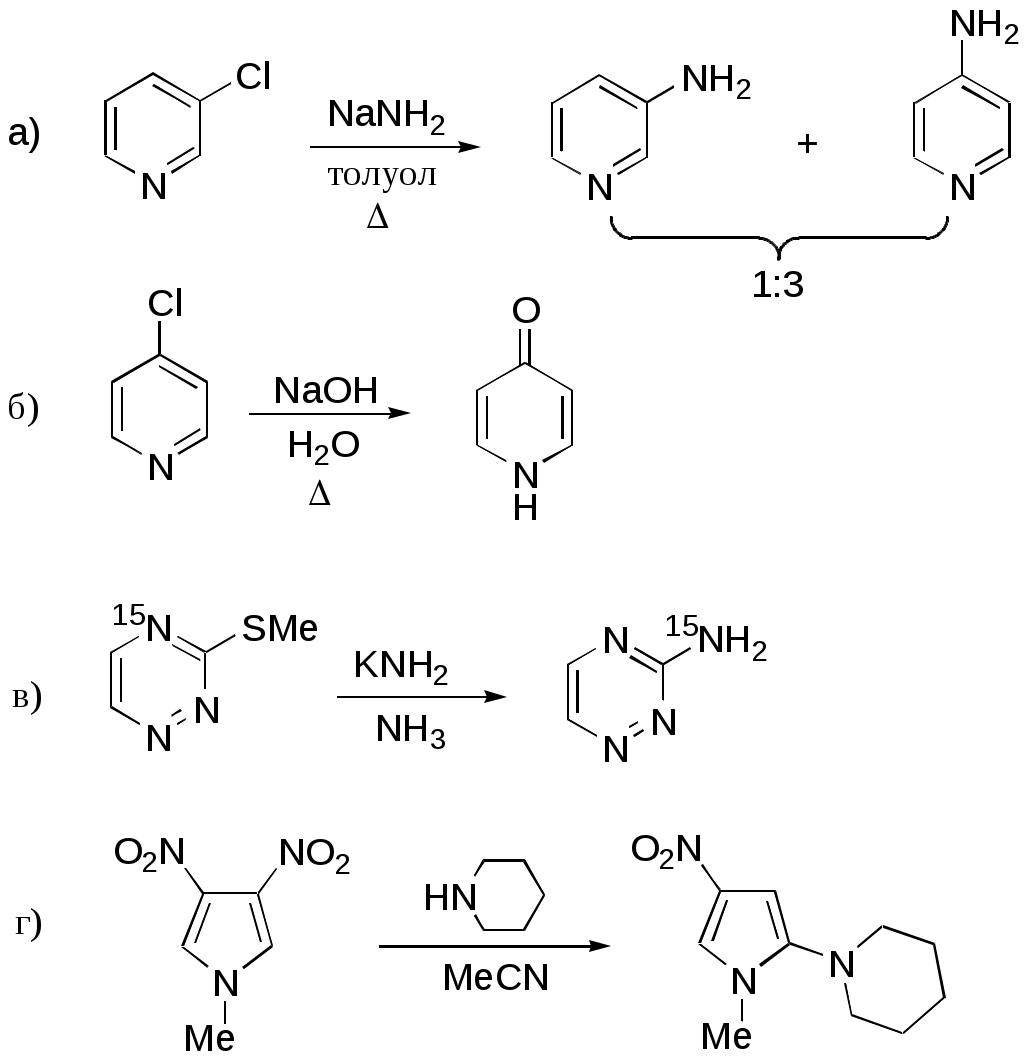 Предложите 2 метода синтеза 2-хлорпиридина из пиридина. Закончите уравнения реакций: 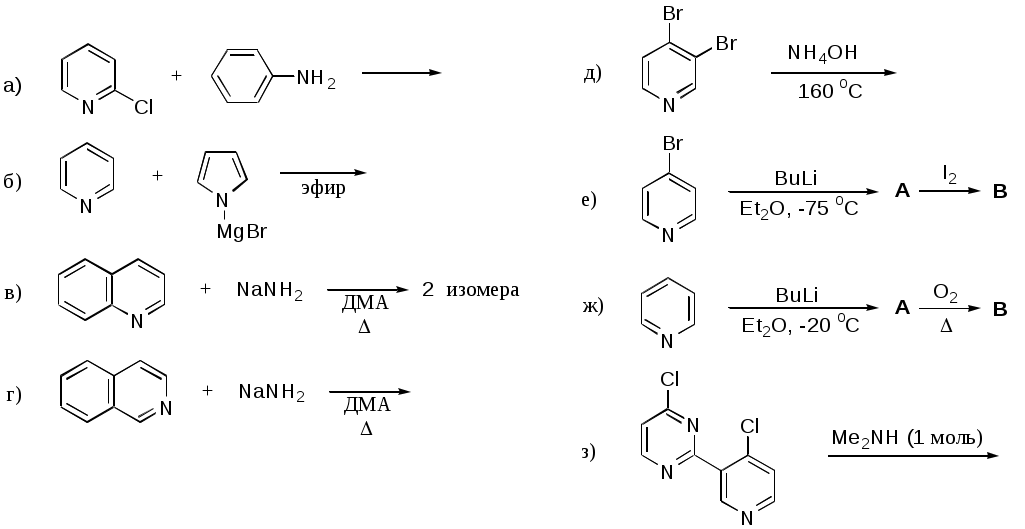 Перхлорат 2,4,6-трифенилпирилия при действии ¯CH2NO2 рециклизуется в 2,4,6-трифенилнитробензол. Каков механизм данного превращения ? Предложите механизм перегруппировки Коста-Сагитуллина: 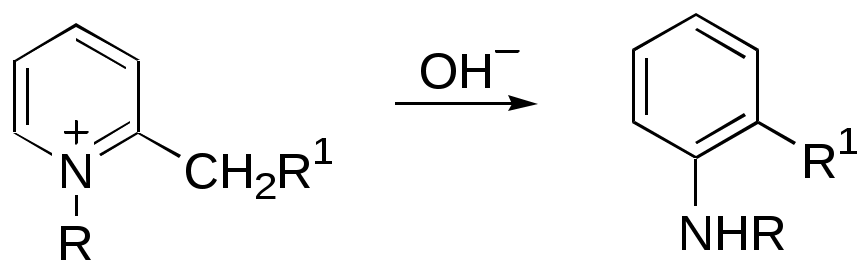 Как превратить: а) перхлорат 2,4,6-трифенилпирилия в перхлорат N-этил-2,4,6-трифенилпиридиния; б) перхлорат тиапирилия в пиридин ? Составьте уравнения реакций с учетом механизма. Предложите механизмы следующих рециклизаций: 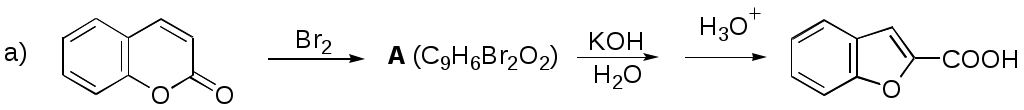 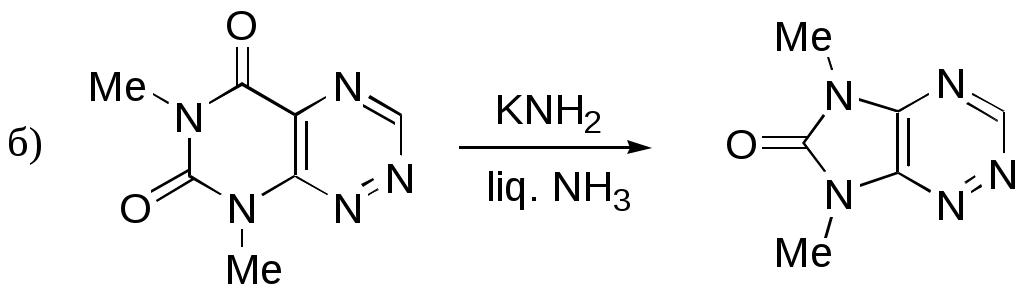 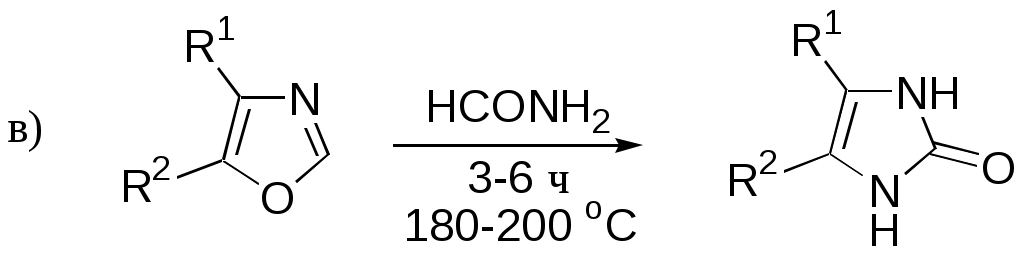 Расшифруйте продукты следующих превращений: 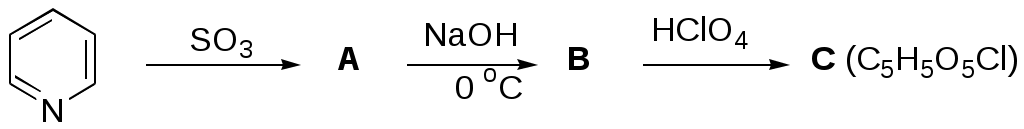 13. Предложите механизм следующей рециклизации: 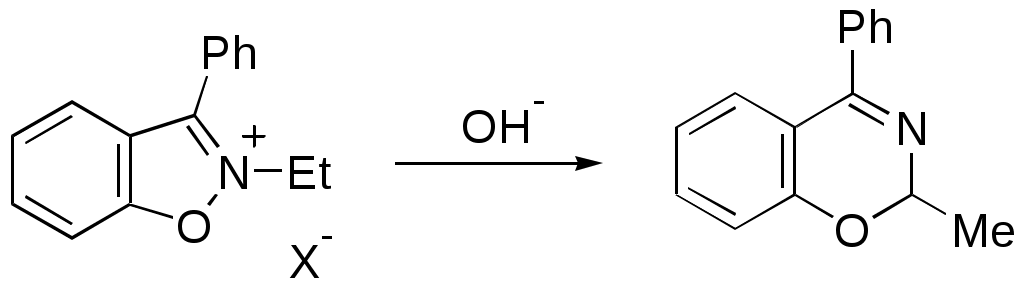 Расшифруйте вещество А и приведите механизмы реакций, ведущих к образованию 4,6,8-триметилазулена: 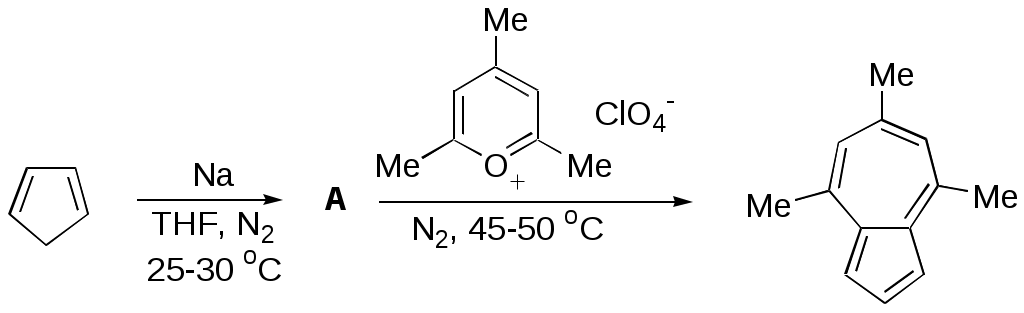 Задачи к главе “CH-Кислотность и реакции металлирования гетероароматических соединений” Объясните изменение СН-кислотности в следующих рядах гетероциклов (величины рКа измерены в системе циклогексиламид цезия – циклогекcиламин): 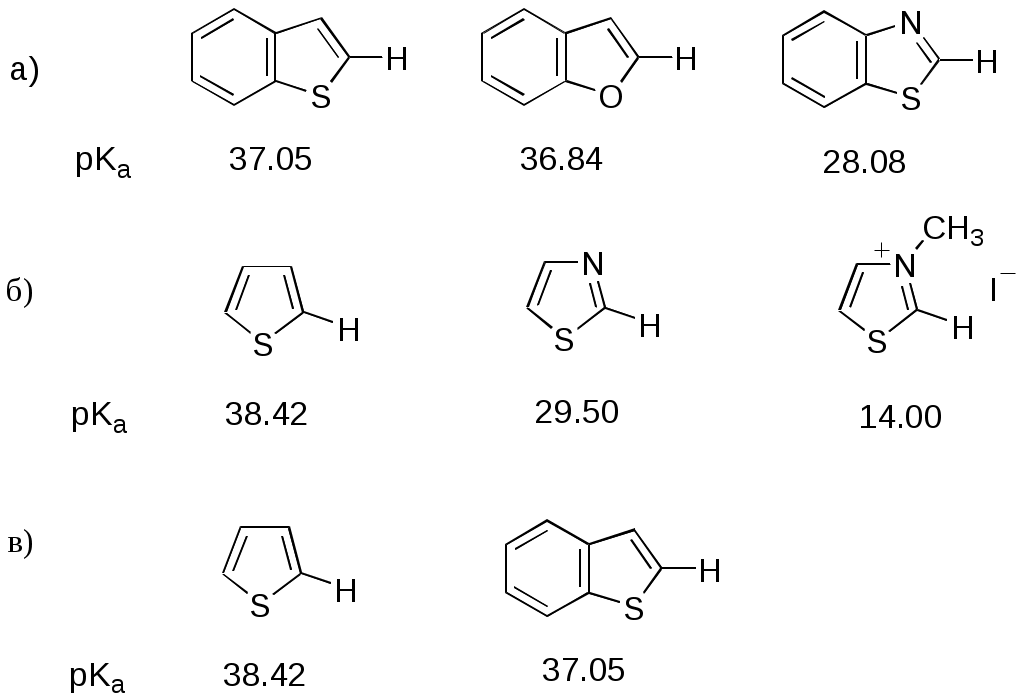 Расшифруйте продукты следующих реакций: 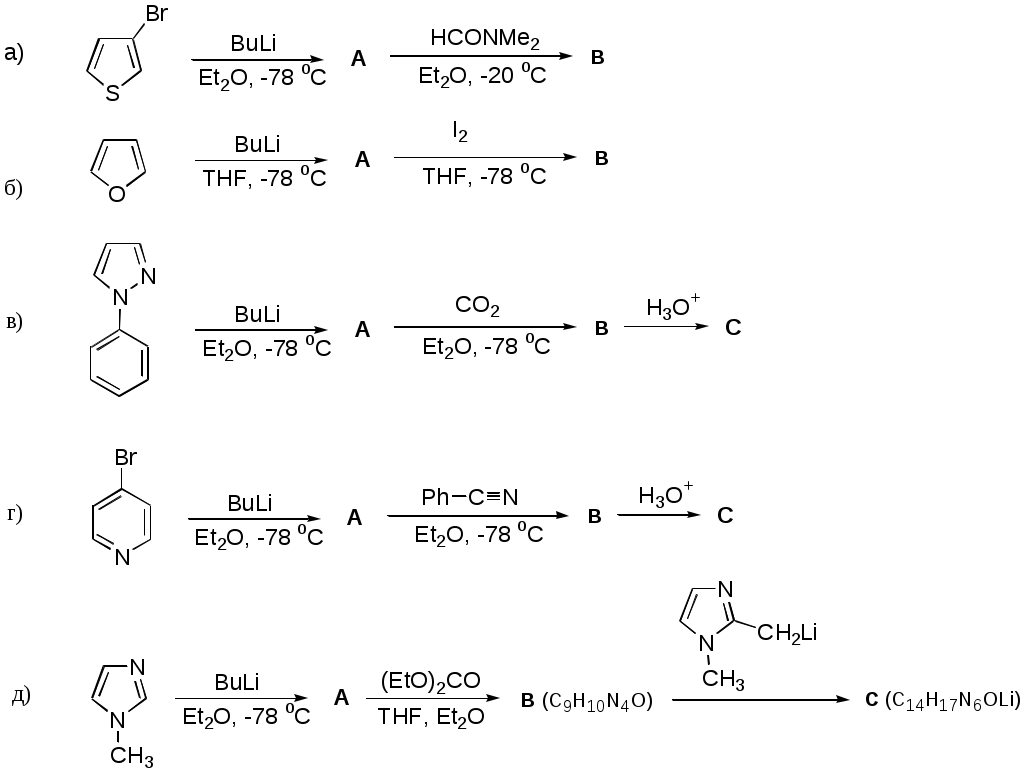 Как получить: а) 2-йодфуран из 2-бромфурана; б) пиридин-4-карбоновую кислоту из 4-бромпиридина ? При действии бутиллития на 2,4-диметилхинолин в смеси ТГФ - гексан при –78 оС в течение 1 часа образуется литийорганическое производное А. Через 2 ч в реакционной смеси наряду с соединением А можно обнаружить изомерный продукт В, а через 124 ч – только соединение В. Объясните наблюдаемые явления. 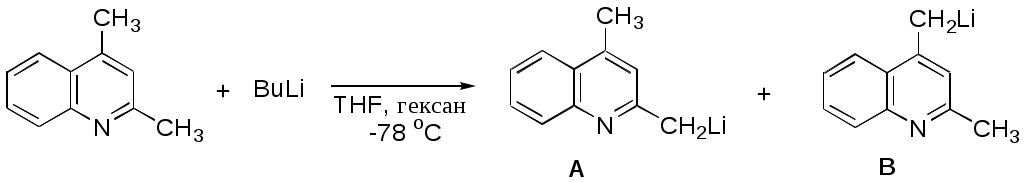 Расшифруйте продукты следующих превращений. Объясните направленность реакций. Ответ см. D. J. Brunelle // Tetrahedron Lett. 1981, 22 (38), 3699-3702. 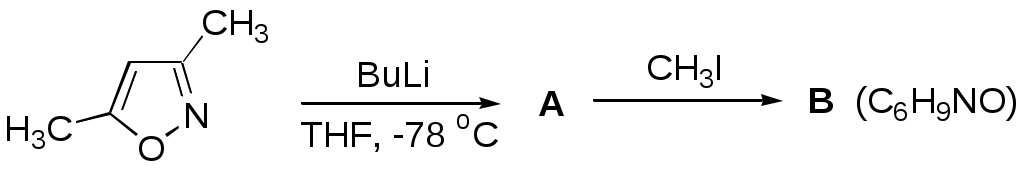 Расшифруйте продукты следующих превращений. Ответ см. R. Radinov, M. Haimova, E. Simova // Synthesis, 1986, (11), 886. 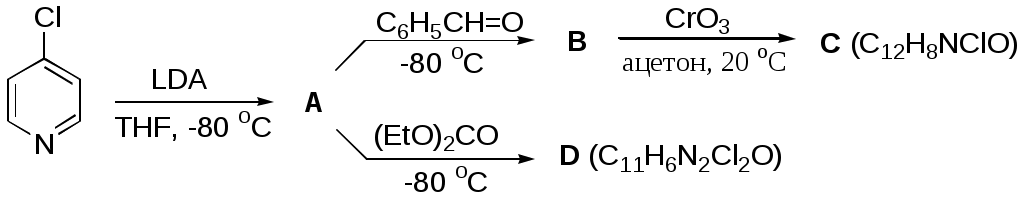 Задачи к главе “Синтез гетероциклических соединений” Какие исходные вещества необходимо взять для синтеза следующих соединений по Скраупу ? Составьте уравнение одной из этих реакций с учетом механизма. 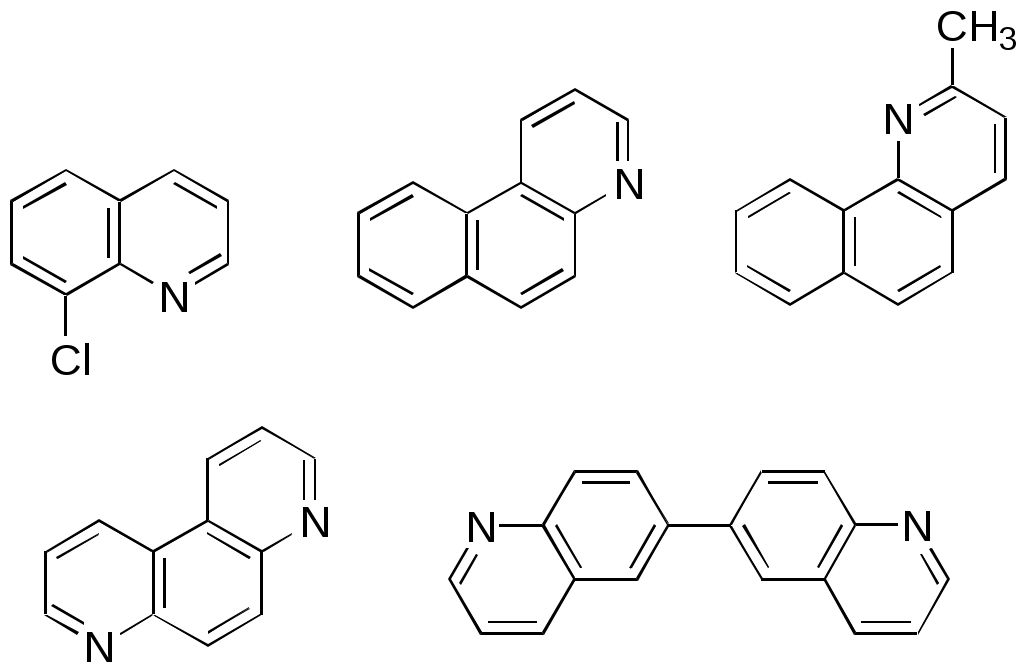 Напишите продукты взаимодействия фенилгидразина с: а) циклогексаноном; б) метилэтилкетоном в условиях реакции Фишера. Приведите возможные стадии конденсации уксусного ангидрида с салициловым альдегидом в присутствии ацетата натрия, приводящей к образованию кумарина.  Предложите способ синтеза: а) 3,6-дифенилпиридазина из 3,6-дифенил-1,2,4,5-тетразина; б) 3-метилпиридина из 1,2,4-триазина. Расшифруйте структуры продуктов следующего превращения: 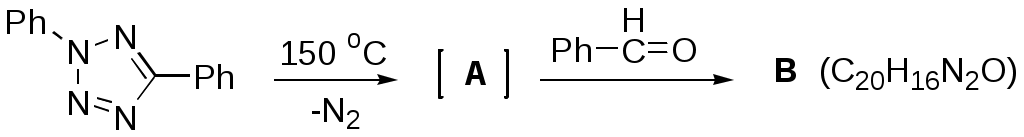 Пиррол А был получен в результате обработки оксима ацетофенона диметиловым эфиром ацетилендикарбоновой кислоты в присутствии метилата натрия с последующим нагреванием соединения до 170-180 оС. Используя в качестве аналогии механизм синтеза индола по Фишеру, предложите механизм этой реакции. 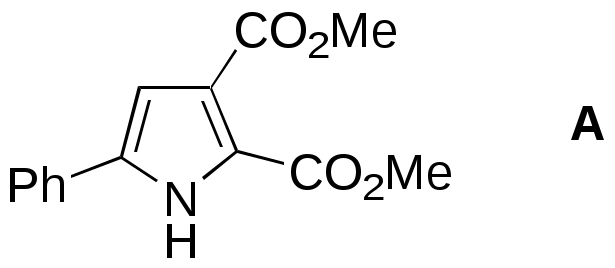 Расшифруйте схему синтеза индазола и рассмотрите механизмы реакций: 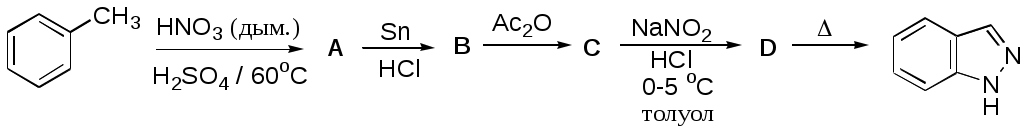 Рассмотрите механизмы реакций, ведущих к 3-фенилбензо[d]изоксазолу (3-фенилиндоксазену): 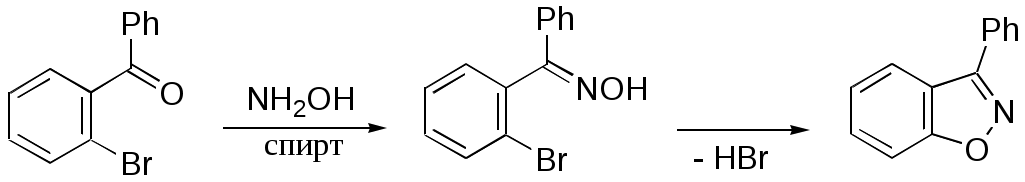 Если к смеси анизола и уксусного ангидрида по каплям прибавлять 72%-ную хлорную кислоту, то через несколько часов начинают выпадать кристаллы перхлората 2-метил-4,6-ди(п-анизил)пирилия. Рассмотрите механизм этой реакции. Задачи к нескольким главам Сравните химические свойства имидазола и пиррола (основность, кислотность, способность к замещению, окислению и восстановлению). Предскажите химические свойства пиридазина (1,2-диазина). Предложите метод синтеза никотиновой кислоты (пиридин-3-карбоновой), исходя из пиридина. Как получить 2-метилфуран исходя из фурана ? Предложите 2-3 способа синтеза пиразинона исходя из пиразина. Предложите по 2 способа синтеза: а) 2-нитропиридина из пиридина; б) 2-хлорпиридина из пиридина. Составьте уравнения реакций индазола со следующими реагентами: а) ацетилхлоридом в бензоле; б) йодистым метилом в среде КОН – этанол; в) бромом в хлороформе; г) нитрующей смесью. Составьте уравнения реакций: а) 4-трет-бутилбензимидазола с йодистым метилом в среде КОН-спирт; б) 2,5-диметилпиррола с бромом в хлороформе; в) 1-метил-3-йодиндазола с бутиллитием в эфире; г) пиридина и диизопропиламида лития в эфире, с последующей обработкой реакционной смеси йодом. Расшифруйте продукты следующих превращений: 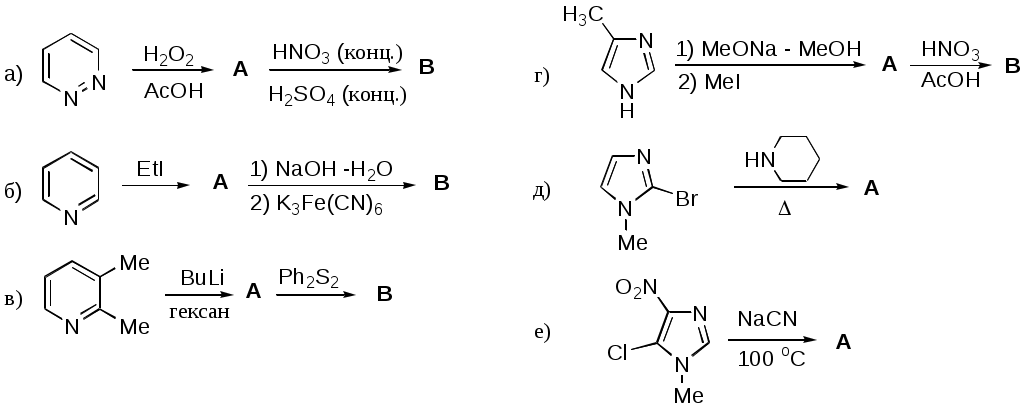 Объясните повышенную устойчивость солей диазония, образующихся при диазотировании 2- и 4-аминопиридин-N-оксидов. Расшифруйте продукты и рассмотрите механизмы реакций, ведущих к образованию N-оксида 4-хлорпиридина: 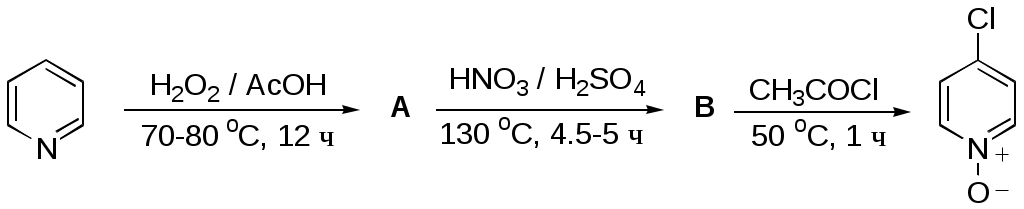 Задачи повышенной сложности Оптически активный индол А реагирует с натриевой солью диэтилмалоната в толуоле с образованием соединения В, которое представляет собой рацемат. Предложите механизм реакции, протекающей с потерей оптической активности. 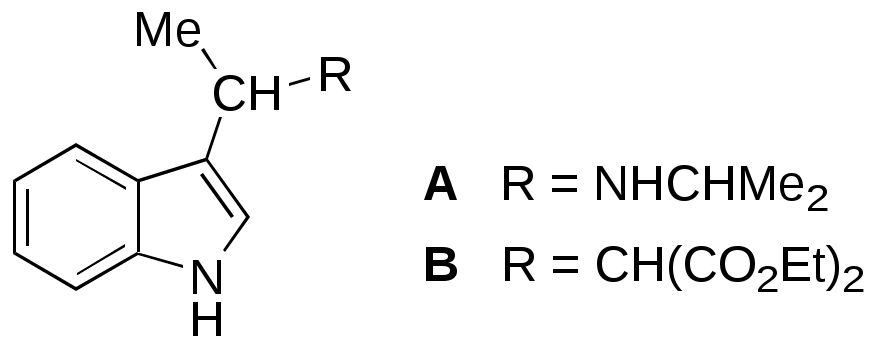 Как превратить нитросоединение А в гетероциклические продукты В и С ? 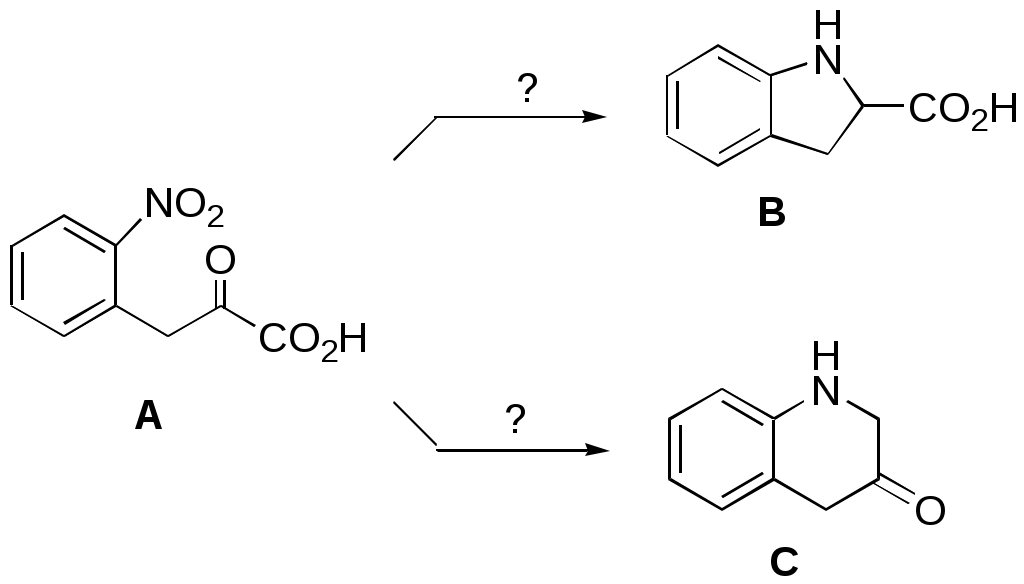 Объясните, почему 1-метил-2-трифторметилимидазол, в отличие от 2-трифторметилимидазола не вступает в следующую реакцию: 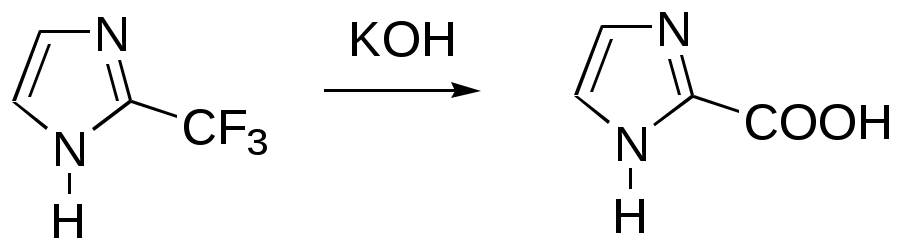 Расшифруйте и назовите продукты следующих превращений: 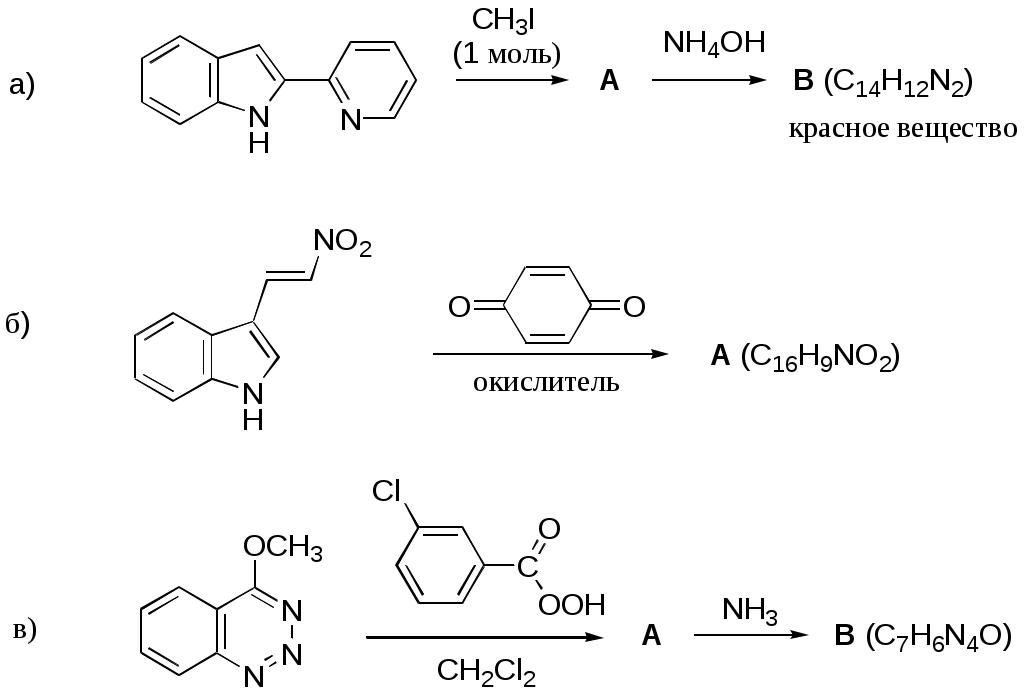 Соль пирилия А при действии триэтиламина превращается в красное кристаллическое соединение состава С15Н17О3 СlO4¯. Предложите структуру этого соединения и механизм его образования. 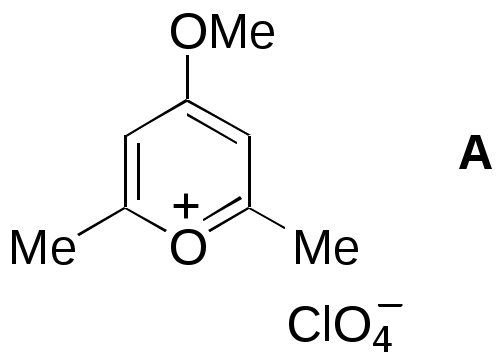 Предложите механизмы следующих превращений: 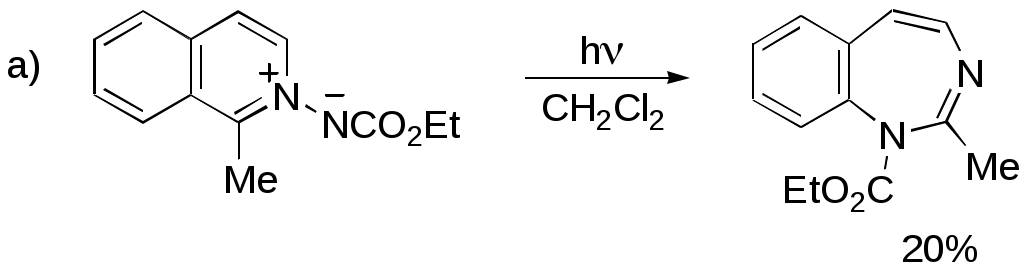 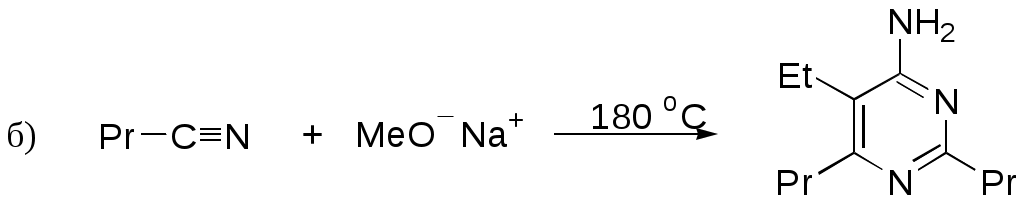 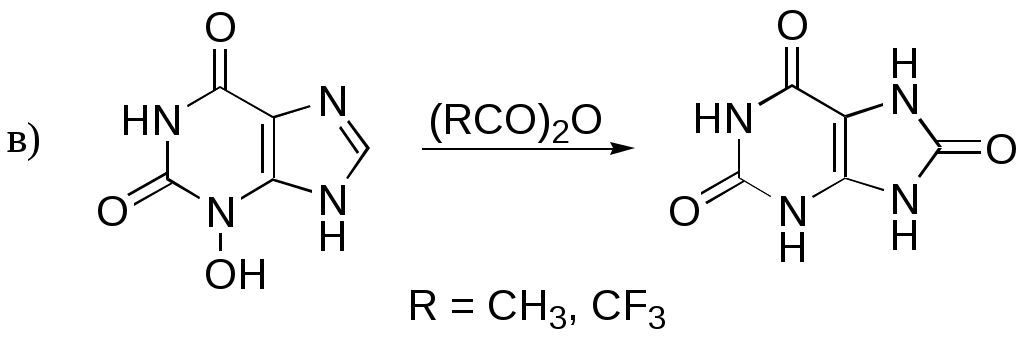 1-Нитро-9-алкиламиноакридины существуют преимущественно в иминоформе, в случае же их изомеров с нитрогруппой в положении 2 реализуется аминоформа. Почему ? Закончите уравнение следующей реакции: 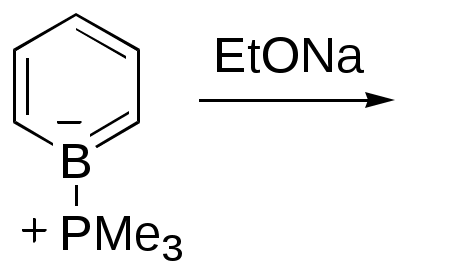 Расшифруйте соединение А, опираясь на его спектральные данные: ИК (КBr) 2996, 2924, 2213 см-1; 1Н ЯМР (CDCl3) 2.79 (3Н, с), 7.41 (1Н, дд), 8.03 (1Н, дд), 8.54 м.д. (1Н, дд); m/z (I %) 206 M+ (100), 191 (47). 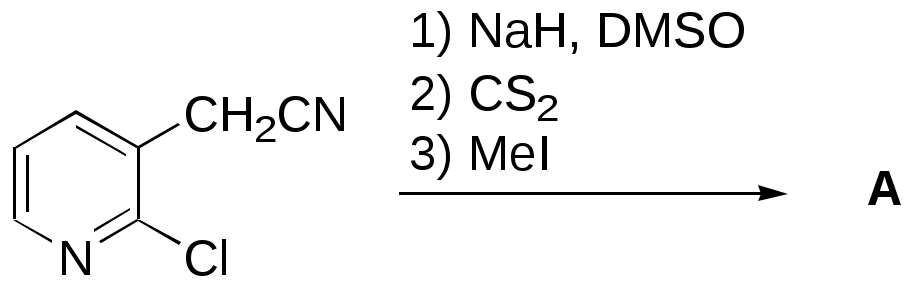 Расшифруйте продукт превращения, опираясь на его спектральные данные: ИК (КBr) 3066, 1734, 1583, 1487 см-1; 1Н ЯМР (CDCl3) 3.29 (2Н, т, J = 5 Гц), 4.13 (3Н, с), 4.66 м.д. (2Н, т, J = 5 Гц), 8.18 (1Н, с); m/z (I %) 208 M+ (5), 178 (7), 150 (100), 106 (26), 79 (36). 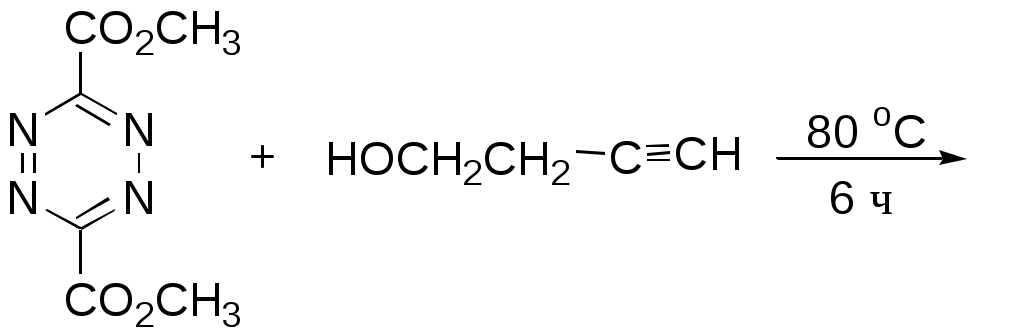 Объясните различную направленность вхождения меченого азота в двух следующих реакциях: 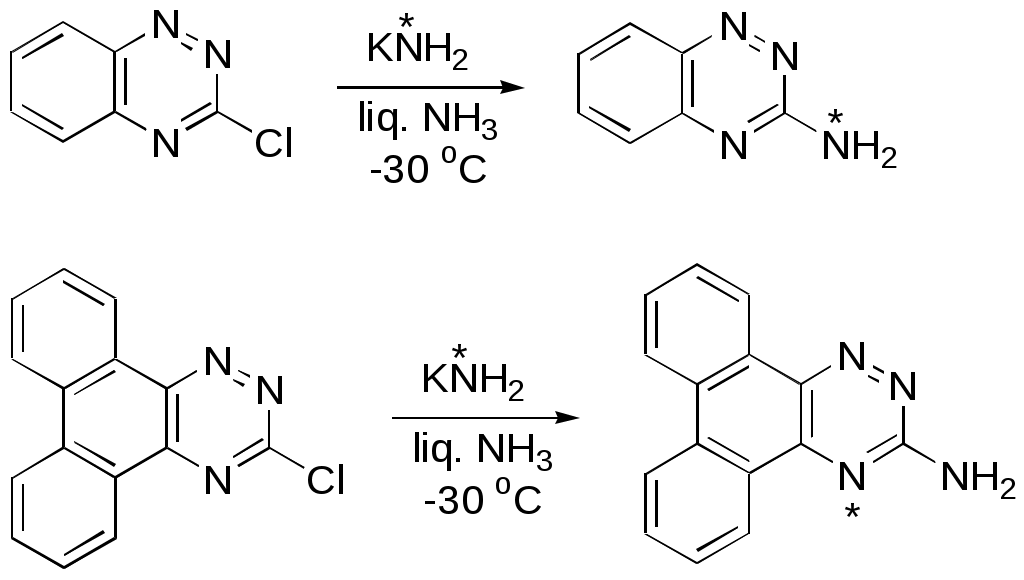 При нагревании соли триазолия А с этилатом натрия получается два продукта В и С. Расшифруйте их строение, если известно, что оба они имеют одну и туже брутто-формулу. По данным ИК спектроскопии в продукте С есть группа NH, а в В нет адсорбции выше 3100 см-1. Данные 13С ЯМР (без химсдвигов углеродов фенильных групп) для соединения В: 61, 145, 160 м.д.; для соединения С: 122,125, 132 м.д. 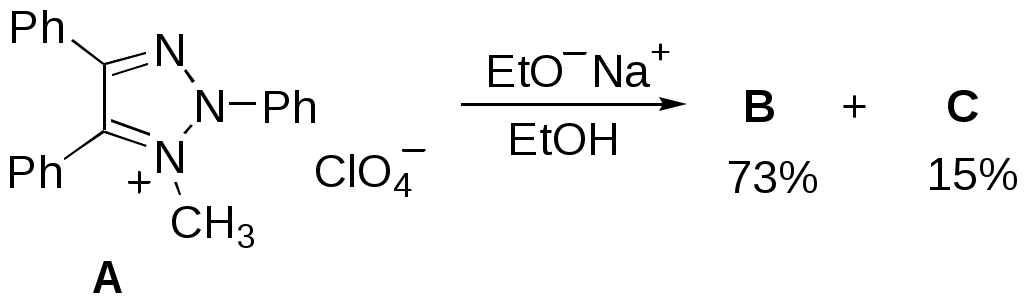 Одним из удивительных свойств азотистых гетероциклов является уменьшение растворимости в воде при переходе к их гидроксипроизводным. Это полностью противоположно тому, что наблюдается в алифатическом ряду. Так, растворимость в воде при 20 оС пурина и его 2-, 6- и 8-гидроксипроизводных, а также 2,6-дигидроксипурина (ксантина) и 2,6,8-тригидроксипурина (мочевой кислоты) равны соответственно: 2, 380, 1400, 240, 2000 и 39500 (приведено число весовых частей воды, растворяющих одну весовую часть вещества). Для сравнения интересно указать, что растворимость в воде кофеина (1,3,7-триметилксантина) равна 70. Выскажите суждение о причинах этого явления. Расшифруйте продукты следующих превращений. К какому типу относятся приведенные реакции ? 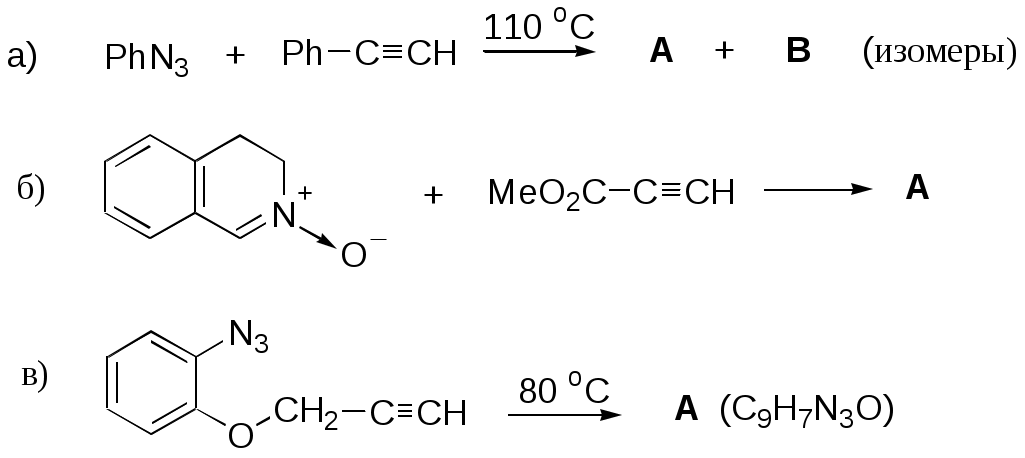 Расшифруйте и назовите продукт следующего превращения:  Клавулановая кислота А при нагревании в метаноле превращается в пиррол В. Предложите механизм этого превращения. 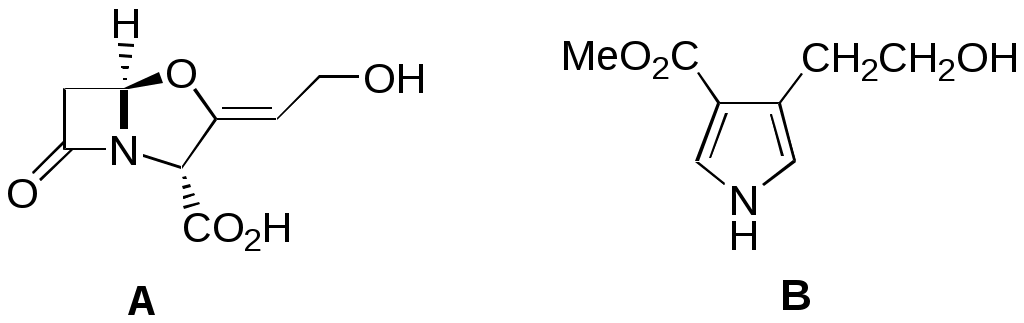 Оксазолон А – бесцветное кристаллическое вещество, дающее желтые растворы. Коэффициент экстинкции полосы, обуславливающей цвет очень зависит от растворителя: в CHCl3 max 436 нм ( 1.4), в ДМСО max 434 нм ( 9600). В ИК спектре вещества А в хлороформе имеется полоса поглощения карбонила при 1820 см-1, а в растворе ДМСО присутствуют две полосы поглощения при 1820 и 1704 см-1. Объясните наблюдаемые явления. 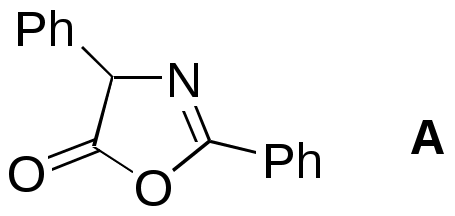 1,4-Динитропиразол А реагирует с диэтиламином, давая продукт замещения В. В тех же условиях 1,3-динитропиразол превращается исключительно в 3-нитропиразол. Предложите механизмы обеих реакций и объясните различие в поведении изомерных динитропиразолов. Ответ см. C.L. Habraken, E.K. Poels // J. Org. Chem. 1977, 42 (17), 2893-2895. 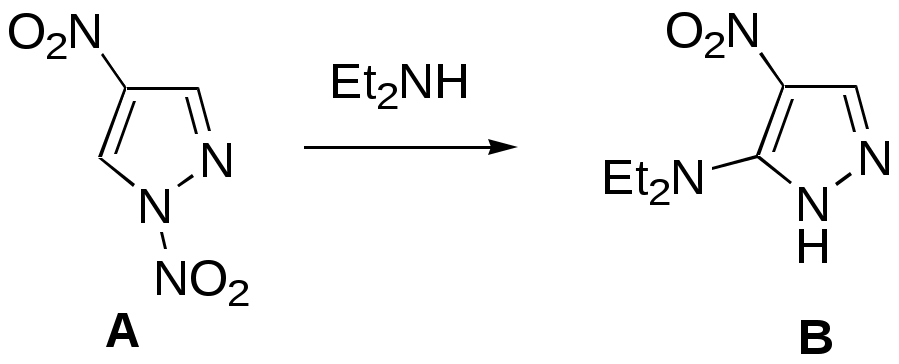 Предложите механизм образования каждого из продуктов реакции хлорпиразина с амидом калия в жидком аммиаке. Ответ см. P.J. Lont, H.C. van der Plas // Rec. trav. chim. 1973, 92 (1), 311-316. 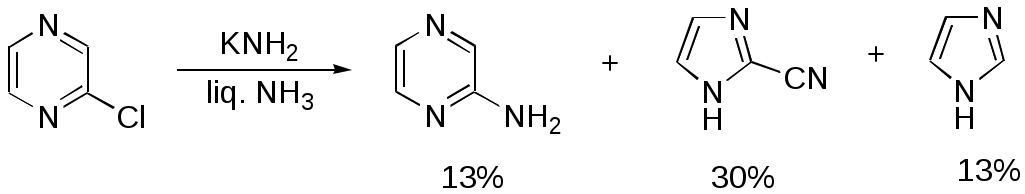 Предложите механизм следующей реакции. Ответ см. H. Zimmer, A. Amer, D. Ho, K. Koch, C. Schumacher, R. C. Wingfield // J. Org. Chem. 1990, 55 (17), 4988-4989. 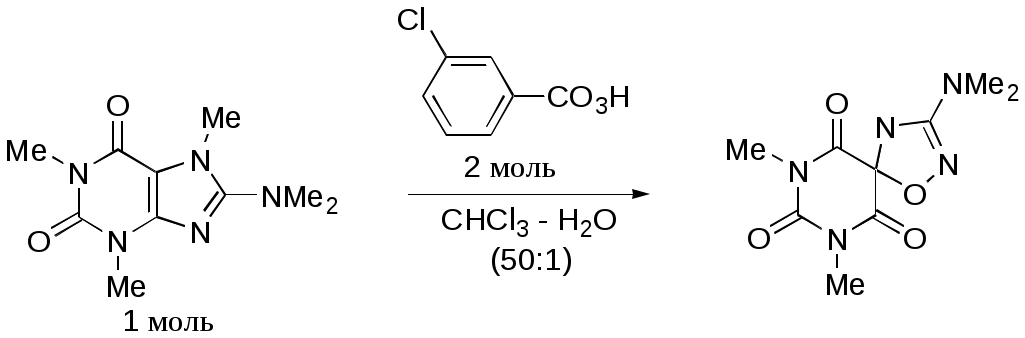 Расшифруйте продукты превращения. К какому типу оно относится ? Ответ см. U. Hees, J. Schneider, O. Wagner, M. Regitz // Synthesis, 1990, (9), 834-840. 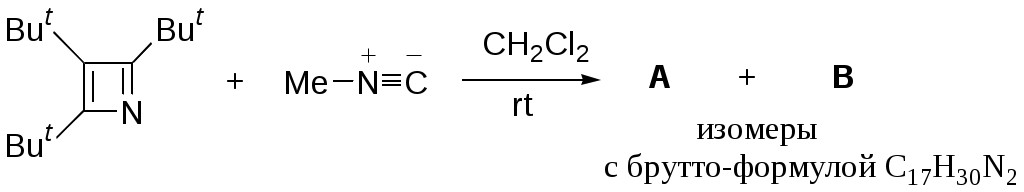 Расшифруйте продукты следующих превращений. Ответ см. D.L. Comins, M.O. Killpack // J. Org. Chem. 1987, 52 (1), 104-109. 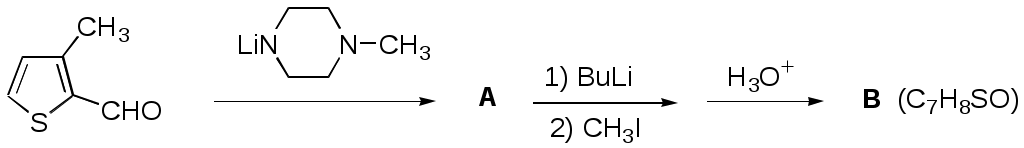 | ||||||||||||||||||||||||