Контрольная работа по химии. Задача 14 4 2 Задача 34 6 3 Задача 94 9 4 Задача 114 11
 Скачать 167.29 Kb. Скачать 167.29 Kb.
|
1 2 1.2 Задача 34. Какую высшую и низшую степень окисления проявляют сурьма, теллур, йод. Ответ мотивируйте строением атомов этих элементов. Какой из данных элементов проявляет наибольшую окислительную активность? Почему? Составьте формулы газообразных соединений с водородом и формулы оксидов этих элементов, отвечающих их высшей степени окисления. Степень окисления атома элемента в соединении определяется числом смещенных электронов к другим атомам (положительная степень окисления) или от других атомов (отрицательная степень окисления). Высшая степень окисления в большинстве случаев соответствует номеру группы периодической системы Д.И.Менделеева, в которой находится элемент. Sb, Te, I – элементы 5 периода, V, VI, VII групп. Электронные формулы атомов сурьмы, теллура йода: 51Sb 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p3 52Te 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p4 53I 1s22s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5 Sb, Te, I – p – элементы, на внешнем энергетическом уровне содержат соответственно 5,6,7 электронов, следовательно – неметаллы (у атомов неметаллов на внешнем слое 4-7 электронов). Атомы неметаллов могут и отдавать, и принимать электроны, проявляя и положительные, и отрицательные степени окисления. Высшая положительная степень окисления определяется номером группы и соответствует отдаче всех валентных электронов с внешнего слоя: 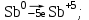 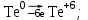 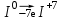 Низшая (отрицательная) степень окисления неметаллов соответствует числу электронов, которые атому необходимо присоединить для образования устойчивой восьмиэлектронной оболочки (ns2np6) и имеет отрицательное значение. Атомам Sb, Te, I для образования устойчивой восьмиэлектронной оболочки инертного газа необходимо принять соответственно 3, 2 и 1 электрон. Следовательно, их низшая (отрицательная) степень окисления будет равна: 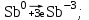 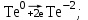 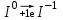 Сурьма -3 и +5 (H₃Sb-3 - стибин (сурьмянистый водород) и 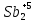 O5 - оксид сурьмы(V)) O5 - оксид сурьмы(V)) Теллур -2 и +6 (H2Te-2 - теллуроводород (теллуран) и Te+6O3 – триоксид теллура) Йод -1 и +7 (HI-1 - йодистый вдород и HI+7O4 – йодная кислота) Оформим результаты решения в виде таблицы 1. Таблица 1 – Степени окисления сурьмы, теллура, йода и молекулярные формулы соответствующих соединений
Мерой окислительной активности элементов являются энергия сродства к электрону - энергия, которая выделяется при присоединении электрона к нейтральному атому, и электроотрицательность – способность атома данного элемента к оттягиванию на себя электронной плотности. Sb, Te, I – элементы одного периода. С увеличением заряда ядер их атомов (от сурьмы Sb к йоду I) растет число электронов на внешнем энергетическом уровне и усиливается притяжение электронов к ядру, что ведет к уменьшению радиуса атомов, к увеличению энергии ионизации, сродства к электрону и электроотрицательности. Следовательно, от сурьмы к йоду увеличивается окислительная активность и усиливаются неметаллические свойства. 1.3 Задача 94. Уменьшится или увеличится энтропия при переходе: а) воды в пар; б) графита в алмаз? Почему? Вычислите изменение энтропии для каждого превращения. Сделайте вывод о количественном изменении энтропии при фазовых и аллотропических превращениях. Энтропия (S) – функция состояния системы, характеризует меру неупорядоченности системы. Она возрастает при нагревании, испарении, плавлении, при переходе от кристаллического к жидкому и газообразному состоянию, а также с усложнением структуры молекул. Энтропия уменьшается в процессах, в результате которых упорядоченность системы возрастает – при охлаждении, конденсации, кристаллизации, уменьшении числа частиц. При протекании химической реакции энтропия системы увеличивается, если объем газообразных продуктов реакции больше, чем исходных веществ, и уменьшается, если он меньше. Изменение энтропии системы в результате химической реакции равно сумме стандартных энтропий продуктов реакции за вычетом суммы стандартных энтропий исходных веществ с учетом стехиометрических коэффициентов (числа молей участвующих в реакции веществ): 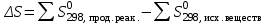 (1.1) (1.1)Значения стандартных энтропий веществ, участвующих в химической реакции (табл. 2): Таблица 2 – Стандартные энтропии S  некоторых веществ. некоторых веществ.
Рассчитаем изменения энтропии при протекании реакции: 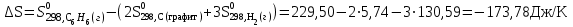 Так как S < 0, энтропия уменьшается. Это происходит вследствие уменьшения объема системы за счет уменьшения числа молекул газообразных веществ. При переходе воды в пар энтропия системы увеличивается. В 1911 г. Макс Планк предложил следующий постулат: энтропия правильно сформированного кристалла чистого вещества при абсолютном нуле равна нулю. Этот постулат может быть объяснен статистической термодинамикой, согласно которой энтропия есть мера беспорядочности системы на микроуровне: 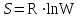 , (1.2) , (1.2)где W – число различных состояний системы, доступное ей при данных условиях, или термодинамическая вероятность макросостояния системы; R = 1,38,10-16 эрг/град - постоянная Больцмана. Очевидно, что энтропия газа существенно превышает энтропию жидкости. Это подтверждают расчеты: H2O(ж) < H2O(г) ∆S°проц. = 188,72 - 69,94 = 118,78 Дж/мольК При переходе графита в алмаз энтропия системы уменьшается, т.к. число различных состояний системы уменьшается. Это подтверждают расчеты: Cграф. > Cалм. ∆S°проц. = 2,44 - 5,74 = -3,30 Дж/мольК Вывод о количественном изменении энтропии при фазовых и аллотропических превращениях: так как энтропия характеризует неупорядоченность системы, то при аллотропных превращениях, если система становится более упорядоченной (в данном случае алмаз тверже и прочнее графита), то энтропия системы уменьшается. При фазовых превращениях: при переходе вещества из твердой, жидкой фазы в газообразную система становится менее упорядоченной и энтропия увеличивается и наоборот. 1.4 Задача 114. Напишите выражения констант равновесия для систем: а) SО2(г) + 2Н2 (г) S(ромб) +2Н2О (г) б) СО2(г) + 4Н2(г) СН4(г) + 2Н2О(г) Как изменится скорость прямой реакции, если а) в каждой системе уменьшить концентрацию водорода в 3 раза; б) понизить давление в системе в 2 раза? В каком направлении при этом сместится равновесие? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции. Состояние химического равновесия характеризуется константой химического равновесия Кс, которая равна отношению произведению равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции. В случае гомогенной системы в выражении константы равновесия входят равновесные концентрации всех компонентов. В случае гетерогенной системы, компонентами которой являются газообразные и твердые вещества или газообразные и жидкие индивидуальные вещества, в выражение константы равновесия входят концентрации только газообразных веществ. Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, в степенях равных стехиометрическим коэффициентам в уравнении реакции. Система SО2(г) + 2Н2 (г) S(ромб) +2Н2О (г) – гетерогенная, равновесие устанавливается на границе раздела твердое вещество – газ. Концентрации твердых и жидких индивидуальных веществ постоянные и в выражение константы равновесия не входят. Константа химического равновесия: 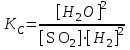 (1.3) (1.3)Концентрации веществ, образующих твердую или жидкую фазу, остаются постоянными и не влияют на скорость реакции. Поэтому в выражение скорости реакции включаются только концентрации газообразных компонентов. Запишем выражение скорости прямой реакции: 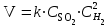 , (1.4) , (1.4)где V – скорость реакции, k – константа скорости реакции, 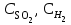 – концентрации реагирующих веществ, 2 – стехиометрический коэффициент в уравнении реакции. – концентрации реагирующих веществ, 2 – стехиометрический коэффициент в уравнении реакции.Система СО2(г) + 4Н2(г) СН4(г) + 2Н2О(г) – гомогенная, состоит только из газообразных веществ. Константа химического равновесия: 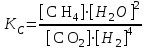 Реагирующие вещества находятся в одной фазе – газообразной. Запишем выражение скорости прямой реакции: 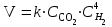 , ,где V – скорость реакции, k – константа скорости реакции, 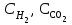 – концентрации реагирующих веществ, 4 – стехиометрический коэффициент в уравнении реакции. – концентрации реагирующих веществ, 4 – стехиометрический коэффициент в уравнении реакции.Для 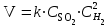 уменьшения давления в системе в 2 раза вызовет увеличение объема системы в 2 раза, а концентрации газообразного водорода и оксида серы уменьшатся в 2 раза, ( уменьшения давления в системе в 2 раза вызовет увеличение объема системы в 2 раза, а концентрации газообразного водорода и оксида серы уменьшатся в 2 раза, (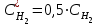 , ,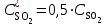 ), и скорость реакции будет равна: ), и скорость реакции будет равна: 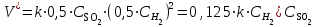 . Следовательно, после понижения давления в 2 раза скорость реакции уменьшится в 8 раз. . Следовательно, после понижения давления в 2 раза скорость реакции уменьшится в 8 раз.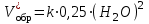 . Скорость обратной реакции уменьшится в 4 раза. . Скорость обратной реакции уменьшится в 4 раза.Скорость прямой реакции уменьшилась в 8 раз, а скорость обратной реакции уменьшилась в 4 раза, следовательно, равновесие сместится в сторону обратной реакции. Для 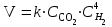 уменьшения давления в системе в 2 раза вызовет увеличение объема системы в 2 раза, а концентрации газообразного водорода и углекислого газа уменьшатся в 2 раза, ( уменьшения давления в системе в 2 раза вызовет увеличение объема системы в 2 раза, а концентрации газообразного водорода и углекислого газа уменьшатся в 2 раза, (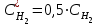 , ,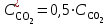 ), и скорость реакции будет равна: ), и скорость реакции будет равна: 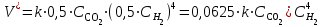 . Следовательно, после понижения давления в 2 раза скорость реакции уменьшится в 16 раз. . Следовательно, после понижения давления в 2 раза скорость реакции уменьшится в 16 раз.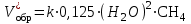 . Скорость обратной реакции уменьшится в 8 раз. . Скорость обратной реакции уменьшится в 8 раз.Скорость прямой реакции уменьшилась в 16 раз, а скорость обратной реакции уменьшилась в 8 раз, следовательно, равновесие сместится в сторону обратной реакции. Если уменьшить концентрацию водорода в 3 раза, то для 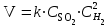 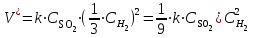 . То есть, скорость реакции уменьшится в 9 раз. . То есть, скорость реакции уменьшится в 9 раз.Для 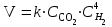 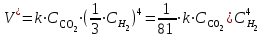 . Скорость реакции уменьшится в 81 раз. . Скорость реакции уменьшится в 81 раз.Влияние концентрации на состояние равновесия ограничено содержанием в системе только тех веществ, концентрации которых входят в выражение константы равновесия. При увеличении концентрации одного из газообразных веществ (реагента или продукта), находящегося в равновесной системе, равновесие смещается в сторону расхода данного вещества. При уменьшении концентрации вещества равновесие смещается в сторону образования этого вещества. В для обеих систем уменьшение концентрации исходного вещества H2, смещает равновесие в сторону образования реагента. 1.5 Задача 134. На нейтрализацию 1 л раствора, содержащего 1,4 г гидроксида калия, требуется 50 мл раствора кислоты. Вычислите молярную концентрацию эквивалентов кислоты. Согласно закону эквивалентов вещества взаимодействуют между собой в эквивалентных количествах, следовательно, 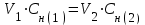 или или 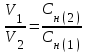 (1.5) (1.5)Таким образом, объемы растворов реагирующих веществ обратно пропорциональны их молярным концентрациям эквивалентов. Число молей эквивалентов гидроксида калия, содержащихся в 1 л раствора, равно 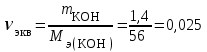 молей эквивалентов, где 56 г/моль – молярная масса эквивалента гидроксида калия. молей эквивалентов, где 56 г/моль – молярная масса эквивалента гидроксида калия.Следовательно, молярная концентрация эквивалентов гидроксида калия Сн(КOH) = 0,025 моль/л. На основании зависимости между объемами растворов реагирующих веществ и их молярными концентрациями эквивалентов рассчитываем молярную концентрацию эквивалентов кислоты: 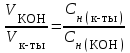 ; отсюда ; отсюда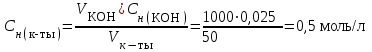 (0,5 н.) (0,5 н.)1.6 Задача 154. Сколько граммов мочевины (NH2)2CO следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,4650С? Криоскопическая константа воды 1,86. Исследование свойств разбавленных растворов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном объеме данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля. В общем виде зависимость повышения температуры кипения tкип. и понижения температуры замерзания tзам. разбавленных растворов от концентрации можно записать так: tкип = КэСm и tзам = КкСm , (1.6) где Кэ и Кк – эбулиоскопическая и криоскопическая постоянные растворителя (С кг моль1 или К кг моль1). Сm – моляльность вещества в растворе (моль/кг) В этих уравнениях моляльную концентрацию можно заменить отношением массы растворенного вещества в 1000 г растворителя (m) к молярной массе этого вещества (М). Тогда 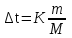 . .По закону Рауля: 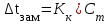 , ,где, 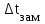 – понижение температуры; – понижение температуры;Кк – криоскопическая константа растворителя, равная 1,86; Сm – моляльность вещества в растворе; 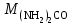 – молярная масса мочевины, равная 60г/моль. – молярная масса мочевины, равная 60г/моль.Сm = 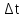 / Кк = 0.465 / 1.86 = 0.25 моль/кг / Кк = 0.465 / 1.86 = 0.25 моль/кгНа 1000 грамм растворителя приходится 0,25 моль вещества. На 75 грамм растворителя приходится Х моль вещества. 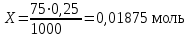 Соответсвенно масса мочевины равна 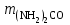 = 60г/моль0,01875 моль = 1,125 г. = 60г/моль0,01875 моль = 1,125 г.1.7 Задача 174. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Fe(OH)3 + 3H+ = Fe3+ + 3H2O б) Cо2+ + 2OH- = Cо(OH)2 в) H+ + NO2- = HNO2 а) Fe(OH)3 + 3H+ = Fe3+ + 3H2O Fe(OH)3 + 3HCl = FeCl3 + 3H2O Fe(OH)3 + 3НNO3 = FeNO3 + 3H2O б)Cd2+ +2OH- = Cd(OH)2 CdCl2 + 2NaOH = Cd(OH)2 + 2NaCl в)H+ + NO2- = HNO2 2NO2+ H2O = HNO3 + HNO2 1.8 Задача 194. Напишите выражение произведения растворимости для сульфита кальция. Рассчитайте растворимость CaSO3 в воде и в 0,2 М растворе Na2SO3, если 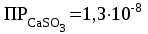 . .В насыщенном растворе малорастворимого электролита произведение концентраций (активностей) ионов в степени их стехиометрических коэффициентов является при данной температуре величиной постоянной. Эту величину называют произведением растворимости электролита и обозначают ПР: ПР =nmm–n. (1.7) Исходя из значений ПР, можно рассчитать растворимость труднорастворимых веществ в воде и в растворах, содержащих другие электролиты. Растворимостью вещества называется концентрация вещества в определенном объеме его насыщенного раствора. Различают молярную растворимость в моль/л (S) и растворимость в г/л (P), которые связаны между собой следующей зависимостью: P = S M, (1.8) где M-молярная масса труднорастворимого вещества. Рассчитаем растворимость СаSО3 в воде: CaSO3 Ca2+ + SO32- в осадке в растворе 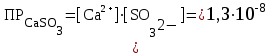 Обозначим растворимость СаSО3 равной S моль/л, тогда согласно уравнению диссоциации сульфита кальция в насыщенном растворе концентрация каждого из его ионов равна S моль/л. 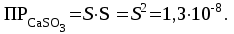 Следовательно, растворимость СаSО3 в воде будет равна: Следовательно, растворимость СаSО3 в воде будет равна:S = 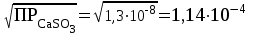 моль/л. моль/л. Найдем растворимость СаSО3 в 0,2 М растворе Na2SO3. При введении сильного электролита, диссоциирующего по уравнению: Na2SO3 2Na+ + SО32-, концентрация сульфит - ионов SО32- повышается на 0,2 моль и становится равной (S + 0,2) моль/л, а концентрация катионов натрия остаётся равной S моль/л, тогда: 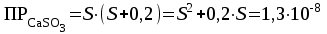 . .Так как значение S2 много меньше произведения 0,1 S, то величиной S2 можно пренебречь и тогда: 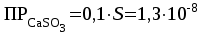 . .Отсюда, растворимость СаSО3 в 0,2 М растворе Na2SO3 будет равна: 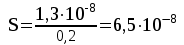 моль/л. моль/л.1.9 Задача 214. Какие из солей NaJ, CrCl3, K2SiO3, (NH4)2SO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Укажите значения рН (>7<) растворов этих солей. Гидролизу в водных растворах подвергаются соли, содержащие катионы слабых оснований и анионы слабых кислот. Соли, содержащие катионы сильных оснований и анионы сильных кислот в водных растворах практически не гидролизуются, так как в системе имеется лишь один слабый электролит Н2О, поэтому отсутствует возможность связывания ионов Н+ и ОН воды ионами соли. Гидролиз хлорида хрома (III) – CrCl3 CrCl3 – соль слабого основания и сильной кислоты, поэтому гидролиз протекает по катиону. Первая стадия гидролиза Молекулярное уравнение: CrCl3 + HOH ⇄ CrOHCl2 + HCl Полное ионное уравнение: Cr3+ + 3Cl- + HOH ⇄ CrOH2+ + 2Cl- + H+ + Cl- Краткое ионное уравнение: Cr3+ + HOH ⇄ CrOH2+ + H+ Вторая стадия гидролиза Молекулярное уравнение: CrOHCl2 + H2O ⇄ Cr(OH)2Cl + HCl Полное ионное уравнение: CrOH2+ + 2Cl- + H2O ⇄ Cr(OH)2+ + Cl- + H+ + Cl- Краткое ионное уравнение: CrOH2+ + H2O ⇄ Cr(OH)2+ + H+ Третья стадия гидролиза Молекулярное уравнение: Cr(OH)2Cl + H2O ⇄ Cr(OH)3 + HCl Полное ионное уравнение: Cr(OH)2+ + Cl- + H2O ⇄ Cr(OH)3 + H+ + Cl- Краткое ионное уравнение: Cr(OH)2+ + H2O ⇄ Cr(OH)3 + H+ Т.к. в результате гидролиза образовались ионы водорода (H+), то раствор будет имееть кислую среду (pH < 7). K2SiO3 – соль сильного основания и слабой кислоты, поэтому гидролиз протекает по аниону. Первая стадия гидролиза Молекулярное уравнение: K2SiO3 + HOH ⇄ KHSiO3 + KOH Полное ионное уравнение: 2K+ + SiO32- + HOH ⇄ K+ + HSiO3- + K+ + OH- Краткое ионное уравнение: SiO32- + HOH ⇄ HSiO3- + OH- Вторая стадия гидролиза Молекулярное уравнение: KHSiO3 + H2O ⇄ H2SiO3 + KOH Полное ионное уравнение: K+ + HSiO3- + H2O ⇄ H2SiO3 + K+ + OH- Краткое ионное уравнение: HSiO3- + H2O ⇄ H2SiO3 + OH- Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор имеет щелочную среду (pH > 7). (NH4)2SO3 – соль слабого основания и слабой кислоты, гидролиз протекает практически полностью, т.к. оба продукта реакции уходят из зоны реакции в виде осадка или газа. Молекулярное уравнение: (NH4)2SO3 + H2O → 2NH4OH + SO2↑ Раствор имеет нейтральную среду. NaJ не гидролизуется, так как является солью сильного основания и сильной кислоты. 1.10 Задача 234. Какие из приведенных реакций относятся к реакциям обмена и к окислительно-восстановительным реакциям? Для реакций обмена расставьте коэффициенты методом подбора, и напишите полное и сокращенное ионно-молекулярное уравнения. Для окислительно-восстановительных реакций, используя метод электронного баланса, составьте электронные уравнения, укажите процессы окисления, восстановления, восстановитель, окислитель. PbO2 + MnSO4 + HNO3 HMnO4 + PbSO4 + Pb(NO3)2 Ca3(PO4)2 + H2SO4 CaSO4 + H3PO4 AuCl3 + H2O2 + NaOH Au + O2 + NaCl + H2O 5PbO2 + 2MnSO4 + 6HNO3 2HMnO4 + 2PbSO4 + 3Pb(NO3)2 + 2H2O Это окислительно-восстановительная реакция: Mn2+ -5ē Mn7+ |2|(окисление|восстановитель) Pb4+ +2ē Pb2+ |5|(восставновление|окислитель) Ca3(PО4)2 + 3H2SО4 = 3CaSO4↓ + 2H3PO4 При взаимодействии фосфата кальция с серной кислотой образуется сульфат кальция, который выпадает в осадок и фосфорная кислота. Это реакция обмена: Ca3(PO4)2 + 6H+ + 3SO42- = 3CaSO4 + 6H+ + PO43- (полное ионное уравнение) Ca3(PO4)2 + 3SO42- = 3CaSO4 + PO43- (краткое ионное уравнение) 2Au3+Cl3 + 3H2O2- + 6NaOH → 3O20 + 2Au0 + 6NaCl + 6H2O Это окислительно-восстановительная реакция: 2Au3+ + 6ē → 2Au0 (восставновление|окислитель) 6O- - 6ē → 6O0 (окисление|восстановитель) 1.11 Задача 254. Какие процессы происходят на электродах гальванического элемента, образованного железом, погруженным в раствор его соли с концентрацией [Fe2+] = 0,001 моль/л и серебром, погруженным в раствор его соли? Вычислите концентрацию ионов Ag+ в растворе его соли, если ЭДС этого элемента 1,152 В. Составьте схему элемента, напишите электронные уравнения электродных процессов. Электродный потенциал металла () зависит от концентрации его ионов в растворе. Строго говоря, величина электродного потенциала зависит от соотношения не концентраций, а активностей ионов металла в растворе. Активность – это действительная концентрация ионов металла в растворе сильных электролитов. Но при невысоких концентрациях растворов погрешность, вносимая заменой активности на концентрацию, невелика. Поэтому, эту зависимость можно выразить уравнением Нернста в следующем виде: 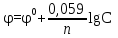 , (1.9) , (1.9)где 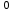 – стандартный электродный потенциал, В; – стандартный электродный потенциал, В;n – число электронов, принимающих участие в процессе (заряд иона металла); С – концентрация гидратированных ионов металла в растворе, моль/л. Стандартный электродный потенциал железа: 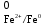 = -0,440 В. = -0,440 В.Определим электродныей потенциал железа по уравнению Нернста: 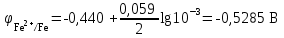 В гальваническом элементе анодом становится металл, обладающего меньшим значением электродного потенциала, а катодом – металл с большим значением электродного потенциала. Железо в электрохимическом ряду напряжений стоит левее серебра, значит, имеет меньшее значение электродного потенциала, чем серебро. Следовательно, в гальваническом элементе железный электрод будет анодом, а серебряный – катодом. Процесс окисления (анодный процесс) происходит на аноде. Процесс восстановления (катодный процесс) происходит на катоде. Максимальная разность потенциалов электродов, которая может быть получена при работе гальванического элемента, называется электродвижущей силой элемента. Она равна разности электродных потенциалов катода (более положительного электрода) и анода (менее положительного электрода): Е = катода 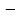 анода. (1.10) анода. (1.10)Электродвижущая сила данного элемента равна: 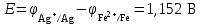 . .Соответственно, можно найти концентрацию ионов Ag+ в растворе его соли: 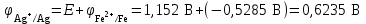 . .Запишем электронные уравнения электродных процессов А: Fe  - 2ē Fe2+ 1 - 2ē Fe2+ 12 K: Ag+ + 2ē Ag  2 2Железо, являясь анодом, растворяется при работе гальванического элемента, а серебро осаждается в виде металла на катоде. Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента имеет вид: Fe  + 2Ag2+ Fe 2+ + 2 Ag + 2Ag2+ Fe 2+ + 2 Ag  Схема данного гальванического элемента будет следующая: А(-) Fe / Fe 2+ Ag 2+/ Ag (+) K. 1.12 Задача 274. Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом; с растворимым - серебряным анодом. Вычислите массу серебра и объем кислорода, выделившихся на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом, если время электролиза 50 мин, сила тока 2А. На катоде протекает процесс восстановления. Так как данная соль образована катионами металлов, расположенными в ряду стандартных электродных потенциалов после водорода, на катоде восстанавливаются катионы этих металлов: Меn+ + nē Ме На аноде протекает процесс окисления. Так как данная соль образована кислородсодержащей кислотой, то на аноде окисляются молекулы воды с выделением О2: 2Н2О – 4ē О2 + 4Н В случае растворимых (активных) анодов сам анод подвергается окислению: Ме Меn+ + nē металл уходят уходят анода в раствор во внешнюю цепь Образующиеся катионы переходят в раствор, анод при этом растворяется. Серебро располагается в ряду стандартных электродных потенциалов после водорода, следовательно, на катоде будет идти восстановление катионов серебра. На аноде идет окисление молекул воды с выделением кислорода, т.к. соль образована кислородосодержащей кислотой: Ag2NO3 Ag+ + NO3- (-) Катод Ag+ NO3- Анод (+) Н2О Ag+ + ē 2Ag 2H2O - 4ē O2 + 4H+ Анион NO3- неокисляем. Суммарное уравнение электролиза раствора соли нитрата серебра (AgNO3): 4AgNO3 + 2Н2О  4Ag↓ + О2↑ + 4НNO3 4Ag↓ + О2↑ + 4НNO3Итак, в ходе электролиза раствора соли нитрата серебра на инертных электродах будут выделяться серебро (на катоде) и кислород (на аноде). Найдем массу серебра, полученного на катоде согласно закону Фарадея. Закон Фарадея выражается следующей формулой:  , (1.11) , (1.11)где Мэ – молярная масса эквивалента вещества, г/моль; J – сила тока, А; - продолжительность электролиза, с; F – число Фарадея (96500 Кл). Молярная масса эквивалента серебра в Ag2SO4 равна отношению молярной массы серебра к его валентности: Мэ(Ag) = МAg/1 = 107,87 г/моль. Подставив в формулу значения Мэ(Ag) = 107,87 г/моль, J = 2А, = 50 60 = 3000 с, получим:  . . При определении объемов выделившихся газов закон Фарадея имеет вид:  , (1.12) , (1.12)где V – объем выделившегося газа, л; Vэ – молярный объем эквивалента газа, л. Молярная масса кислорода М 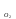 = 32 г/моль, молярная масса эквивалента кислорода М = 32 г/моль, молярная масса эквивалента кислорода М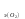 = 8 г/моль. Молярный объем эквивалента кислорода рассчитываем, исходя из следствия закона Авогадро: = 8 г/моль. Молярный объем эквивалента кислорода рассчитываем, исходя из следствия закона Авогадро:32 г кислорода при н.у. занимают объем 22,4 л 8 г кислорода при н.у. занимают объем х л (Vэ) 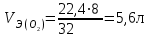 , тогда объем кислорода, выделившегося на аноде, будет равен: , тогда объем кислорода, выделившегося на аноде, будет равен: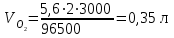 . .При замене инертного анода на серебряный, на аноде становится возможным протекание еще одного окислительного процесса - растворение серебра, из которого сделан анод: (+) А: Ag0 – ē = Ag+ Этот процесс характеризуется более низким значение потенциала, чем остальные возможные анодные процессы. Поэтому при электролизе раствора соли нитрата серебра (AgNO3) с серебряным анодом на аноде происходит реакция окисления серебра (Ag), а в анодном пространстве будет накапливаться AgNO3. Суммарная электродная реакция выразится уравнением в ионном виде: Ag0 + Ag+ = Ag+ + Ag0 Так как ионы сокращаются, то составить молекулярное уравнение электролиза раствора соли нитрата серебра (AgNO3) невозможно. Это означает, что электролиз раствора соли нитрата серебра (AgNO3) с анодом из серебра (Ag) сводится к переносу серебра с анода на катод. 1.13 Задача 294. Как происходит атмосферная коррозии пар Cd-Sn и Sn-Cu при нарушении целостности покрытия? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии? Во влажном воздухе происходит атмосферная коррозия. При этом поверхность металла, находящегося во влажном воздухе, покрывается пленкой воды, содержащей различные газы, и в первую очередь кислород. Стандартный электродный потенциал олова  , а стандартный электродный потенциал кадмия , а стандартный электродный потенциал кадмия  . Потенциал олова более положительный, следовательно, при контакте этих металлов кадмий будет анодом, а олово – катодом. Схема образующегося при атмосферной коррозии гальванического элемента будет следующая: . Потенциал олова более положительный, следовательно, при контакте этих металлов кадмий будет анодом, а олово – катодом. Схема образующегося при атмосферной коррозии гальванического элемента будет следующая:А (-) Cd O2, H2O Sn (+) K Электронные уравнения электродных процессов: А: Cd0 - 2ē Cd2+ K  : O2 + 2H2O + 4ē 4OH : O2 + 2H2O + 4ē 4OH2H2O + 4ē 4OH Уравнивая число электронов, участвующих в катодном и анодном процессах, можно записать суммарное уравнение: 2Cd  +O2 + 2H2O 2Cd2+ + 4OH- +O2 + 2H2O 2Cd2+ + 4OH-Ионы Cd2+ взаимодействуют с гидроксид-ионами: Cd2+ + 2ОH- Cd(ОН)2. Образующийся гидроксид Cd(ОН)2 является продуктом коррозии. Стандартный электродный потенциал олова 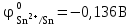 , а стандартный электродный потенциал меди , а стандартный электродный потенциал меди 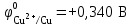 . Потенциал меди более положительный, следовательно, при контакте этих металлов олово будет анодом, а медь – катодом. Схема образующегося при атмосферной коррозии гальванического элемента будет следующая: . Потенциал меди более положительный, следовательно, при контакте этих металлов олово будет анодом, а медь – катодом. Схема образующегося при атмосферной коррозии гальванического элемента будет следующая:А (-) Sn O2, H2O Cu (+) K Электронные уравнения электродных процессов: А: Sn0 - 2ē Sn2+ │2 K: O2 + 2H2O + 4ē 4OH │1 Суммируя реакции на аноде и катоде, получаем уравнение, которое в ионной форме, выражает происходящую в гальванической паре реакцию: 2Sn0 + 2H2O + О2 → 2Sn2+ + 4OH- Уравнение электрохимической коррозии в молекулярной форме: 2Sn + 2H2O + О2 → 2Sn(OH)2↓ Образующийся гидроксид Sn(ОН)2 является продуктом коррозии. СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ1. Химия: учебное пособие / Е.Ю. Ларина, Е.Н. Коптелова, Л.В. Герасимова; Сев. (Арктич.) федер. ун-т им. М.В. Ломоносова. – Архангельск: ИД САФУ, 2016. – с. 210. 2. СТО 60-02.2.3-2018. Стандарт организации. Общие требования к оформлению и изложению документов учебной деятельности обучающихся [Электронный ресурс]. – Режим доступа: https://narfu.ru/upload/medialibrary/d11/STO-24.01.2018.pdf, свободный. – (Дата обращения: 21.01.2019). 1 2 | ||||||||||||||||
