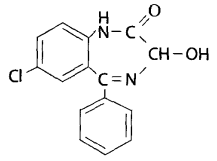
токсикологическая химия контрольная работа №1. Задача 2 На схэ доставлены внутренние органы, кровь, спинномозговая жидкость, моча трупа
 Скачать 487.24 Kb. Скачать 487.24 Kb.
|
|
ВАРИАНТ № 2 СИТУАЦИОННЫЕ ЗАДАЧИ ЗАДАЧА № 2 На СХЭ доставлены: внутренние органы, кровь, спинномозговая жидкость, моча трупа. Обстоятельства дела. В госпиталь города Ростова был доставлен мужчина в возрасте 32 лет с клиническими признаками передозировки опиатов. Из анамнеза: пострадавший принимал участие в боевых действиях в Чечне, был ранен, пристрастился к наркотикам, в течение последнего года проходил курс лечения с использованием метадона. Со слов родственников потерпевшего: «метадоновая» терапия не изменила его состояния. Он опять стал покупать «грязный», «уличный» героин. Несмотря на все принятые в госпитале меры, мужчина скончался. Цель исследования: провести СХЭ представленных биообъектов. Информация: В результате СХЭ обнаружены, идентифицированы, количественно определены морфин, 6-МАМ, метадол, ацетилметадол, продукты метаболизма диазепама. Приведите схему химико-токсикологического анализа представленных биообъектов, опираясь на методологию системного химико-токсикологического анализа (СХТА): Какими документами, регламентирующими работу в области судебно-химической экспертизы, Вы будете пользоваться? В каких объектах будет наибольшее содержание токсикантов и (или) их метаболитов (почему)? Прогнозируйте возможные реакции метаболизма токсикантов (на 1-ой и 2-ой стадиях). Какие способы пробоподготовки Вы будете использовать? Какие требования к метрологическому обеспечению (СХТА) при проведении этой экспертизы? Лаборатория оснащена по стандарту GLP современными приборами для проведения химико-токсикологического анализа. Выбор оптимальных методов качественного и количественного анализа, предусмотренных соответствующими приказами, - за Вами. Какой наиболее эффективный способ расчета количественного содержания токсикантов Вы можете предложить? Ответ: Какими документами, регламентирующими работу в области судебно-химической экспертизы, Вы будете пользоваться? Документы, регламентирующие работу в области СХЭ:
В каких объектах будет наибольшее содержание токсикантов и (или) их метаболитов (почему)? Героин при внутривенном введении практически сразу (в течение 30 мин) подвергается деметилированию с образованием 6-МАМ и морфина, которые накапливаются в печени, почках, легких, мозге, селезенке. В извлечениях из этих органов концентрация морфина и 6-МАМ будет максимальной. Кроме того высокое содержание метаболитов героина будет выявлено в моче. Метадол и ацетилметадол накапливаются во внутренних органах – печени, почках, жировой ткани, легких, костном мозге. Накопление бензодиазепинов происходит в веществе головного мозга. Прогнозируйте возможные реакции метаболизма токсикантов (на 1-ой и 2-ой стадиях). Метаболизм токсикантов Героин. В крови в Ι фазе метаболизма гидролизуется до 6-МАМ (6-моноацетилморфина) и морфина, во ΙΙ фазе образуются конъюгаты с глюкуроновой кислотой. Ι фаза – гидролиз 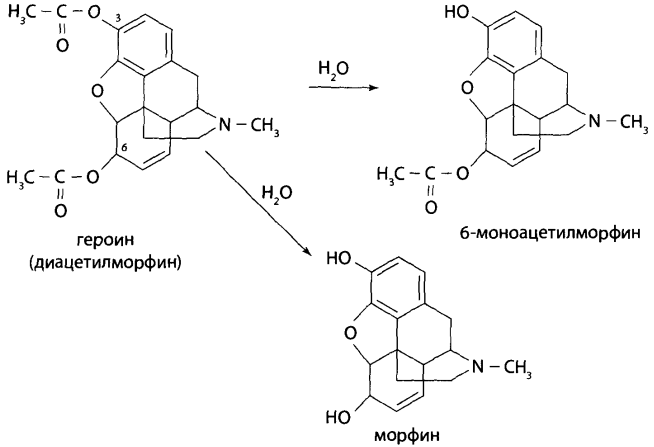 ΙΙ фаза – конъюгация с глюкуроновой кислотой 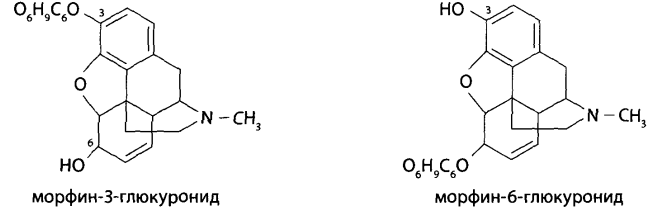 Метадон. Метаболизм происходит по пути деметилирования с последующей циклизацией – Ι фаза и гидроксилированием фенильных радикалов и конъюгацией с глюкуроновой кислотой – ΙΙ фаза. 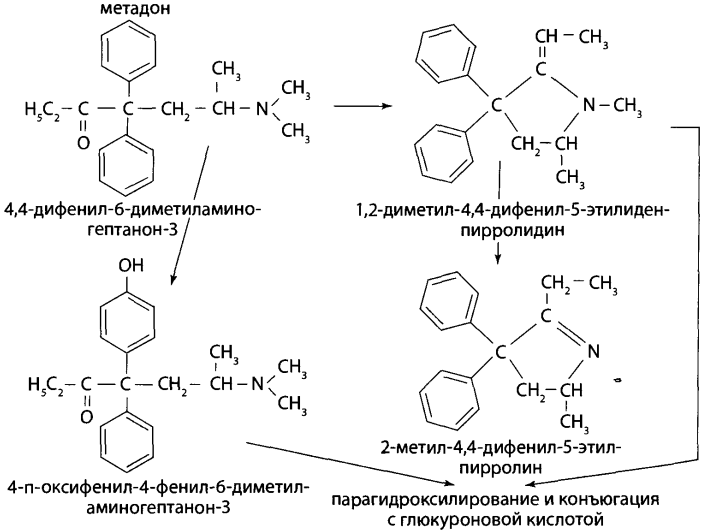 Диазепам. Ι фаза – деметилирование в положении 1 и 2, окисление в положении 3 с образованием гидроксильной группы: 1) деметилирование: 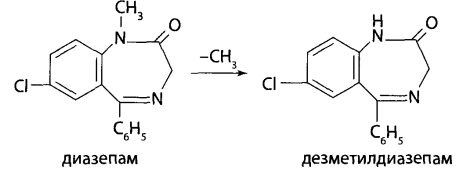 2) окисление: 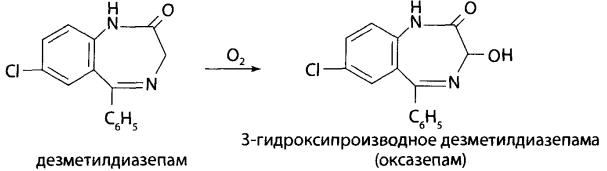 ΙΙ фаза – конъюгация с глюкуроновой или серной кислотой метаболитов диазепама: - образование конъюгатов с глюкуроновой или серной кислотой: 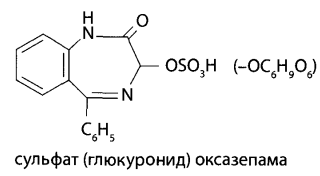 Какие способы пробоподготовки Вы будете использовать? Пробоподготовка; 1. Внутренние органы – измельчение, вымораживание, лиофилизация при низких температурах. 2. Кровь – добавление смешивающихся с водой органических растворителей (этанол, метанол, ацетонитрил, ацетон и др.). 3. Моча – проведение разрушения конъюгатов с глюкуроновой и серной кислотами (неспецифический кислотный или специфический ферментативный гидролиз). Какие требования к метрологическому обеспечению (СХТА) при проведении этой экспертизы? Лаборатория оснащена по стандарту GLP современными приборами для проведения химико-токсикологического анализа. Чувствительность используемых для судебно-химического анализа методик должна в пределах не ниже предполагаемых токсических доз. Обычно предел обнаружения для аналитических методик составляет 10-3-10-6 г на взятую для исследования пробу. Выбор оптимальных методов качественного и количественного анализа, предусмотренных соответствующими приказами, - за Вами. 1. Изолирование токсикантов. Объекты исследования: 1) желудок с содержимым; 2) печень, селезенка, почки; 3) легкие; 4) кровь, моча, ликвор; 5) головной и спинной мозг. 1.1. Морфин. Морфин изолируют из биологического материала путем настаивания с полярным растворителем (подкисленным спиртом или подкисленной водой) и экстрагируют хлороформом из растворов с рН = 8-10 (1-2% - из-за плохой растворимости в хлороформе). Хроматографический метод изолирования из трупного материала с использованием катионита СДВ-3 и элюированием сорбированного морфина 5% раствором аммиака - изолируется до 20% морфина. Метод Крамаренко позволяет изолировать до 50% морфина. 1.2. 6-МАМ (6-моноацетилморфин). 6-моноацетилморфин также изолируют из биологического материала путем настаивания с полярным растворителем (подкисленным спиртом или подкисленной водой) и экстрагируют хлороформом из растворов с рН = 8-10. 1.3. Метадол (метадон), ацетилметадол. Для изолирования применяют жидкость-жидкостную экстракцию при рН > 7, твердофазную экстракцию в специальных патронах. 1.4. Продукты метаболизма диазепама – оксазепам и его конъюгаты с серной и глюкуроновой кислотами. Биообъектами могут быть: - желудок с содержимым; - тонкий кишечник с содержимым; - головной мозг; - печень, почки; - кровь, моча. Производные 1,4-бензодиазепина изолируют из биологического материала путем настаивания с полярным растворителем (подкисленным спиртом или подкисленной водой) и экстрагируют из водной фазы хлороформом при рН = 10 (для оксазепама) или используют сорбционный метод на полимерных сорбентах с последующим элюированием исследуемых соединений из сорбента. Полученные экстракты (элюаты) упаривают до небольшого объема ≈ 0,5-1 мл (концентрирование). Гидролиз оксазепама до 2-амино-5-хлорбензофенона Гидролиз бензодиазепинов до 2-аминобензофенонов: для проведения гидролиза могут быть использованы непосредственно ткани органов, хлороформные экстракты подкисленных вытяжек и элюаты при применении сорбционного метода. Определенный объем элюата или экстракта выпаривают досуха. К сухому остатку, навеске ткани органа, к 10 мл мочи или 2 мл крови прибавляют 2 мл 6М раствора хлороводородной кислоты. Смесь нагревают на кипящей водяной бане в течение 1 часа или в течение 5-10 мин на глицериновой (песчаной) бане при 120°С. При наличии в объекте производных 1,4-бензодиазепина раствор окрашивается в желтый цвет за счет образования бензофенонов (завершение гидролиза). Первая часть гидролизата используется для проведения цветных реакций. Вторую часть гидролизата осторожно подщелачивают 50% раствором гидроксида натрия до рН = 10-11 и экстрагируют гексаном. Гексановые экстракты выпаривают досуха при комнатной температуре, остаток растворяют в небольшом объеме этанола и исследуют с помощью ТСХ и УФ-спектрофотометрии. 2. Обнаружение токсикантов. 2.1. Морфин, 6-МАМ. Физические методы Предварительные методы 2.1.1. ТСХ-скрининг извлечений из щелочного раствора – морфин и 6-МАМ обнаруживается в виде оранжевых пятен на желтом фоне при обработке реактивом Драгендорфа. Подтверждающие методы 2.1.2. Хроматография в тонком слое сорбента. Остаток после испарения экстракта из водной вытяжки раствора с рН = 8-10 наносят на стартовые линии хроматографических пластинок («Силуфол», «Сорбфил», «Кизельгель-60 (G)»), содержащие флуоресцирующие добавки. Одновременно на пластинки наносят растворы «стандартов» в метаноле, содержащих 1 мг/л морфина и др. опиатов в количестве 5-10 мкл. После подъема системы на высоту 10 см пластинку высушивают и выдерживают в термостате при 120° 10 мин. Затем последовательно применяют: - освещение УФ-лучами с длиной волны 254 нм – регистрируют пятна по отсутствию флуоресценции; - обработку реактивом Драгендорфа – оранжевые пятна на желтом фоне; - обработка раствором йодплатината калия – пятна опиатов темнеют, а пятна морфина переходят в сине-фиолетовый цвет. 2.1.3. ВЭЖХ. Позволяет определять основные метаболиты – глюкурониды и исключить стадию гидролиза при пробоподготовке. Идентифицируют вещества по удерживаемому объему (времени удерживания) и по спектральным отношениям с использованием нескольких длин волн. Полученные параметры удерживания и спектральные отношения должны совпадать с параметрами стандартных образцов веществ.
2.1.4. ИК-спектроскопия. Остаток после испарения экстракта органического растворителя из объекта, очистки с помощью ТСХ растирают с кристаллами бромида калия и анализируют ИК-спектр. Полосы поглощения исследуемого вещества должны совпадать с полосами поглощения стандартных веществ. Морфин дает характеристические полосы поглощения (см-1) – 805, 1243, 1448, 945, 1086, 833. 2.1.5. УФ-спектрофотометрия. Остаток после испарения хлороформного экстракта очищают с помощью ТСХ, очищенные вещества элюируют с пластинки этанолом или 0,1М растворами гидроксида натрия, серной или соляной кислот. Регистрируют спектры поглощения элюатов в области 200-320 нм. Результаты анализа сравнивают со спектрами поглощения стандартных веществ. В этанольном растворе у морфина максимум светопоглощения регистрируется в области 287 нм, в растворе 0,1М соляной кислоты – в области 285 нм. 2.1.6. ГЖХ. Анализ проводят после очистки извлечений из объектов с помощью ТСХ. Обнаружение опиатов основано на измерении индекса удержания. Для морфина индекс удержания равен 2450. 2.1.7. Хроматомасс-спектрометрия по Е.К.Еремину. Используется для идентификации и количественного определения опиатов в варианте электронного удара. Для идентификации анализ Проводится в режиме сканирования. Для заключения об обнаружении конкретного вещества необходимо совпадение времен удерживания всех выбранных ионов и соответствие интенсивностей этих ионов, величинам, полученным для стандартных веществ (допускается отклонение не более ±20%). Химические методы Предварительные методы 2.1.8. Общеалкалоидные осадительные реакции. Морфин и 6-МАМ дают аморфные осадки. Подтверждающие методы 2.1.9. Реакции окрашивания. Морфин дает характерные окрашенные соединения с реактивами: 1) Манделина – фиолетовое; 2) Марки – красно-фиолетовое; 3) Фреде – фиолетовое; 4) Эрдмана – красное, переходящее в желтое. При добавлении к морфину и 6-МАМ раствора хлорида железа (ΙΙΙ) появляется синее окрашивание; при добавлении к морфину 1-2 капель концентрированной азотной кислоты появляется кроваво-красное окрашивание, переходящее в желтое; при взаимодействии щелочного раствора морфина с диазотированной сульфаниловой кислотой на месте соприкосновения растворов появляется красное окрашивание. 2.1.10. Реакция этерификации (для 6-МАМ). К части исследуемого остатка извлечения из объекта добавляют 1 мл концентрированной серной кислоты, несколько капель этилового спирта и нагревают – при этом ощущается характерный запах уксусноэтилового эфира (яблочной эссенции): 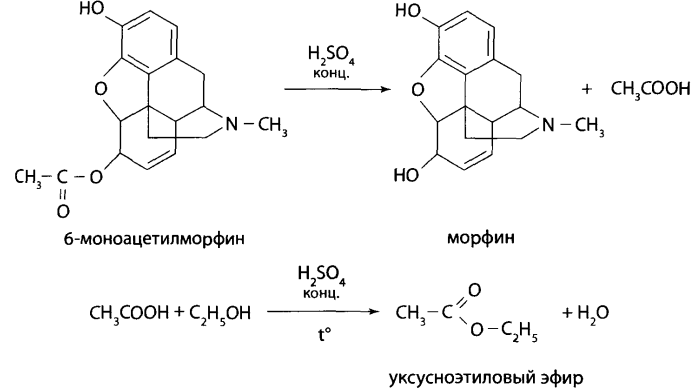 Микрокристаллоскопические реакции 2.1.11. Хлороформный экстракт из объекта выпаривают досуха на предметных стеклах, добавляют 1-2 капли 0,1М раствора соляной кислоты и каплю соответствующего реактива. Смесь выдерживают во влажной камере 10-15 мин. Образуется осадок с характерной для конкретного вещества формой кристаллов. В качестве реактивов используют хлорид ртути (ΙΙ), хлорид кадмия, соль Рейнеке, пикролоновую кислоту, цианид натрия и др. 2.2. Метадол, ацетилметадол. Физические методы Подтверждающие методы 2.2.1. Хроматография в тонком слое сорбента. Метадон анализируют, используя систему растворителей бензол-этанол-диэтиламин (9 : 1 : 1). Rf для метадона равно 0,80. Пятна на пластинках детектируют в УФ-лучах с длиной волны 254 нм – гашение флуоресценции. При последующей обработке реактивом Драгендорфа пятна окрашиваются в оранжевый цвет. 2.2.2. ВЭЖХ (см. Морфин, 6-МАМ). 2.2.3. Газовая хроматография с масс-спектральным детектированием. После испарения органического растворителя рекомендуется проводить дериватизацию выделенных из биоматериала веществ с помощью уксусного или перфторуксусного ангидрида. Анализ проводят, используя хроматомасс-спектрометрию электронного удара. Сканирование масс-спектров ведут в диапазоне 31-550 дальтон.
Химические методы Подтверждающие реакции 2.2.4. Реакции окрашивания. Метадон при взаимодействии с реактивом: 1) Марки – дает розово-красное, переходящее в интенсивное флуоресцирующее окрашивание; 2) Либермана – дает оранжевое окрашивание; 3) Манделина (смесь концентрированной серной кислоты и ванадата аммония) – зеленое, переходящее в голубое окрашивание; 4) Фреде (смесь концентрированной серной кислоты и молибдата аммония) – серо-коричневое окрашивание. 2.3. Продукты метаболизма диазепама – оксазепам и его конъюгаты с глюкуроновой и серной кислотой. 2.3.1. Положительный результат предварительных реакций: 1) выпадение аморфного осадка при обработке извлечений из биообъекта; 2) выявление при ТСХ на хроматографической пластинке светящихся в УФ-свете пятен, которые после обработки реактивом Драгендорфа приобретают оранжевый цет; 3) появление желтого окрашивания при проведении гидролиза производных 1,4-бензодиазепина за счет образования бензофенонов. Подтверждающие реакции на бензофеноны 2.3.2. Реакция образования азокрасителя (Браттона-Маршалла). При добавлении к части гидролизата после охлаждения капли 5% нитрита натрия и внесении нескольких капель полученного раствора в 2 мл свежеприготовленного 2% щелочного раствора резорцина или β-нафтола появление вишнево-красного окрашивания (для оксазепама) свидетельствует о наличии бензофенона: 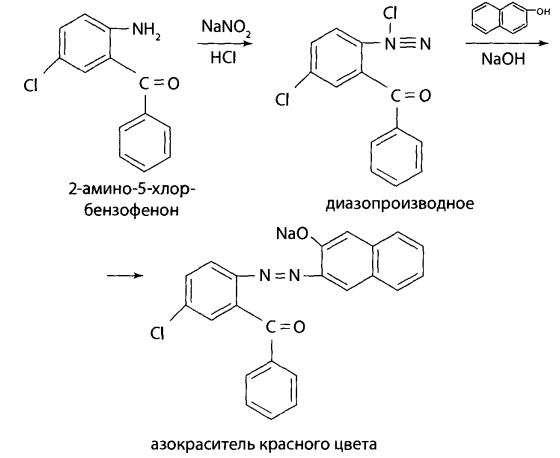 Подтверждающие реакции на оксазепам 2.3.3. Реакция гидролиза амидокарбинольной группы. К сухому остатку прибавляют 5 мл 96% этилового спирта и 4 капли концентрированной фосфорной кислоты. Смесь нагревают на кипящей водяной бане не менее 5 мин. Раствор охлаждают. К 1 мл полученного раствора добавляют 5мл воды очищенной и 1 мл фуксинсернистой (хромотроповой) кислоты – наблюдается появление фиолетового окрашивания. Физические методы обнаружения оксазепама 2.3.4. ИК-спектроскопия. Сухой остаток после испарения хлороформного экстракта или элюата растирают с кристаллами бромида калия, прессуют в диски. В ИК-спектре бензодиазепинов появляются интенсивные полосы за счет валентных колебаний ОН-, NH-, СО-, С-С-групп. Оксазепам дает характеристические полосы в ИК-спектре (см-1) – 1706, 1687, 830, 693 см-1. 2.3.5. УФ-спектрофотометрия. Характеристические полосы в УФ-спектре: водная кислота – 234, 280 нм, водная щелочь – 233, 344 нм, этанол – 230, 315 нм (см. рис.). 2.3.6. Газожидкостная хроматография (ГЖХ). Проводится с использованием колонок длиной 2 мм и диаметром 4 мм на хромосорбе Q (80-100 меш.) с покрытием SE-30. Обнаружение бензодиазепинов и их метаболитов проводят по соответствующим индексам удерживания. Для оксазепама индекс удерживания равен 2336. 2.3.7. Высокоэффективная газожидкостная хроматография (ВЭЖХ). Обнаружение производных 1,4-бензодиазепина предложено производить по нативным соединениям или бензофенонам. При использовании жидкостного хроматографа «Милихром-А02» для оксазепама получены следующие данные хроматографического анализа методом ВЭЖХ:
3. Количественное определение токсикантов 1. ВЭЖХ. Метод внешнего и внутреннего стандарта (в качестве внутреннего стандарта используется налорфин), метод добавок (морфин). Оксазепам Метод добавок. Анализ проводят с экстрактом из биологического объекта или элюатом после проведения твердофазной экстракции с добавлением в него определенного количества (эталонный раствор) обнаруженного бензодиазепина или бензофенона. Метод внешнего стандарта. Вслед за анализом с помощью ВЭЖХ исследуемого экстракта или элюата в тех же условиях проводят определение эталонного раствора, концентрация которого близка к концентрации бензодиазепина или бензофенона в извлечении из биообъекта. Метод внутреннего стандарта. В биообъект до начала его пробоподготовки добавляют известное количество вещества, принятого за стандарт. После исследования с помощью ВЭЖХ проводят расчет концентрации определяемого вещества. Расчеты для этих трех методов осуществляют по специальным формулам. 2. УФ-спектрофотометрия. Анализ ведут при длинах волн, соответствующих максимуму светопоглощения токсиканта. Расчет токсиканта производится по калибровочному графику (морфин, 6-МАМ, метадон, ацетилметадол). 3. ГЖХ. Расчет концентраций производится по калибровочным графикам (морфин, 6-МАМ, метадон, ацетилметадол). 4. Фотоколориметрические методы. Метод В.Ф.Крамаренко (непосредственной фотоколориметрии) и экстракционно-фотоколориметрический метод – для морфина. Фотоколориметрия по реакции образования азокрасителя с бензофенонами (для оксазепама). 5. Иммунохимические методы – поляризационный иммуноанализ (для опиатов и опиоидов). Какой наиболее эффективный способ расчета количественного содержания токсикантов Вы можете предложить? Наиболее эффективным способом количественного определения токсикантов является ВЭЖХ, т.к. позволяет исключить из пробоподготовки стадию гидролиза и определять основные метаболиты токсикантов - глюкурониды. КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Правила проведения судебно-химического исследования в судебно-химических отделениях бюро судебно-медицинской экспертизы. Судебно-химические экспертизы проводят в специально оборудованных для химических работ помещениях. Доступ в лабораторию должен быть ограничен для посторонних лиц. Помещение должно соответствовать санитарным нормам и нормам техники безопасности, должно быть изолировано от других отделений Бюро и по окончании работы запираться и опечатываться печатью отделения. Прием и хранение объектов исследования (вещественных доказательств) и сопроводительных документов 1.Объекты исследования (вещественные доказательства) поступают через канцелярию Бюро или непосредственно в СХО согласно правил направления трупного материала на СХЭ: - Объекты регистрируют вместе с документами к ним в регистрационном журнале СХО (журнал должен быть пронумерован, прошнурован, опечатан и подписан заведующим СХО). - Объекты подвергают подробному осмотру и описанию, отмечая характер упаковки, надписей, печати, проверяя соответствие данным, указанным в направлении (постановлении) 2. Вещественные доказательства до начала судебно-химической экспертизы, в процессе проведения анализа и до его окончания хранят в условиях, обеспечивающих их сохранность: - не подвергающихся гниению - в закрытом опечатанном металлическом шкафу, - подвергающиеся гниению (внутренние органы, биожидкости) - в герметически закрывающейся посуде в холодильнике, который опечатывают по окончании работы. 3. По окончании экспертизы: - не подвергающиеся гниению объекты возвращают вместе с заключением приславшему их учреждению - подвергающиеся гниению оставляют на хранение в СХО в течение одного года по окончанию экспертизы, после чего уничтожают согласно «Правил хранения и уничтожения...» (объекты, поступившие для исследования на наличие только этанола, уничтожаются через один месяц после окончания анализа) - сопроводительные документы хранят в архиве вместе с копией «Акта судебно-химического исследования» Основные правила судебно-химического исследования 1. Судебно-химическая экспертиза должна быть начата в день поступления объектов на анализ. Если это невозможно, то объекты хранят в холодильнике. 2. Приступая к СХЭ, эксперт тщательно осматривает объекты и описывает в рабочем журнале, устанавливая полное соответствие полученных объектов с описанием их в сопроводительном документе. 3. Эксперт тщательно изучает все сопроводительные материалы и составляет план исследования. 4. Для проведения СХЭ расходуют 2/3 присланных объектов, 1/3 остается в архиве (для повторного анализа, если возникнет необходимость). Однако при ограниченном количестве расходуют весь объект по согласованию с приславшей организацией. 5. Исследование в зависимости от поставленных вопросов может быть проведено на определенное соединение, группу веществ или на неизвестное вещество по схеме общего СХЭ (скрининг-анализа). 6. Для исследования всегда нужно применять только те методы и процедуры, с которыми эксперт ранее ознакомился, владеет ими, знает все условия, сможет учесть все ошибки, которые могут возникать. Все методики должны быть заранее апробированы. Основной задачей СХЭ является выбор оптимального метода изолирования. Для качественного обнаружения используют предварительные и подтверждающие методы, с их учетом чувствительности и специфичности. 7. Каждое судебно-химическое исследование следует проводить как количественное, в которое оно может быть превращено на любой стадии работы. 8. Количественное определение производят во всех случаях, где это возможно и имеются соответствующие методики определения. Количество найденных веществ относится к 100 г навески объекта и выражается в весовых единицах 9. Все методы количественного определения должны быть апробированы на той биологической матрице, которая будет использоваться для анализа (кровь, моча, ткани органов) по схеме модельных опытов. 10. Следует убедиться в химической чистоте используемых для анализа реактивов, при этом на чистоту реактивы проверяют в тех максимальных количествах, в которых они будут употреблены для анализа и теми же методами и реакциями, которые будут применены в ходе СХЭ. 11. Для обеспечения высокого качества производства экспертизы рекомендуется производить внутрилабораторный и внешний контроль качества, ориентированный как на метод, так и на определяемое вещество. Судебно-химическое отделение должно быть лицензировано (аттестовано). 2. Понятие о рецепторах токсичности. Характеристика связи яда с рецептором. Рецептор токсичности – это химически активная группировка, в норме участвующая в метаболизме клетки, к которой способна присоединяться молекула токсиканта. Сродство токсиканта к рецептору определяется прочностью возникающей химической связи. Наиболее прочной является ковалентная связь, которая может образоваться либо по обменному, либо по донорно-акцепторному механизму (образование комплексных соединений между токсикантом и рецептором). В случае ковалентного связывания реакция образования комплекса токсикант-рецептор необратима. Нековалентное связывание с помощью ионных, иондипольных, водородных и ван-дер-ваальсовых взаимодействий обратимо. 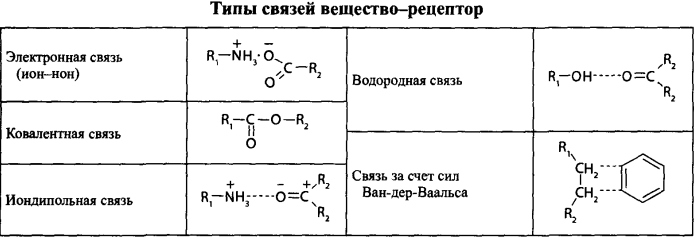 Образование ковалентных связей между рецептором и токсикантом характерно для: 1) взаимодействия «металлических ядов» с –SH-группами белков; 2) взаимодействии изониазида, гистидина, цистеина и цистина с ионами меди (образование координационных соединений); 3) протонирования эндогенных азотсодержащих гетероциклов при отравлении кислотами; 4) фосфорилирования гидроксильных групп аминокислот; 5) взаимодействия нейтральных свободных радикалов с биомолекулами. 3. Стадии развития острых отравлений. Организация службы клиники острых отравлений в Российской Федерации. Острое отравление – развивается при одномоментном поступлении в организм токсической дозы яда. В клинической картине острого отравления выделяют стадии. 1. Токсикогенная стадия. Это стадия нахождения токсиканта в организме в дозе, способной вызвать его специфическое действие (делирий, кома, экзотоксический шок, аритмии, токсический отек легких и др.). Включает в себя 2 фазы. 1.1 Фаза резорбции (всасывания) яда – продолжается до достижения максимальной концентрации яда в крови. 1.2. Фаза элиминации (выделения) яда – длится до полного выведения токсиканта и его метаболитов из организма. 2. Соматогенная стадия острого отравления начинается с момента исчезновения (удаления или разрушения) яда из организма и характеризуется формированием поражений структуры и нарушения функций различных органов и систем. Соматогенная стадия отличается отсутствием четких признаков токсикологической специфичности. Это стадия осложнений острого отравления. Организация службы клиники острых отравлений в Российской Федерации Приказом Министерства здравоохранения Российской Федерации от 8 января 2002 г. N 9 учреждены Центры и Отделения острых отравлений. Центр острых отравлений (далее Центр) создается в каждом субъекте Российской Федерации или в городе с населением свыше 1 млн. человек на базе больницы скорой медицинской помощи, республиканской (краевой, окружной, областной) или другой многопрофильной больницы и является ее структурным подразделением, на которое при необходимости могут быть возложены функции окружного центра. Центр осуществляет следующие функции: 1. Обеспечение специализированной помощи при острых отравлениях с использованием современных методов диагностики и лечения. 2. Выполнение функций организационно-методического центра по проблемам острых химических отравлений. 3. Разработка и проведение совместно с заинтересованными организациями мероприятий по профилактике всех видов острых отравлений. 4. Организация и проведение работы с населением по предупреждению острых отравлений. 5. Участие в профилактике и ликвидации медицинских последствий техногенных химических аварий. 6. Обеспечение ежедневной круглосуточной консультативной помощи лечебно-профилактическим учреждениям по вопросам оказания медицинской помощи при острых отравлениях, а также предоставление необходимой информации другим организациям и населению. 7. Участие в проведении экспертизы временной нетрудоспособности и прогностической оценки степени тяжести заболевания госпитализированных больных, а также в решении вопросов целесообразности направления на медико – социальную экспертную комиссию (МСЭК) больных с инвалидизирующим течением заболевания. 8. Внедрение в практику новых лечебно-диагностических технологий на основе последних научно-технических достижений, а также передового опыта аналогичных учреждений, в том числе в области информатизации. 9. Организацию статистической системы сбора, учета, анализа и отчетности по острой химической патологии. 10. Взаимодействие с Центрами ГСЭН, бюро судебно-медицинской экспертизы субъекта Российской Федерации, другими центрами (отделениями) острых отравлений и ИКТЦ Минздрава России, с целью обеспечения сбора, учета, анализа распространенности, структуры, причин и осуществления профилактики острых отравлений. Отделение острых отравлений (далее Отделение) создается на базе лечебно-профилактического учреждения: больницы скорой медицинской помощи, республиканской (краевой, окружной, областной) или другой многопрофильной больницы и является его структурным подразделением. Выполняет функции пп. 1, 6, 8, 9, 10 Центра. 4. Методы математической статистики в химико-токсикологическом анализе. Аналитические методы, используемые в химико-токсикологических исследованиях должны быть валидированы (метрологически аттестованы). Валидация метода анализа обеспечивает отсутствие систематической ошибки при его последующем использовании. Валидация, метрологическая аттестация метода анализа, - это лабораторная оценка степени пригодности аналитических методов. После того, как лабораторное оборудование прошло валидационные испытания, его можно использовать для определения токсичных веществ в биоматериалах и вещественных доказательствах. Получаемые при анализе результаты должны быть метрологически оценены (статистически обработаны). Их статистическая обработка заключается в расчете ряда метрологических параметров. При оптимальном объеме выборки (n≥5) определяют: - среднее значение определяемой величины 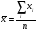 ; ;- случайное отклонение i-ой варианты от среднего  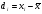 ; ;- дисперсию V (s2), показывающую рассеяние вариант относительно среднего 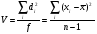 ; ; - стандартное отклонение (или среднее квадратичное отклонение) s s = 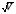 = = 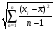 ; ;- стандартное отклонение среднего 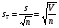 - относительное стандартное отклонение 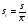 Дисперсия V, стандартное отклонение s и стандартное отклонение среднего 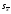 , относительное стандартное отклонение , относительное стандартное отклонение 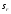 характеризуют воспроизводимость анализа. Чем меньше их значения, тем лучше воспроизводимость анализа. характеризуют воспроизводимость анализа. Чем меньше их значения, тем лучше воспроизводимость анализа. Далее определяют доверительный интервал среднего, т.е. интервал значений определяемой величины, в котором с заданной доверительной вероятностью Р (например, 0,95 или 0,99) находится действительное значение определяемой величины 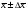 . Полуширину доверительного интервала находят по формуле: . Полуширину доверительного интервала находят по формуле: 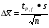 , где tP,f – коэффициент Стьюдента, зависящий от доверительной вероятности Р и числа степеней свободы f = n-1. , где tP,f – коэффициент Стьюдента, зависящий от доверительной вероятности Р и числа степеней свободы f = n-1.Окончательно результат может быть представлен в виде относительной ошибки среднего результата 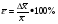 5. Виды изолирования. Факторы, влияющие на выбор изолирования. Изолирование – это выделение токсиканта (или его метаболитов) из объекта исследования, его очистка и концентрирование в анализируемой пробе. Виды изолирования 1. Изолирование токсикантов путем экстракции и сорбции. 1.1. Изолирование амфифильными растворителями (ацетон, метанол, этанол, ацетонитрил) – эти растворители имеют сродство как к гидрофобным, так и к гидрофильным участкам мембран клеток. Метод применяется для экстракции наркотических веществ и лекарственных препаратов. 1.2.1. Изолирование подкисленным спиртом. Метод Стаса-Отто. Метод Е.М.Саломатина. 1.2.2. Изолирование нейтральным ацетоном. 1.2. Изолирование подкисленной водой. Метод Степановой-Швайковой. Метод А.А.Васильевой. Метод В.Ф.Крамаренко. Метод В.И.Поповой. 1.3.Изолирование подщелоченной водой. Метод П.Валова 1.4. Изолирование лекарственных и наркотических веществ из мочи твердофазной экстракцией (сорбционный метод). 1.5. Экстракция органическими растворителями (ФОС, хлорпроизводные, севин, органические соединения ртути). 1.6. Экстракция водой в сочетании с диализом. 2. Изолирование токсикантов методами минерализации. Применяется для обнаружения «металлических ядов». 2.1. Методы «мокрой» минерализации. Минерализация серной и азотной кислотами. Минерализация серно, азотной и хлорной кислотами. 2.2. Метод минерализации для обнаружения ртути (модификация А.Н.Крыловой). 2.3. Изолирование токсикантов методами «сухого озоления». Метод сплавления с карбонатом и нитратом натрия. Метод простого сжигания. 3. Изолирование «летучих ядов». 3.1. Изолирование методом перегонки с водяным паром. 3.2. Изолирование методами «микроперегонки» и микродиффузии. Выбор способа изолирования определяется: 1) природой объекта (биоматериал, одежда, пищевые продукты) и метрологическими параметрами методики; 2) предысторией объекта – обстоятельства отравления, предварительное исследование; указание на происхождение; 3) сочетаемостью метода изолирования с методами последующего обнаружения и определения токсиканта в извлечении. УПРАЖНЕНИЯ 2. На судебно- химическую экспертизу доставлены внутренние органы трупа г-на С., 25 лет. Со слов родственников, С. принял примерно 40 табл. нозепама, умер дома. Приведите формулу, химическое название, физико-химические, спектральные и хроматографические характеристики токсиканта. Представьте процедуру пробоподготовки биообъектов, способ (способы) выделения (изолирования) токсиканта. Ответ: Приведите формулу, химическое название, физико-химические, спектральные и хроматографические характеристики токсиканта.
Физико-химические свойства токсиканта Оксазепам – обычно белое кристаллическое вещество, но допускается наличие желтоватого, зелено-желтого или кремового оттенка. Практически нерастворим в воде, малорастворим в эфире и этаноле, хорошо растворим в хлороформе. Обладает слабоосновными свойствами за счет гетероатома азота в положении 4 и слабокислотными свойствами за счет имидо-имидольной таутомерии в положении 1-2. Спектральные и хроматографические характеристики токсиканта 1. ИК-спектроскопия. Оксазепам дает характеристические полосы в ИК-спектре (см-1) – 1706, 1687, 1136, 1123, 830, 693 см-1 (см. рис.). 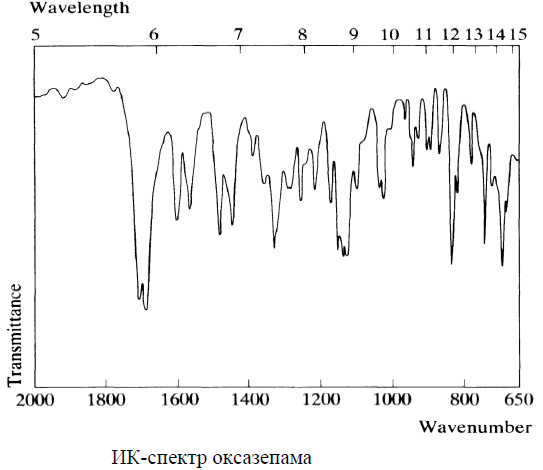 2. УФ-спектрофотометрия. Характеристические полосы в УФ-спектре: водная кислота – 234, 280 нм, водная щелочь – 233, 344 нм, этанол – 230, 315 нм (см. рис.). 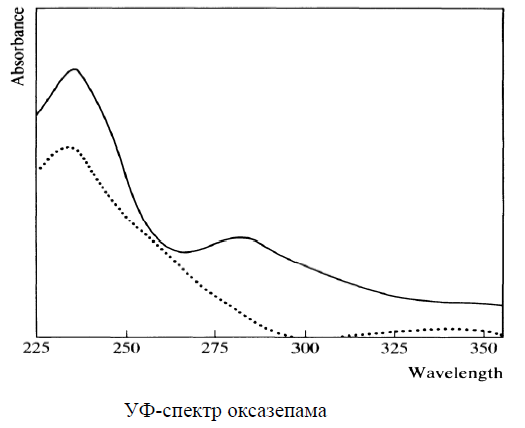 3. Газожидкостная хроматография (ГЖХ). Проводится с использованием колонок длиной 2 м и диаметром 4 мм на хромосорбе Q (80-100 меш.) с покрытием SE-30. Обнаружение бензодиазепинов и их метаболитов проводят по соответствующим индексам удерживания. Для оксазепама индекс удерживания равен 2336. 4. Высокоэффективная газожидкостная хроматография (ВЭЖХ). Обнаружение производных 1,4-бензодиазепина предложено производить по нативным соединениям или бензофенонам. При использовании жидкостного хроматографа «Милихром-А02» для оксазепама получены следующие данные хроматографического анализа методом ВЭЖХ:
Представьте процедуру пробоподготовки биообъектов, способ (способы) выделения (изолирования) токсиканта. Пробоподготовка: 1. Внутренние органы – измельчение, вымораживание, лиофилизация при низких температурах. 2. Кровь – добавление смешивающихся с водой органических растворителей (этанол, метанол, ацетонитрил, ацетон и др.). 3. Моча – проведение разрушения конъюгатов с глюкуроновой и серной кислотами (неспецифический кислотный или специфический ферментативный гидролиз). Изолирование оксазепама Биообъектами для анализа могут служить: 1) желудок и тонкий кишечник с содержимым; 2) головной мозг; 3) печень, почки; 4) кровь, моча. Производные 1,4-бенздиазепина обладают как слабоосновными (за счет гетероатома азота в положении 4), так и слабокислотными (за счет имидо-имидольной таутомерии в положении 2) свойствами и при ненаправленном анализе изолируются из биоматериала подкисленным спиртом или подкисленнной водой с хлороформной экстракцией из водной фазы рН = 10 (оксазепама). Для изолирования также можно использовать сорбционный метод на полимерных сорбентах с последующим элюированием веществ с сорбента. Полученные экстракты /элюаты упариваются до 0,5-1 мл с целью концентрирования и используются для ТСХ, УФ-спектрофотометрии, ГЖХ, ВЭЖХ и химического метода. Гидролиз оксазепама до 2-амино-5-хлорбензофенона Для проведения гидролиза могут быть использованы непосредственно ткани органов, хлороформные экстракты подкисленных вытяжек и элюаты при применении сорбционного метода. Определенный объем элюата или экстракта выпаривают досуха. К сухому остатку, навеске ткани органа, к 10 мл мочи или 2 мл крови прибавляют 2 мл 6М раствора хлороводородной кислоты. Смесь нагревают на кипящей водяной бане в течение 1 часа или в течение 5-10 мин на глицериновой (песчаной) бане при 120°С. При наличии в объекте производных 1,4-бензодиазепина раствор окрашивается в желтый цвет за счет образования бензофенонов (завершение гидролиза). Первая часть гидролизата используется для проведения цветных реакций. Вторую часть гидролизата осторожно подщелачивают 50% раствором гидроксида натрия до рН = 10-11 и экстрагируют гексаном. Гексановые экстракты выпаривают досуха при комнатной температуре, остаток растворяют в небольшом объеме этанола и исследуют с помощью ТСХ и УФ-спектрофотометрии. 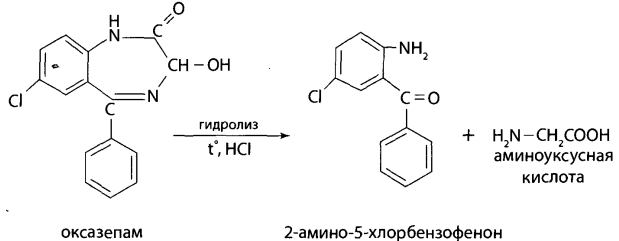 ТЕСТОВЫЙ КОНТРОЛЬ
Используемая литература:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||