Задача 21
 Скачать 203.5 Kb. Скачать 203.5 Kb.
|
|
Задача 21 вариант 2 1. Составить технологическую схему производства ацетонитрила на основе взаимодействия этилена с аммиаком. 2. Составить материальный баланс процесса. 3. Рассчитать технико-экономические показатели. В основу расчета взять следующую реакцию:
1. Составить технологическую схему производства ацетонитрила на основе взаимодействия этилена с аммиаком Смесь этан этиленовой фракции, аммиака и воздуха подают реактор с пседдрожиженным слоем висмут-фосфорно-молибденового катализатора, где при 550°С протекает реакция: Выходящие из реактора газы после охлаждения промывают водной серной кислотой для удаления аммиака. Из водного раствора отгоняют ацетонитрил. 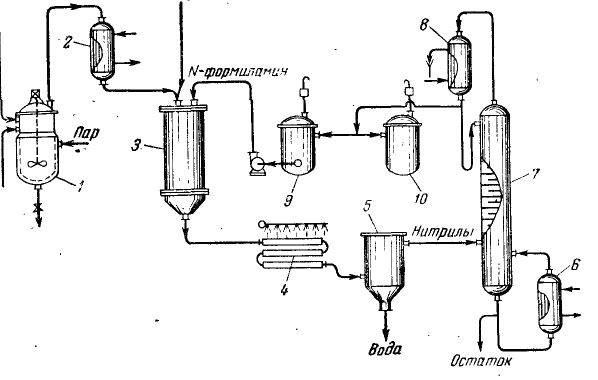 Рисунок 1 - Схема получения нитрилов из аминов: 1 - реактор для получения этилена; 2 - подогреватель; 3 - реактор для получения ацетонитрила; 4 - холодильник; 5 - разделитель; 6 - кипятильник; 7 - ректификационная колонна; 8 - дефлегматор; 9 - сборник аммиака;. 10 — сборник ацетонитрилов. Решение: Определим равновесные и фактические составы реакционной смеси: Зададимся 1 молем этилена, тогда масса этилена будет 28кг, отсюда из весового соотношения «этилен-аммиак» получаем 28*9=252кг аммиака или 252/17=14,82кмоль. Таблица 1. Равновесные и фактические составы реакционной смеси
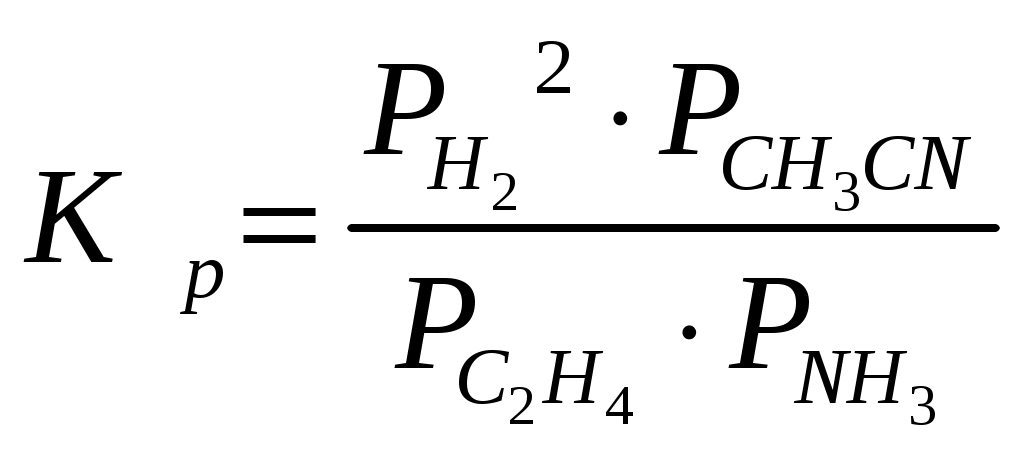 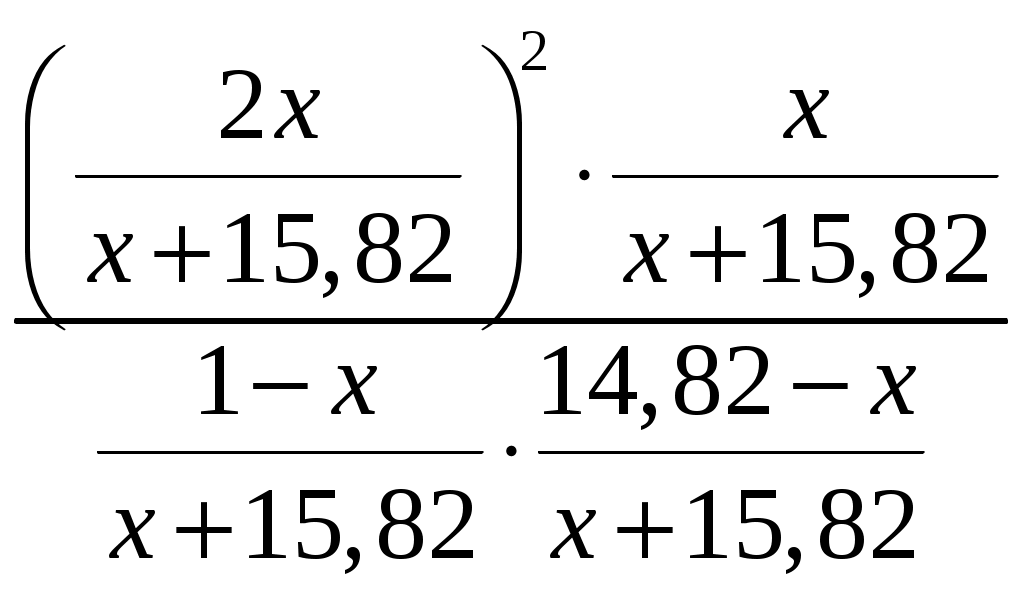 = 10 = 10Отсюда х = 0,99 х = 0,99 Производительность по ацетонитрилу: 120т/год=120000/(340*24)=14,71кг/ч Потери ацетонитрила составляют: По реакции находим количество остальных компонентов: 14,93кг/ч - х кг/ч - 14,93кг/ч - х кг/ч - 14,93кг/ч - х кг/ч - Составим пропорцию на основании данных столбцов таблицы 1: 14,93кг/ч - х кг/ч - Тогда поданного аммиака будет: 6,19+103,03=109,22кг/ч 14,93кг/ч - х кг/ч - Тогда поданного этилена будет: 10,20+1,94=12,14кг/ч Находим состав этилена: 12,14/28кмоль/ч х/30кмоль/ч отсюда х = 1,45 кг/ч, а технического этилена будет: 12,14+1,45=13,59кг/ч Таблица 2. Материальный баланс
3. Технико-экономические показатели: а) Производительность:14,71кг/ч б) Пропускная способность по этилену 12,14кг/ч. в) Выход ацетонитрила на поданный этилен: хкг/ч - 12,14 кг/ч - Gт =17,78кг/ч Выход ацетонитрила на превращенный этилен: хкг/ч - 10,20 кг/ч - Gт =14,93кг/ч г) теоретический и фактический расходные коэффициенты по сырью. теоретический: фактический: д) Конверсия этилена: Конверсия аммиака: Список использованной литературы1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. Изд. 2-е, пер. М., «Химия», 2005, 736 с. 2. Юкельсон И.И. Технология основного органического синтеза. М.: «Химия», 2008, 846 с. 3. Общая химическая технология / Под ред. А.Г.Амелина. М.: «Химия», 2007, 400 с. 4. Расчеты химико-технологических процессов / Под ред. И.П.Мухленова. Л.:Химия, 2009, 300 с. 5. С.И. Вольфкович Общая химическая технология. М.: Государственное научно-техническое издательство химической литературы. 2009, 633с. 6. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для вузов.// Под ред. Стадничука М.Д. – 5-е изд.. перераб. и доп. – СПб.: «Иван Федоров», 2002. – 624 с. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
