Задачи и решения алкани. Задача Напишите структурные формулы всех алканов с пятью атомами углерода в главной цепи, плотность паров которых по водороду равна 50. Назовите их по систематической номенклатуре. Задача 2
 Скачать 46.5 Kb. Скачать 46.5 Kb.
|
|
Задача 1. Напишите структурные формулы всех алканов с пятью атомами углерода в главной цепи, плотность паров которых по водороду равна 50. Назовите их по систематической номенклатуре. Задача 2. Углеводород имеет элементный состав: 82,76% углерода и 17,24% водорода (по массе). При хлорировании (радикальном) углеводород образует два изомерных монохлорида - первичный и третичный. Определите строение исходного углеводорода. Задача 3. Газ, образующийся при полном сгорании 0,1 моль предельного углеводорода, пропустили через избыток известковой воды, при этом выпало 60 г осадка. Определите молекулярную формулу и строение предельного углеводорода, если известно, что он содержит один четвертичный атом углерода. Задача 4. При прокаливании смеси массой 49г, состоящей из ацетата калия и избытка гидроксида калия, выделился газ, прореагировавший при освещении с парами брома. В результате последней реакции образовалось 25,3 г трибромметана. Выход трибромметана составил 50% от теоретического. Найдите массовые доли веществ в исходной смеси. Задача 5. При пропускании 11,2 л смеси метана, оксида углерода (IV) и оксида углерода (II) через раствор гидроксида натрия, взятый в избытке, объем исходной смеси уменьшился на 4,48 л (н.у.). Для полного сгорания оставшейся смеси потребовалось 6,72 л (н.у.) кислорода. Определите состав исходной смеси (в % по объему). Задача 1. Напишите структурные формулы всех алканов с пятью атомами углерода в главной цепи, плотность паров которых по водороду равна 50. Назовите их по систематической номенклатуре. Решение. Молярная масса алканов равна: M(CnH2n+2) = 2*50 = 100 г/моль, откуда n = 7. Из 7 атомов углерода 5 составляют главную цепь, а два входят в состав заместителей: двух групп -СН3 или одной группы -С2Н5. Две группы -СН3 могут находиться в следующих положениях при главной цепи: 2,2-: 2,3-: 2,4-; 3.3-.  2.2-диметилпентан 2.3-диметилпентан  2.4-диметилпентан 3.3-диметилпентан Одна группа -С2Н5 может находиться только в положении 3. В противных случаях она войдет в состав главной цепи, и длина последней будет превышать пять атомов углерода:  3-этилпентан Ответ. 5 изомеров состава С7Н16. Задача 2. Углеводород имеет элементный состав: 82,76% углерода и 17,24% водорода (по массе). При хлорировании (радикальном) углеводород образует два изомерных монохлорида - первичный и третичный. Определите строение исходного углеводорода. Решение.Пусть формула углеводорода - СхНу (М = 12x+y). Массовая доля водорода в одном моле этого вещества равна: (H) = y/(12x+y) = O,1724 откуда, y = 2,5x. Это означает, что простейшая формула углеводорода С2Н6. Ей соответствует истинная формула С4Н10. Существует два углеводорода состава С4Н10:  Бутан 2-мстилпропан Третичные атомы углерода есть только в одном из этих двух изомеров, в 2-метилпропане, поэтому только 2-метилпропан при хлорировании может образовать третичный алкилхлорид: 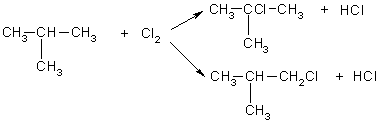 Ответ. 2-метилпропан. Задача 3. Газ, образующийся при полном сгорании 0,1 моль предельного углеводорода, пропустили через избыток известковой воды, при этом выпало 60 г осадка. Определите молекулярную формулу и строение предельного углеводорода, если известно, что он содержит один четвертичный атом углерода. Решение. При сгорании одного моля углеводорода, содержащего и атомов углерода, образуется n моль СО2: СnН2n+2 + (Зn+1)/2O2 → СO2 + (n+1)Н2О. При пропускании СО2 через известковую воду образуется карбонат кальция: Са(ОН)2 + СО2 = СаСО3↓ + Н2О. v(СаСО3) = 60/100 = 0,6 моль = v(CO2). При сгорании 0,1 моль СnН2n+2 выделилось 0,6 моль СО2, следовательно n = 6. Молекулярная формула углеводорода - С6Н14. Из пяти углеводородов состава С6Н14 четвертичный атом углерода есть только в 2,2-диметилбутане: 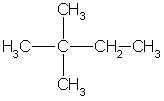 Ответ. С6Н14- 2,2-диметилбутан. Задача 4. При прокаливании смеси массой 49г, состоящей из ацетата калия и избытка гидроксида калия, выделился газ, прореагировавший при освещении с парами брома. В результате последней реакции образовалось 25,3 г трибромметана. Выход трибромметана составил 50% от теоретического. Найдите массовые доли веществ в исходной смеси. Решение. При прокаливании исходной смеси происходит реакция: СН3СООK + KОН = K2СО3 + СН4 . Выделяющийся метан реагирует при освещении с парами брома: СН4 + 3Вr2 = СНВr3 + 3НВr. M/(СНВr3) = 253 г/моль, М(СН3СООK) = 98 г/моль. Трибромметана образовалось 25,3/253 = 0,1 моль. С учетом 50%-ного выхода в реакцию бромирования вступило 0,1/0,5 = 0,2 моль метана. Следовательно, в первую реакцию вступило 0,2 моль СН3СООК (КОН - в избытке) массой 0,2•98 = 19,6 г. Массовая доля ацетата калия в исходной смеси равна: ω(СН3СООК) = 19,6/49 = 0,4, или 40%. Тогда массовая доля КОН равна 0,6 или 60%. Ответ. 40% СН3СООK, 60% KОН. Задача 5. При пропускании 11,2 л смеси метана, оксида углерода (IV) и оксида углерода (II) через раствор гидроксида натрия, взятый в избытке, объем исходной смеси уменьшился на 4,48 л (н.у.). Для полного сгорания оставшейся смеси потребовалось 6,72 л (н.у.) кислорода. Определите состав исходной смеси (в % по объему). Решение. При пропускании смеси через раствор щелочи поглощается только оксид углерода (IV): СО2 + 2NaOH = Na2CO3 + Н2О 0бъем поглощенного СО2 составляет 4,48 л. Следовательно, v(CO2) = 4,48/22,4 = 0,2 моль. После поглощения СО2 объем смеси составил 11,2-4,48 = 6,72 л, что соответствует 0,3 моль. Оставшиеся газы сгорают по уравнениям: СН4 + 2О2 = СО2 + 2Н2О, 2СО + О2 = 2СО2 . Пусть в смеси было x моль СН4 и у моль СО, тогда на сгорание СН4 израсходовано 2x моль О2, а на сгорание СО —у/2 моль O2; всего израсходовано 6,72/22,4 = 0,3 моль О2. Имеем систему: x + у = 0,32 2x + у/2 = 0,3 Отсюда x = 0,1, у = 0,2. Значит, в исходной смеси было 0,1 моль СН4 (2,24 л, или 20%), 0,2 моль СО (4,48 л. или 40%) и 0,2 моль СO2 (4,48 л или 40%). Ответ. 20% СН4, 40% СО, 40% СО2. |
