Равновесная концентрация. Задача относится к заданиям ii (повышенного)уровня сложности
 Скачать 7.21 Mb. Скачать 7.21 Mb.
|
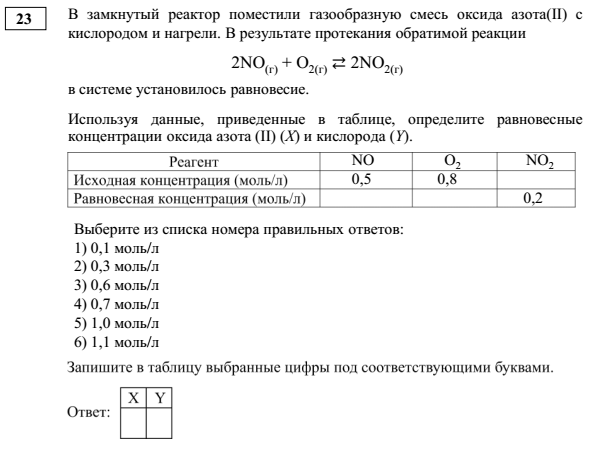 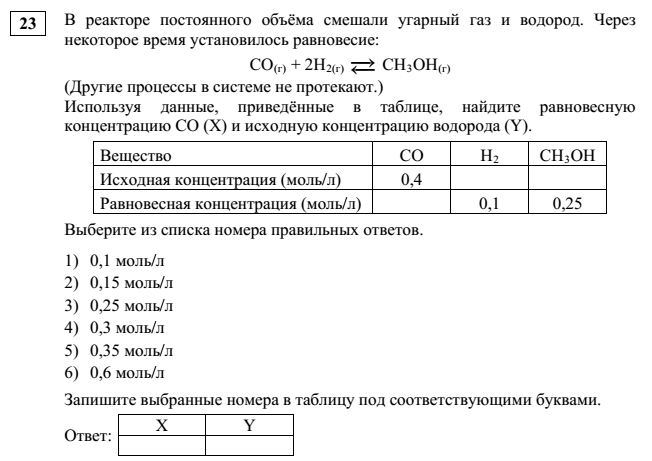 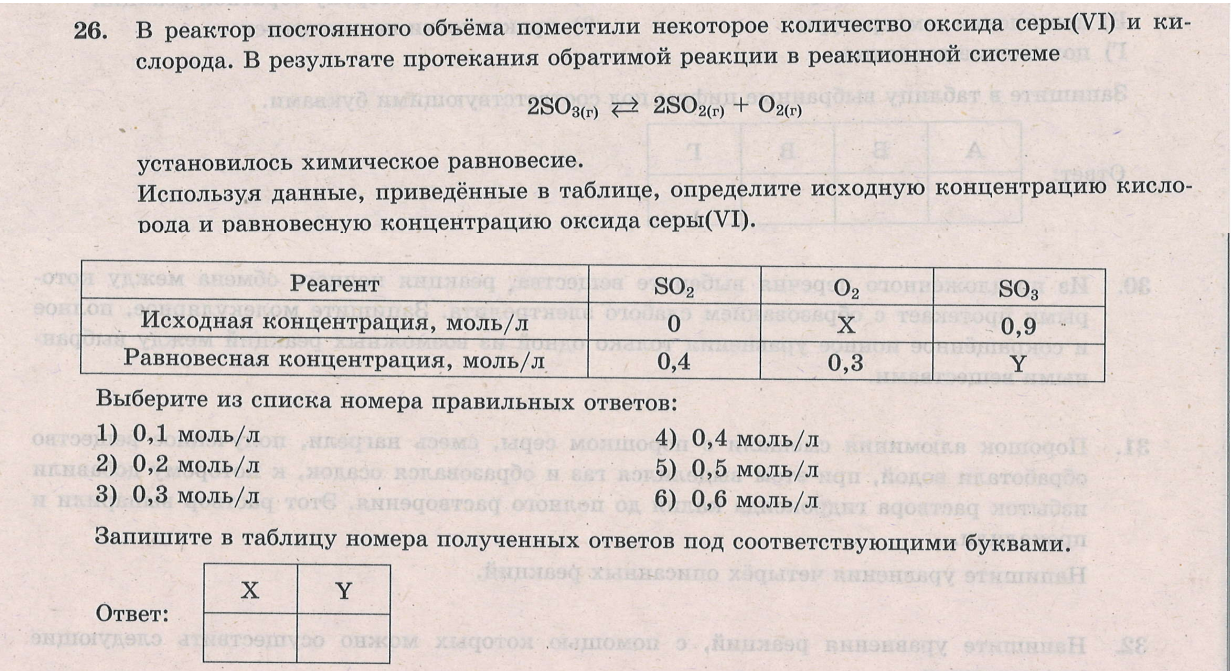    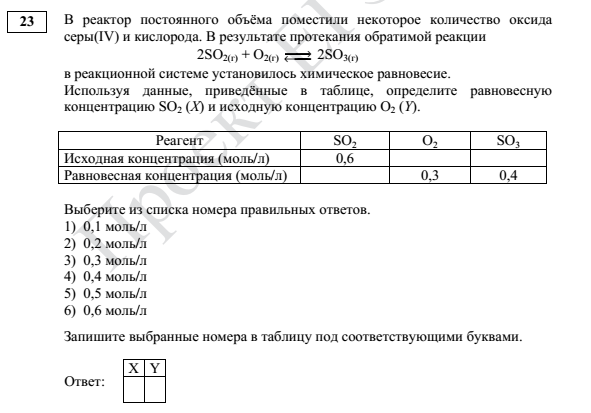 Задача относится к заданиям II (повышенного)уровня сложности, т.е (из спецификации КИМ ЕГЭ-2022):  Этап 1: подготовка. а) В установлении исходных концентраций на основании анализа текста ( и необходимых расчетов). Данное действие осуществляется по мере необходимости. б)В нахождении "известного" вещества - по которому будут производиться стехиометрические расчеты. Этап 2: Стехиометрические расчеты по уравнению реакции: На основании изменения концентрации известного вещества определяют изменение концентраций неизвестных веществ Этап 3.Нахождение неизвестных концентраций. Ориентиром здесь является то, что у исходных реагентов в ходе реакции происходит уменьшение концентрации, а у продуктов - увеличение. Ниже рассмотрено несколько примеров 23 задачи разного уровня сложности, в конце статьи приведена ссылка на видеоразбор этих примеров. Рекомендую познакомиться с видеоразбором. Несмотря на ряд его недочетов (начиная с 17 минуты), в целом он позволяет лучше понять ход решения 23 задачи.  Этап 1. а)Из анализа текста следует, что изначально в реакторе не было NO2, т.е исх. концентрация NO2=0: б)известное вещество (у которого известны исходная и равновесная концентрации)- NO2. Его образовалось 0,2 моль Этап 2. Стехиометрические расчеты: 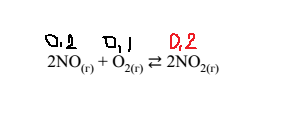 Из уравнения реакции следует, что прореагировало 0,2 моль NO и 0,1 моль О2. 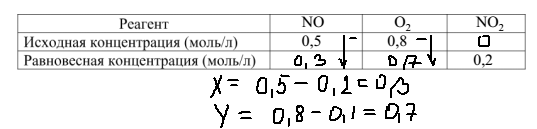 ответы - 2,4. Разбор всех последующих примеров будет происходить непосредственно на тексте задания:  Решение:  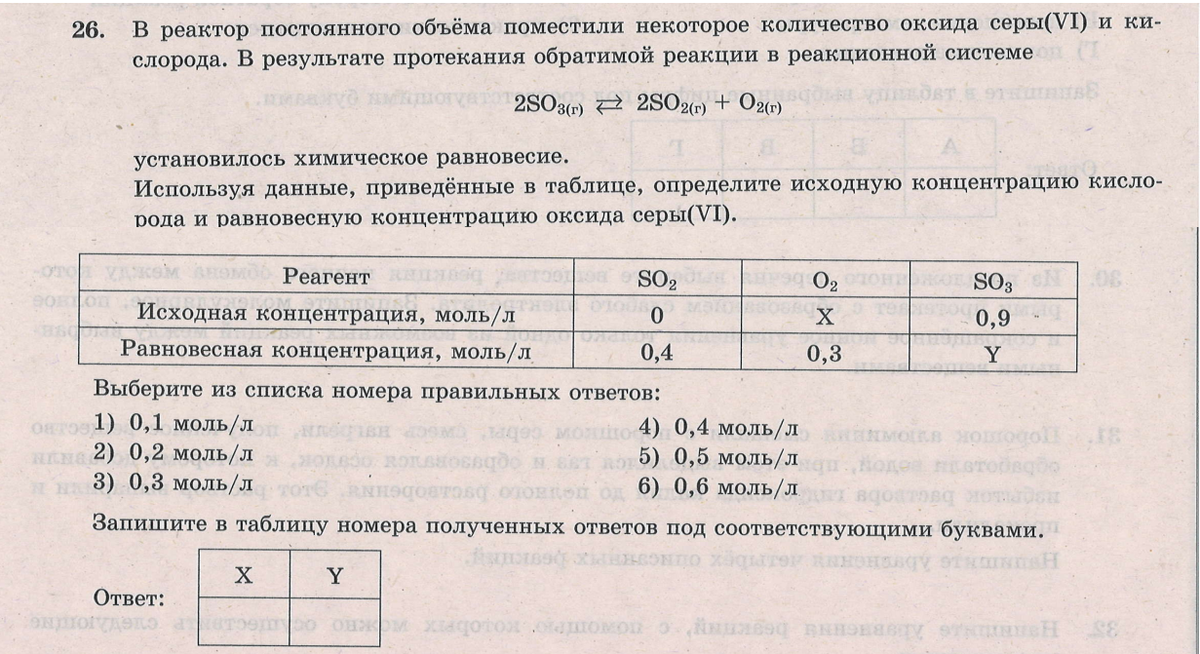 Решение: 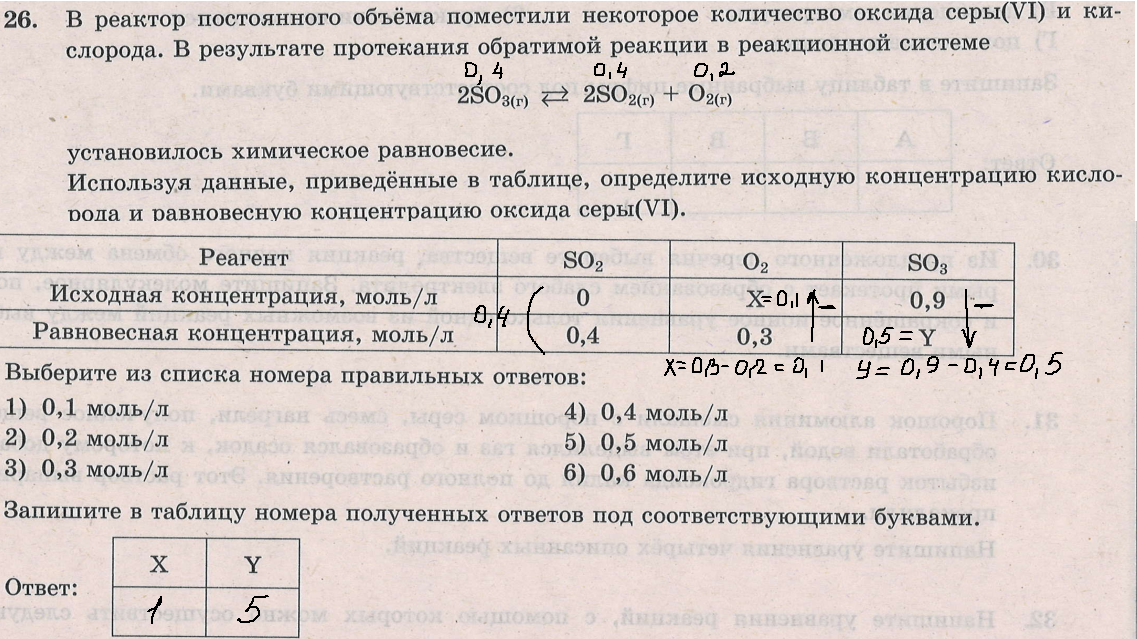  Особенность этой задачи в том, что по факту протекает обратная реакция (разложение диоксида азота). Т.е., NO2 - является исходным веществом, а NO - продуктом). Решение:   Решение. Особенность этой задачи в том, что в начале решения необходимо найти молярную концентрацию водорода: См(Н2)=n(H2)/V=8/(2*10)=0,4 моль/л   Особенности этой задачи: а)Необходимо перевести числовую информацию в молярные концентрации: Сравновесн(NH3)=5/5=1 моль/л. Т.е. NH3 расходуется, т.е. является исходным веществом. б) напишем уравнение реакции: 2NH3=N2+3H2 и далее - решение по алгоритму с учетом мольного соотношения исходных концентраций продуктов (водорода и азота).  Ниже приведена ссылка на видеоразборы всех примеров. Начиная с 17 минуты есть погрешности, к которым я отнеслась "философически" и исправила в ходе дальнейшего разбора: https://youtu.be/Q-34Eypgw6Y |
