Решение. Решение Основы инженерной защиты окружающей среды. Задача Расчет отстойника Рассчитать отстойник для сгущения водной суспензии
 Скачать 66.58 Kb. Скачать 66.58 Kb.
|
|
КОНТРОЛЬНАЯ РАБОТА Вариант №______ Задача 1. Расчет отстойника Рассчитать отстойник для сгущения водной суспензии: расход суспензии равен (Gсм), содержание твердых частиц – 6500 кг/ч в суспензии (хсм) – 0,2 кг/кг. в осадке (хос) – 0,5 кг/кг. в осветленной жидкости (хосв) – 0,0001 кг/кг. Частицы суспензии имеют шарообразную форму. Минимальный размер удаляемых частиц (dТ) – 30 мкм. Плотность частиц составила (ρТ) 2675, а вязкость жидкости равна (μж) – 0,001519 Па с. Решение Определим значение критерия Архимеда (Ar) по следующей формуле:  где dТ – диаметр частицы, м; ρж – плотность чистой жидкости, кг/м3; g – скорость свободного падения, м/с; ρТ – плотность твердых частиц, кг/м3; ρж – плотность чистой жидкости, кг/м3; μж – вязкость жидкости, Па.  Исходя из того, что Ar < 36, рассчитываем число Рейнольдса при осаждении частицы (Re) по следующей формуле: Для ламинарного режима 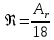 где  – критерия Архимеда – критерия Архимеда По значению критерия Рейнольдса скорость свободного осаждения шарообразных частиц woc (м/с) составит по формуле:  где μж – вязкость жидкости, Па. Re – число Рейнольдса при осаждении частицы; dТ – диаметр частицы, м; ρж – плотность чистой жидкости, кг/м3. 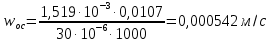 Найдем плотность суспензии ρсм (кг/м3) по формуле:  где хсм – содержание твердых частиц: в суспензии, кг/м; ρТ – плотность твердых частиц, кг/м3; ρж – плотность чистой жидкости, кг/м3.  Определим значение объемной доли жидкости в суспензии ε по формуле:  где хсм – содержание твердых частиц: в суспензии, кг/м; ρсм – плотность суспензии, кг/м3; ρТ – плотность твердых частиц, кг/м3.  Исходя из того, что ε 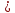 0,7, для расчета скорости стесненного осаждения wст (м/с) применяем формулу: 0,7, для расчета скорости стесненного осаждения wст (м/с) применяем формулу: 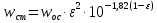 где ε – объемная доля жидкости в суспензии; woc – скорость свободного осаждения шарообразных частиц, м/с. 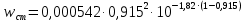 =0,000318 м/с =0,000318 м/сЗатем находим поверхность осаждения F (м2), принимая К3 = 1,3 и считая, что плотность осветленной жидкости равна плотности чистой воды по формуле: 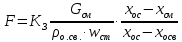 где Gсм – массовый расход сходной суспензии, кг/с; К3 – коэффициент запаса поверхности 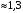 ; ;ρосв – плотность осветленной жидкости, 1000 кг/м3; wст – скорость осаждения частиц суспензии, м/с; хсм – содержание твердых частиц: в суспензии, кг/м. хос – содержание твердых частиц: в осадке, кг/м. хосв – содержание твердых частиц: в осветлённой жидкости, кг/м.  м2 м2Ответ. По приведенным данным выбираем отстойник, имеющий поверхность 4,43 м2. Задача 2. Расчет ХПК сточной водыРассчитайте ХПК сточной воды состав которой приведен ниже Сульфанол сульфат натрия нитратный иона фенол хлорид натрия 160 60 50 11 360 Решение Составим уравнение горения каждого вещества и определим необходимое количество кислорода для сжигания веществ: C6H4NaO3S + 2O2 → C6H4NaO4 + SO3 Молярная масса (C6H4NaO3S) равна 179 г/моль. Для 179 г C6H4NaO3S требуется 64 г O2 160 г Na2SO4 → х2 O2 х2 = 160*64/179 = 57 г Na2SO4 + 2O2 → 2NaO2 + SO4 Молярная масса (Na2SO4) равна 142 г/моль. Для 142 г Na2SO4 требуется 64 г O2 60 г Na2SO4 → х2 O2 х2 = 60*64/142 = 27 г 2NO3 + O2 → 2NO4 Молярная масса (NO3) равна 62 г/моль. Для 62 г NO3 требуется 32 г O2 50 г NO3 → х2 O2 х2 = 50*32/62 = 26 г C6H5OН + 7O2 → 6СО4 + 3Н2О Молярная масса (C6H5OН) равна 94 г/моль. Для 94 г C6H5OН требуется 224 г O2 11 г C6H5OН → х2 O2 х2 = 11*224/94 = 26 г NaCl+ O2 → NaClО2 Молярная масса (NaCl) равна 58 г/моль. Для 58 г NaCl требуется 32 г O2 360 г NaCl → х2 O2 х2 = 360*32/58 = 199 г ХПКобщ. = 57 + 27 + 26 + 26 + 199 = 335 мг/дм3. Ответ. ХПК сточной воды составляет 335 мг/дм3 Задача 3. Определение массы влажного шлама Определите массу влажного шлама, выделенного из воды объемом V, если содержание взвешенных веществ в исходной воде – x, степень осаждения –y 85 %, а влажность шлама – wисх. После уплотнения влажность шлама уменьшается до wкон. V, м 3 x, мг/дм3 y, % wисх, % wкон, % 1 250 1625 82 96 90 Решение Определяем массу влажного шлама, выделенного из воды после осаждения: 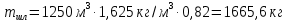 При учете влажности шлама 96 % его общая масса составит:  После уплотнения масса шлама составит: 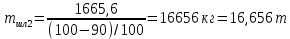 Ответ. Таким образом, масса влажного шлама, выделенного из воды объемом 1250 м3, если содержание взвешенных веществ в исходной воде 1625 мг/дм3 составит  кг, при степени осаждения 82%. С учетом влажности шлама wисх=96% общая масса шлама составила 55,521 т. После уплотнения влажность шлама уменьшилась до wкон=90 %, а масса составила 16,656 т. Обезвоживанние шлама с 96 % до 90 % приводит к сокращению его массы, предназначенной для вывоза на захоронение в 3,3 раза. кг, при степени осаждения 82%. С учетом влажности шлама wисх=96% общая масса шлама составила 55,521 т. После уплотнения влажность шлама уменьшилась до wкон=90 %, а масса составила 16,656 т. Обезвоживанние шлама с 96 % до 90 % приводит к сокращению его массы, предназначенной для вывоза на захоронение в 3,3 раза.Задача 4. Определение рН среды после гидролиза коагулянтаВ исходную сточную воду с pH = А для осаждения взвешенных веществ вводят коагулянт — гидроксохлорид алюминия в дозах С по Al2O3. Определите pH среды после гидролиза коагулянта.А С, мг/дм3 9,6 150 Решение Гидролиз протекает по реакции: Al2O3 + CO3-2-= 2AlO2- + CO2 Молярная масса (Al2O3) равна 102 г/моль Для нейтрализации ионов CO3-2 требуется 2 моль Al2O3, т. е. 204 г Al2O3. Найдем содержание CO3-2 в сточной воде исходя из значения рН=9,6. Т. к. рН = −lg(CO3-2+) и концентрация CO3-2 в этом уравнении выражается в моль/дм3, то можно определить концентрацию CO3-2, которая будет равна CCO3-2 =10-4 моль/дм3 или 10-4 г/дм3. По условию задачи объем сточной воды измеряется в кубометрах (м3), поэтому необходимо привести ее соответствие единицы измерения, в результате содержание CO3-2 в исходной воде будет равно 10–1 моль/м3. Для гидролиза такого количества ионов CO3-2 потребуется 204 * 0,1 = 20,4 г Al2O3, а так как гидроксохлорид алюминия – это коагулянт Al2O3 в воде с содержанием 0,150 г/дм3, то необходимый расход составит: Vизв.м = 20,4 * 2/0,150 = 272 дм3 Ответ. Расход известкового молока составляет 272 дм3 Задача 5. Расчет рН среды усредненного стокаВ усреднитель поступает Х сточной воды с pH = А. В него же подают второй поток сточной воды с расходом Y с pH = B. Рассчитайте pH среды усредненного стока. А Х, м 3 /ч Y м 3 /ч B 10,5 17 5 4,0 Решение Обозначим объемы сточной воды V1 и V2 соответственно. Поскольку смешивается кислая и щелочная сточные воды (т.е. рН1 7 и рН2 7, то конечную концентрацию раствора рассчитывают по веществу, взятому в избытке. При избытке щелочи проводим расчет: [ОH-]3 = 10-(14-pH1) * V1 – 10-pH2 * V2/(V1 + V2) [ОH-]3 = 10-3,5 * 17 – 10-4 * 5/(17 + 5) = 0,00022 Вычислим pH3 = 14 + lg[ОH-]3= 14 + lg(0,00022) = 10,34 Ответ. Таким образом, pH среды усредненного стока составляет 10,34. Задача 6. Определение ХПК исходной сточной воды и воды после фотохимического реактораОпределите ХПК исходной сточной воды и воды после фотохимического реактора, если на очистку подают сточную воду с расходом Q, содержащей фенол в количестве Сфенол и пропанол в количестве Спроп. Для деструкции примесей вводят 1 г/дм3 пероксида водорода в виде 10%-го раствора. Весь пероксид водорода расходуется на деструкцию органических примесей, в первую очередь происходит деструкция фенола. Q, м 3 /ч Сфенол, мг/дм3 Спроп, мг/дм3 11 19 170 Решение Минерализация органических примесей воды протекает по реакциям: C6H5OН+ Н2О2 = C6H4(OН)2 + Н2О С3Н7ОН + Н2О2 = C3H6(OН)2 + Н2О Для полной минерализации фенола (молярная масса 94) и пропанола (молярная масса 60) по вышеприведенным уравнениям требуется пероксида водорода:  г г г гОтвет. ХПКобщ. составит 103 мг/дм3. Задача 7. Расчет материального баланса процесса очистки сточных водРассчитайте материальный баланс процесса очистки сточных вод в количестве Q. В сточных водах содержится Х мг/дм3 взвешенных веществ, Y сульфида натрия. Для полного осаждения сульфидов вводят раствор Fe2(SO4)3 с концентрацией С и дополнительно Z сульфата железа в качестве коагулянта для полного осаждения взвешенных веществ. Образующуюся серную кислоту нейтрализуют известковым молоком (10 г/дм3 Ca(OH)2). Оседающий шлам имеет влажность W. Степень выделения взвешенных веществ 96 %, сульфидов — до остаточной концентрации 0,2 мг/дм3, а содержание гипса в очищенной воде 0,2 % масс. Q, м 3 /ч X, мг/дм3 Y, мг/дм3 С, % Z, мг/дм3 W, % 14 630 100 15 155 97,8 Решение Масса потока – 14 000 кг/ч. В нем содержится: взвешенных веществ – 6,3 кг; Na2S – 1 кг; Ca(OH)2 – 100 кг; Fe2(SO4)3 – 1,55 кг; Для осаждения взвешенных веществ вводится 0,15 * 14 = 2,1 кг твердого коагулянта или 14 кг раствора, Коагулянт гидролизуется по реакции Fe2(SO4)3 + 6H2O = 2Fe(OH)3 + 3H2SO4, при этом выделяется гидроксид железа  г гобразуется H2SO4  Серная кислота может расходоваться на взаимодействие со взвешенными частицами Ca(OH)2 по реакции Ca(OH)2 + H2SO4 = CaSO4 + 2H2O. Масса растворившегося гидроксида кальция составляет 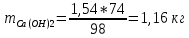 Остается в нерастворимом виде 100 – 1,16 = 98,84 кг. Практически полностью происходит осаждение гидроксида железа Fe2(SO4)3 + 6H2O = 2Fe(OH)3 + 3H2SO4, Причем выделяющаяся при осаждении серная кислота взаимодействует с Ca(OH)2 с образованием практически нерастворимого гипса CaSO4·2H2O. Согласно экспериментальным данным, степень перехода железа в осадок достигает 97,8 %. Рассчитываем количество образующихся Fe(OH)3 и H2SO4   По реакции Ca(OH)2 + H2SO4 = CaSO4 * 2H2O. образуется гипса  расходуется Ca(OH)2  Остается в виде Ca(OH)2 – (98,84 – 0,83) = 98,01 кг. Так как в системе остаются еще взвешенные вещества в виде Ca(OH)2, то дополнительного введения подщелачивающих реагентов не требуется. Учитывая степень осаждения взвешенных веществ, рассчитываем массу взвешенных, переходящих в шлам: [1 + 2,1 + 98,01 (остаток нерастворенной Ca(OH)2)]×0,96 = 97,07 кг В осветленной воде остается взвешенных веществ 100 – 97,07 = 2,93 кг. В шлам переходит Fe(OH)3 – 1,12 кг, Fe(OH)3 – 0,81 кг, CaSO4·2H2O – 1,93 кг. m 1,12 0,81 1,93 3,86 кг. Составляем таблицу материального баланса
Задача 8. Расчет материального баланса процесса очистки сточных водРассчитайте экобаланс производства хлора для обеззараживания воды расход которой составил Q, если вводят дозу хлора X. Хлор производят методом электролиза раствора поваренной соли с концентрацией 300 г/дм3. Плотность раствора 1,17 кг/дм3. Степень разложения соли – Y. Частично хлор растворяется в конечном растворе с образованием гипохлорита натрия, его концентрация – C. Q, м 3 /ч X, мг/м3 Y, % С, г/дм3 215 000 23 55 0,9 Решение Процесс электрохимического синтеза Cl2 протекает по реакции 2NaCl + 2H2O → Cl2 + H2 + 2NaOH, а образование побочного продукта по реакции: Cl2 + 2NaOH = NaCl + NaClO + H2O. Для получения 500 м3 Cl2 по первой реакции расходуется NaCl (молярная масса 58,5) в количестве:  При учете степени разложения NaCl 55 % требующаяся масса соли составляет:  Объем раствора:  а его масса m= 15,83  1170 = 18518,67 кг. 1170 = 18518,67 кг. Согласно реакции, образуется одинаковый объем водорода (считаем по хлору) – 500 м3, а также NaOH (молярная масса 40):  В растворе остаются неразложившиеся соли 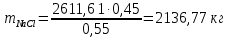 На образование Cl2, H2 и NaOH расходуется воды  Таким образом, в реактор приходит 18518,67 кг раствора NaCl. За счет реакции в газовую фазу выделяется 500 м3 H2  После реакции (без учета образования побочных продуктов) остается жидкой фазы 16889,21 кг. Считаем, что плотность раствора не изменяется, тогда объем раствора составляет 14,44 м3. Так как в растворе содержится 0,9 г/дм3 NaClO, то его количество составляет 14,44 · 0,9 = 12,99 кг. Для образования такого количества NaClO (молярная масса 74,5) по второй реакции расходуется хлор в количестве  и NaOH в количестве  при этом регенерируется NaCl  Масса оставшейся в жидкой фазе NaOH составляет 1785,71 – 13,95 = 1771,76 кг, NaCl – 2136,77 + 10,20 = 2146,97 кг. За счет образования побочного продукта NaCl объем выделяющегося Cl2 уменьшается с 500 м3 до (500 – 3,91) = 496,09 м3, т. е. от требующегося объема образуется только 99,22 %. Если обеспечивать требующуюся производительность по Cl2, то надо увеличить расходы компонентов на 0,78%. Сведем результаты расчетов в таблицу. Таблица. Материальный баланс производства
Задача 9. Расчет материального баланса процесса очистки от нефтепродуктовНа очистку от нефтепродуктов поступают сточные воды, содержащие 80 мг/дм3 нефтепродуктов, причем 15 мг/дм3 растворенные, а остальные эмульгированные. pH стока 6,5. Очистку проводят реагентной напорной флотацией, а в качестве коагулянта используют 10 %-й раствор сульфата алюминия в дозах 70 мг/дм3 по оксиду. Для нейтрализации кислоты используют 10 %-й раствор кальцинированной соды. Степень выделения эмульгированных нефтепродуктов – X, растворенных – Y. Влажность флотопены – 95 %. Рассчитайте материальный баланс процесса, если объем сточной воды Q, а расход воздуха – 1,5 м 3 /м3 воды. Q, м 3 /ч X, % Y, % 215 99,5 98,5 Решение При введениие в воду 70 мг/дм3 коагулянта по реакции гидролиза: Al2(SO4)3 + 6H2O = 2Al(OH)3 + 3H2SO4 образуется гидроксид алюминия в количестве m(2Al(OH)3) = 2 * 78 * 70 * 215/115 = 20 416 г Выделяется H2SO4 m(H2SO4) = 3 * 98 * 70 * 215/115 = 38 476 г Для нейтрализации H2SO4 (поддержания pH = 6,5) используется раствор соды H2SO4 + Na2CO3 = Na2SO4 + H2CO3. Всего требуется Na2CO3 m(Na2CO3) = 106 * 38 476/98 = 41 617 г или 10%-го раствора 41,617/0,1 = 416,17 кг. Расход 10%-го раствора коагулянта составит 0,07кг/м3 * 215 м3/0,1 = 150,5 кг. Согласно условию задачи с флотопеной уходит: - растворенные нефтепродукты – 0,015 кг/м3 * 215 м3 * 0,995 = 3,2 кг; - эмульгированные нефтепродукты – 0,065 кг/м3 * 215 м3 * 0,985 = 13,77 кг Всего твердой фазы во флотошламе 37,386 кг. С учетом влажности флотопены (95 %) ее масса составит 37,386/0,05 = 747,72 кг. В осветленной воде остается - растворенные нефтепродукты – 0,015 кг/м3 * 215 м3 * 0,055 = 0,016 кг; - эмульгированные нефтепродукты – 0,065 кг/м3 * 215 м3 * 0,015 = 0,21 кг Составляем таблицу материального баланса флотатора
Список литературы1. Ветошкин А. Г. Процессы инженерной защиты окружающей среды. / А. Г. Ветошкин. – Пенза: Изд-во Пенз. гос. ун-та, 2005. 2. Гребенников, С. Ф. Физическая и коллоидная химия процессов защиты и реабилитации объектов окружающей среды / С. Ф. Гребенников, Л. М. Молод-кина, М. Ю. Андрианова. – СПб.: СПГУТД, 2010. – 421 с. 3. Панов, В. П. Инженерная защита окружающей среды / В. П. Панов, Н. Ю. Бусыгин. – М.: Издательский центр «Академия», 2014. – 304 с. 4. Родионов А. И. Защита биосферы от промышленных выбросов. Основы проектирования технологических процессов / А. И. Родионов, Ю. П. Кузнецов, Г. С. Соловьев. – М.: Химия, КолосС, 2005. – 392 с. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
