Практ.Химия. Задача2. Задача 3 Задача 4 Задача Задача 6. Задача 7
 Скачать 478.32 Kb. Скачать 478.32 Kb.
|
|
Кузнецова Лидия. Гр.СТРб-2103а Практическая работа. Задача№2.  Задача №3  Задача №4  Задача 5.  Задача №6.  Задача №7. 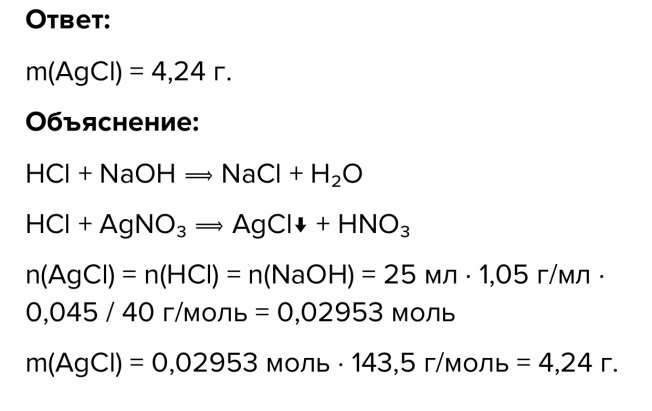 Задача №8. Дано: Сн(Na2CO3) = 0,018н α=80% = 0,8 Найти: t (крист) -? Решение: Так как плостность раствора равна 1 г/мл, то раствор объемом 1 л имеет массу 1000г Диссоциация соли дает три иона : Na2CO3⇔2Na⁺ + CO3²⁻ , значит k = 3 Изотонический коэффициент находим по формуле: i = 1+ α(k-1) = 1+0,8*(3-1) = 2,6 Понижение температуры кристаллизации равно Δt = i*K*Cm М(Na2CO3) = 106 г/моль, Мэ(Na2CO3) = 106/2 = 53 г/моль, n = m/M n(Na2CO3) = (Мэ * Сн * V)/M = (53 * 0,018 * 1л)/106 = 0,009 моль Моляльная концентрация раствора будет равняться примерно Cm(Na2CO3) = 0,009 моль/1 кг H2O (если составить пропорцию, с учётом, что 0,009 моль находится в 1000 - 0,009*106 = 999,046 г воды, то результат такой же) Криоскопическая постоянная для воды К(H2O)= 1,86 Δt = 2,6 * 1,86 * 0,009 = 0,0435°С t(крист)(H2O)= 0°C t(крист) раствора = 0-0,0435 = -0,0435°С Ответ: -0,0435°С Задача №9. Запишем уравнение окислительно-восстановительной реакции, определим степени окисления иода: KI-1 + KI+5O3 + H2SO4 → I20 + K2SO4 + H2O В этой реакции KIO3 является окислителем, он восстанавливается до молекулярного иода. KI является восстановителем, он окисляется до I20. Для расстановки коэффициентов в уравнении воспользуемся методом электронного баланса: 2 I-1 – 2е- → I20 5 2 I+5+ 10е– → I20 1 Расставим коэффициенты при окислителе и восстановителе, а остальные определим методом подбора. 10KI + 2KIO3 + 6H2SO4 = 7I2 + 6K2SO4 + 6H2O Из уравнения реакции видно, что окислитель и восстановитель реагируют в молярном отношении 1:5. Число молей окислителя равно 0,075*0,90 = 0,0675. Тогда число молей восстановителя равно 5*0,0675 = 0,3375. Молярная масса KI равна 166,0 г/моль. Тогда масса восстановителя, необходимая для взаимодействия с окислителем, равна 0,3375*166,0 = 56,0 г. Ответ: 56,0 г. Задача №10 Принимаем стандартную температуру (25 град. С) , тогда потенциал водородного электрода будет равен Е=-0,059рН рН в 0,002 М растворе рассчитывается по формуле рН=(-lgК-lgC)/2=(4,75-lg0,002)/2=(4,75+2,7)/2=3,725 E=-0,059*3,725=-0,219 Задача №11.  |
