Задачи для подготовки к экзамену по дисциплине. Задачи для подготовки к экзамену по
 Скачать 333.47 Kb. Скачать 333.47 Kb.
|
|
Задачи для подготовки к экзамену по дисциплине «Химическая термодинамика и кинетика» Три моля идеального одноатомного газа (CV = 3.0 кал/(моль. К)), находящегося при T1 = 350 K и P1 = 5 атм, обратимо и адиабатически расширяются до давления P2 = 1 атм. Рассчитайте конечные температуру и объем, а также совершенную работу и изменение внутренней энергии и энтальпии в этом процессе. Система содержит 0.5 моль идеального одноатомного газа (CV = 3.0 кал/(моль. К)) при P1 = 10 атм и V1 = 1 л. Газ расширяется обратимо и адиабатически до давления P2 = 1 атм. Рассчитайте начальную и конечную температуру, конечный объем, совершенную работу, а также изменение внутренней энергии и энтальпии в этом процессе. Рассчитайте эти величины для соответствующего изотермического процесса. Один моль метана, взятый при 25 оС и 1 атм, нагрет при постоянном давлении до удвоения объема. Мольная теплоемкость метана дается выражением: Cp= 5.34 + 0.0115. Tкал/(моль. К). Рассчитайте мольную энтропию неона при температуре 500 К, если при 298 К и том же объеме энтропия неона равна 146.2 Дж·моль-1·К-1. Напишем формулы для мольной энтропии для двух указанных состояний: S1 = S0 + Cv*lnT1 + R*lnV S2 = S0 + Cv*lnT2 + R*lnV, где Cv = 3R/2 - теплоемкость неона при постоянном объеме. Вычтем из второго уравнения первое и получим формулу для S2: S2 = S1 + Cv*ln(T2/T1) = 146,2 + 1,5*8,31*ln(500/298) = 152,65. Рассчитайте изменение энтропии при нагревании 11,2 л азота от 0 до 500С и одновременном уменьшении давления от 1 атм до 0,01 атм.  Один моль гелия при температуре 1000С и давлении 1 атм смешивают с 0,5 моль неона при 00С и 1 атм. Определите изменение энтропии, если конечное давление равно 1 атм. Исходые концентрации оксида углерода (II) и паров воды равны и составляют 0,03 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2 в системе СО + Н2О ↔СО2 + Н2 если равновесная концентрация СО2 оказалась равной 0,01 моль/л. Вычислите константу равновесия.  При некоторой температуре равновесные концентрации в сиситеме 2SO2 + O2 ↔ 2SO3 составляли соотвественно [SO2]=0,04 моль/л, [O2] = 0,06 моль/л, [SO3] = 0,02 моль/л. Вычислите константу равновесия и исходные концентрации оксида серы (IV) и кислорода. В ТЕТРАДЕ ЛЕКЦИОННОЙ. Вычислите константу равновесия системы COCl2 ↔ CO + Cl2 если при некоторой температуре равновесные концентрации оксида углерода (II) и хлора равны соответсвенно и составляют 0,001 моль/л, а [COCl2] = 4,65∙10-5 моль/л. В ТЕТРАДЕ ЛЕКЦИОННОЙ. Исходная концентрация оксида углерода (II) и хлора в системе 2NO + Cl2 ↔ 2 NOCl составляют соответственно 0,5 М и 0,2 М. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20 % оксида азота (II) .  Вычислите ∆G0 образования CH4, C2H4, NH3 исходя из значений ∆Н0обр и измененеия энтропии ∆S0. Вычислите ∆G0 следующих реакций и определите в каком направлении они будут протекать, если вещества взяты при нормальных условиях: а) 2N2O + O2 ↔ 4NO б) N2O + NO ↔ NO2 +N2 в) N2O + NO2 ↔ 3NO Вычислите ∆G0 следующих реакций и определите в каком направлении они будут протекать, если вещества взяты при нормальных условиях: а) 4HCl + O2 ↔ 2Cl2 +2H2O(г) б) H2 + Se(г) ↔ H2Se(г) в) 2HF + O3 ↔ H2O(г) +F2 +O2 . Какие из перечисленных оксидов можно восстановить водородом: Li2O; CuO; MnO; PbO ? В параллельных реакциях первого порядка 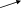 k1 B k1 B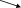 A Ak2 D выход вещества B равен 53%, а время превращения A на 1/3 равно 40 с. Найдите k1 и k2.  Реакция разложения вещества A может протекать параллельно по трем направлениям: 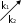 B B 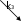 A C A CD Концентрация продуктов в смеси через 5 мин после начала реакции были равны: [B] = 3.2 моль*л-1, [С] = 1.8 моль*л-1, [D] = 4.0 моль*л-1. Определите константы скорости k1 – k3? если период полураспада вещества A равен 10 мин. Для обратимой реакции первого порядка Ak1 B k2 Kравн = 10, а k1 = 0,2 c-1. Вычислите время, при котором концентрации веществ A и B станут равными, если начальная концентрация вещества B равна 0.  Определите, какие реакции представлены на этих рисунках: Рисунки кинетики сложных реакций 1A1 2 A2 r1 3 A3 4 A4 r2 бимолекулярная обратимая двухстороняя реакция k1 B   A Ak2 D паролельная Ak1 Bk2 C последовательная Вычислите равновесные концентрации в системе 2NO + O2 ↔ 2NO2 если исходные концентрации NO и O2 соответственно равны 0,01 и 0,005 моль/л. Сколько молей H2 необходимо ввести на каждый моль I2, чтобы в образовавшейся системе с константой равновесия К = 40 H2 + I2↔2HI 50% иода превратилось в HI. 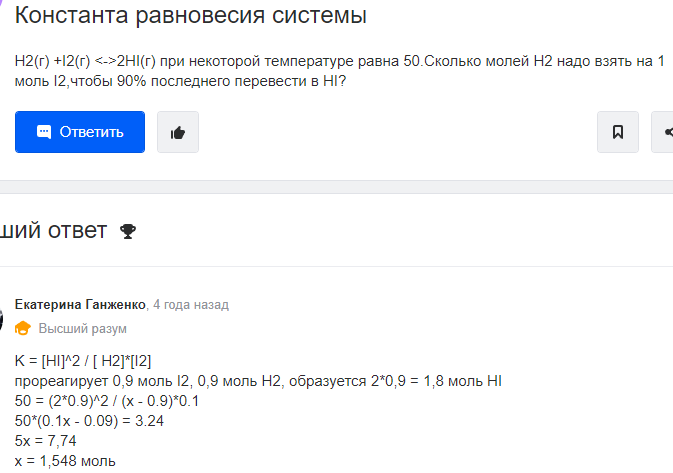 Какое количество теплоты необходимо для повышения температуры 16 г кислорода от 300 до 500 К при давлении 1 атм? Как при этом изменится внутренняя энергия?  Рассчитайте изменение энтальпии кислорода (идеальный газ) при изобарном расширении от 80 до 200 л при нормальном атмосферном давлении. Дано: V₁ = 80 л = 80·10⁻³ м³ V₂ = 200 л = 80·10⁻³ м³ i = 5 - число степеней свободы молекулярного кислорода p = const = 1·10⁵ Па ______________________ ΔН - ? Изменение энтальпии: ΔH = ΔU + p·ΔV Найдем: p·ΔV = 1·10⁵·(200-80)1·10⁻³ = 12 000 Дж Изменение внутренней энергии при постоянном давлении: ΔU = (i/2)·ν·R·ΔT Дважды запишем уравнение Клапейрона-Менделеева: p·V₁ = ν·R·T₁ (1) p·V₂ = ν·R·T₂ (2) Вычтем из второго уравнения первое: p·ΔV = ν·R·ΔT Тогда: ΔU = (i/2)·ν·R·ΔT = (i/2)·p·ΔV ΔU = (5/2)·12000 = 30 000 Дж Окончательно: ΔH = ΔU + p·ΔV = 30 000 + 12 000 = 42 000 Дж или 42 кДж В системе протекают две параллельные реакции: А + В → продукты (k1), А + С → продукты (k2). Отношение k1/k2 = 7. Начальные концентрации веществ В и С одинаковы. К моменту времени t прореагировало 50% вещества В. Какая часть вещества С прореагировала к этому моменту? 
Напишите кинетическое уравнение реакции. |
