ршр 1. теория горения №5. Задание 1 Номер
 Скачать 343.5 Kb. Скачать 343.5 Kb.
|
|
Задание № 1 Номер варианта 5 Рассчитать объем и массу окислительной среды, необходимые для горения i – го горючего вещества. Дано:
Решение. Для практических расчетов принимают, что воздух состоит из 21% кислорода и 79 % азота. Таким образом, объемное соотношение азота и кислорода в воздухе составит  , (1.1) , (1.1)где Весовое соотношение азота и кислорода в воздухе можно определить, исходя из соотношения  , (1.2) , (1.2)где Для удобства расчетов горючие вещества разделяют на три типа (таблица 1.1): – индивидуальные химические соединения (метан, уксусная кислота и т.п.); – вещества сложного состава (древесина, торф, сланцы, нефть и т.п.); – смесь газов (генераторный газ и т.д.). Таблица 1.1 – Формулы расчета теоретического количества воздуха
Для определения объема воздуха при горении в условиях, отличных от нормальных, пользуются следствием из уравнения состояния идеальных газов:  , (1.6) , (1.6)где р0 – нормальное давление, Па; где Т0 – нормальная температура, К; где V0 – объем воздуха при нормальных условиях; где р1, V1, T1 – соответственно, давление, объем и температура воздуха, характеризующие заданные условия горения. Практический объем воздуха, поступившего в зону горения, обозначают VB. Отношение практического объема воздуха к теоретическому называется коэффициентом избытка воздуха :  . (1.7) . (1.7)Решение В данном случае горючее – индивидуальное химическое соединение, а окислителем является воздух . Для расчета запишем уравнение химической реакции горения: и найдем: nГ = 1; Молекулярная масса динитротолуола М = 712 + 61 + 214 + 416 = 170; Объем 1 кмоля газа при нормальных условиях составляет 22,4 м3 Рассчитаем количество окислительной среды на 1 кг динитротолуола  ; ;  = 5,48 = 5,48 Из формулы (1.7) рассчитаем практическое количество окислительной смеси при нормальных условиях: Находим количество окислительной смеси, пошедшей на горение вещества при заданных условиях горения, используя формулу (1.6):  =33,8 =33,8 Масса окислительной среды Задание № 2 Рассчитать объем образующихся продуктов (м3) при горении i – го горючего вещества.
С целью упрощения, расчета все горючие вещества разделены на три типа: индивидуальные, сложные и смеси горючих газов (таблица 1.2). Таблица 1.2 – Формулы расчета объема и состава горения
Практический (полный) объем продуктов горения состоит из теоретического объема продуктов горения и избытка воздуха: или Состав продуктов горения, т.е. содержание i-го компонента, определяется по формуле  , (1.23) , (1.23)где где где При горении в избытке воздуха в продуктах горения содержатся кислород и азот: где Решение Горючее – индивидуальное химическое соединение. Запишем уравнение химической реакции горения: Окислитель содержит 30% кислорода и 70 % азота. Определяем содержание азота в продуктах сгорания 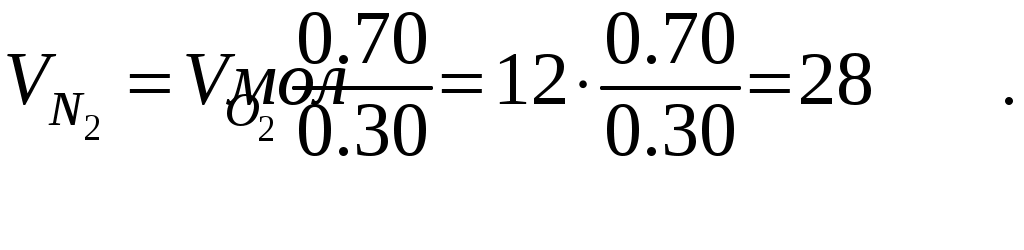 С учетом этого и α = 1,4, реакция горения выглядит так: Объем продуктов горения при сгорании 1 кг дибутилового эфира  Объем продуктов горения при заданных условиях (1420 К, Р = 101325Па и α = 1,4): Задание №3 Задачи по расчету теплот сгорания веществ
Расчет теплоты сгорания веществ При расчетах теплового баланса на пожаре, как правило, определяют низшую теплоту сгорания (таблица 2.1): где QВ – высшая теплота сгорания; где QH – низшая теплота сгорания; где QИС – теплота испарения воды, выделяющейся при сгорании вещества, Таблица 2.1 – Формулы расчета теплоты сгорания
Решение Расчет теплоты сгорания газовоздушных смесей проводят по формуле где где QH – низшая теплота сгорания горючего вещества, кДж/моль, кДж/м3; где φг – концентрация горючего в смеси, % об. Задание №4 Рассчитать температуру горения i-го вещества
Температура горения определяется из уравнения теплового баланса: При этом адиабатическая температура горения: 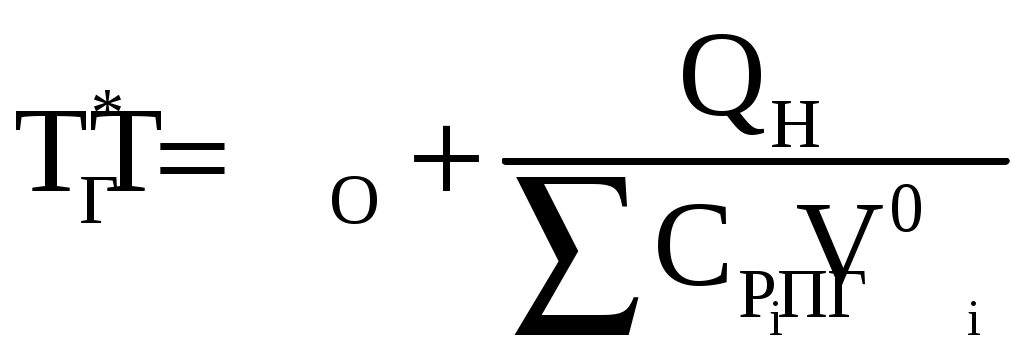 , (2.9) , (2.9)а действительная температура горения:  , (2.10) , (2.10)где где Т0 – начальная температура; где СРВ, где где VB – избыток воздуха; где QH – низшая теплота горения вещества; где QПГ – теплота, пошедшая на нагрев продуктов горения. При этом QПГ = QH (1 – η), (2.11) где η – доля теплопотерь в результате излучения энергии, химического и механического недожога. Расчет температуры горения по формулам (2.9) или (2.10) может быть проведен только методом последовательных приближений, т.к. теплоемкость газов зависит от температуры, т.е. температуры горения (таблица 2.3). Таблица 2.3 – Последовательность расчета температуры горения
Действительная температура горения на пожаре для большинства газообразных, жидких и твердых веществ изменяется в достаточно узких пределах (1300 – 1800 К). В связи с этим расчет действительной температуры горения может быть значительно упрощен, если теплоемкость продуктов горения выбирать при температуре 1500 К:  , ,где Таблица 2.4 – Теплоемкости продуктов горения при 1500 К
Решение. Расчет проводим по схеме, приведенной в таблице 2.3. 1. Так как горючее – индивидуальное вещество, для определения объема и состава продуктов горения запишем уравнение химической реакции горения: С2Н6 + 3,5О2 + 3,5·3,76 N2 = 2СО2 + ЗН2О + 3,5·3,76 N2. Следовательно, состав продуктов горения в молях: VПГ = 2 + 3 + 13,16 = 18,16 моля. 2. Низшую теплоту сгорания определяем по формуле (2.2). Из таблицы 3 находим теплоту образования этана – 88,4 кДж/моль: QH = 2·396,6 + 3·242,2 – 88,4 = 1431,46 кДж/моль. 3. Средняя энтальпия продуктов горения: ΔНСР =  = 78,82 кДж/моль. = 78,82 кДж/моль.4. Так как ΔНСР выражена в кДж/моль, то по таблице 1б, ориентируясь на азот, выбираем первую приближенную температуру горения T1 = 2300°C. 5. Рассчитываем теплосодержание продуктов горения при 2300°С по формуле (2.13): QПГ =126,9·2 +104,2·3 + 77,8·11,28 = 1444,0 кДж/моль. 6. Сравниваем QH и QПГ, так как QПГ > QH, выбираем температуру горения, равной 2200 °С. 7. Рассчитываем теплосодержание продуктов горения при 2200 °С: Так как 8. Так как  = 2110 °С. = 2110 °С. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 (1.3а)
(1.3а) (1.3б)
(1.3б) (1.4)
(1.4) (1.5)
(1.5) (1.14)
(1.14) (1.15)
(1.15) (1.19)
(1.19) (1.20)
(1.20) (2.3)
(2.3) (2.12)
(2.12) (2.14)
(2.14)