ФХ_03 вар_1_ГОТОВО. Задание к контрольной работе 1
 Скачать 496.5 Kb. Скачать 496.5 Kb.
|
|
Задание к контрольной работе № 1. Задание 1. Опишите (с приведением уравнений химических реакций) методы переведения ковалентно-связанного галогена в ионное состояние. Приведите примеры 2-3 лекарственных средств (структурная формула, латинское и химическое название), содержащих одновременно ковалентно-связанный хлор и иод. Предложите методы определения их подлинности по ковалентно-связанным галогенам с приведением уравнений реакций. Ответ: Для переведения связанного галогена в ионное состояние существует ряд методов. Выбор метода зависит от прочности связи. После переведения в ионное состояние требуется дальнейшее обнаружение галогена фармакопейными методами. Нагревание с концентрированной серной и азотной кислотами. Этот метод применяется для иод-содержащих органических соединений. В результате образуется молекулярный йод, который на стенках пробирки образует фиолетовый налет. 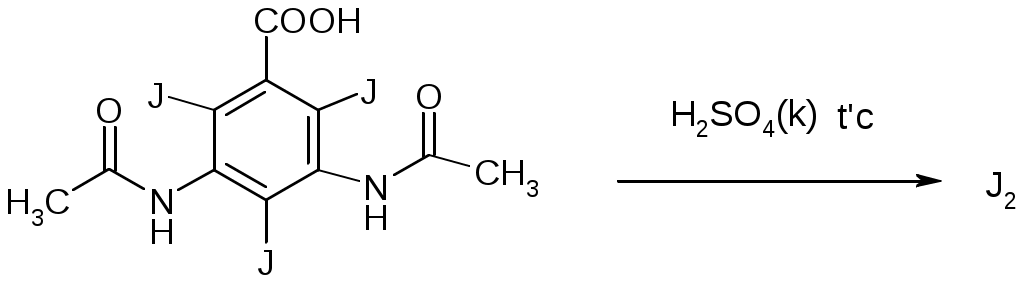 Кислота амидотризоевая Нагревание с раствором серебра нитрата в азотнокислой среде Этот метод применяют только для алифатических соединений, которые имеют небольшую молекулярную массу. Сначала происходит разрушение лекарственного вещества азотной кислотой до галогеноводородов, которые тут же взаимодействуют с серебра нитратом. 3. Нагревание с раствором натрия гидроксидом или калия гидроксидом в водной или спиртовой среде (10 или 30% растворы щелочей). В результате образуется натрия или калия галогенид. Например, хлорэтил дает характерную реакцию на хлориды после нагревания лекарственного вещества со спиртовым раствором калия гидроксида на кипящей водяной бане с обратным холодильником во избежание улетучивания хлорэтила: 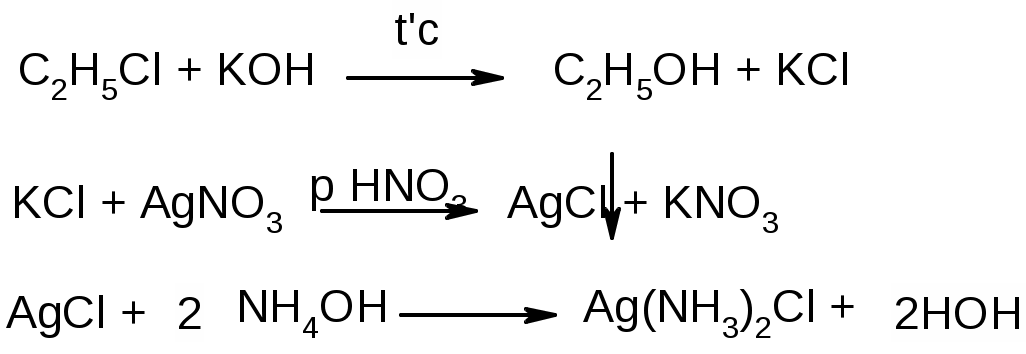 4. Сплавление с кристаллическим натрия гидроксидом или калия гидроксидом, сплавление с металлическим натрием. Такой способ обработки используется для обнаружения фтора во фторотане, фторафуре, фторурациле и др. лекарственных веществах. 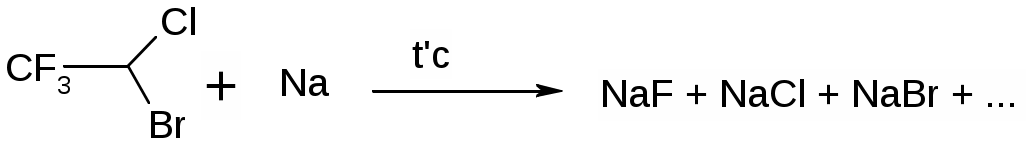 Фторотан В результате образуется натрия или калия галогенид. 5. Воздействие на ЛП металлическим цинком в кислой или щелочной среде. 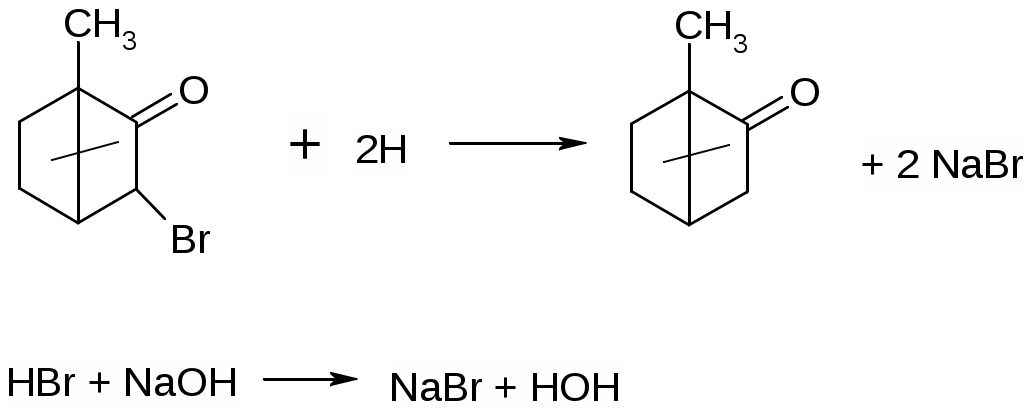 Во всех случаях после предварительной обработки цинковую пыль отфильтровывают и в фильтрате обнаруживают хлорид-, бромид- и йодид-ионы аналитическими реакциями, рекомендуемыми ГФ. 6. Метод сжигания веществ в колбе с кислородом. Сущность метода состоит в разрушении органических веществ в атмосфере кислорода, растворении образующихся продуктов сгорания поглощающей жидкостью и последующем определении веществ, находящихся в растворе. Принцип метода заключается в разрушении органических веществ сожжением в атмосфере кислорода, растворении образующихся продуктов в поглощающей жидкости и последующем определении галогенов в растворе в виде ионов или молекул. Сожжение проводят в конической колбе вместимостью 750-1000 мл из термостойкого стекла со шлифом. В пробку колбы впаяна платиновая проволока, заканчивающаяся корзиночкой (держатель). Образец помещают в полиэтиленовую капсулу. Подготовленную пробу закрепляют в корзинке. В колбу для сжигания наливают поглощающую жидкость, пропускают в течение 3-5 минут ток кислорода. Затем пробу поджигают и плотно закрывают колбу. При сжигании галогеносодержащих веществ образуются ионы или молекулы галогенов, например: 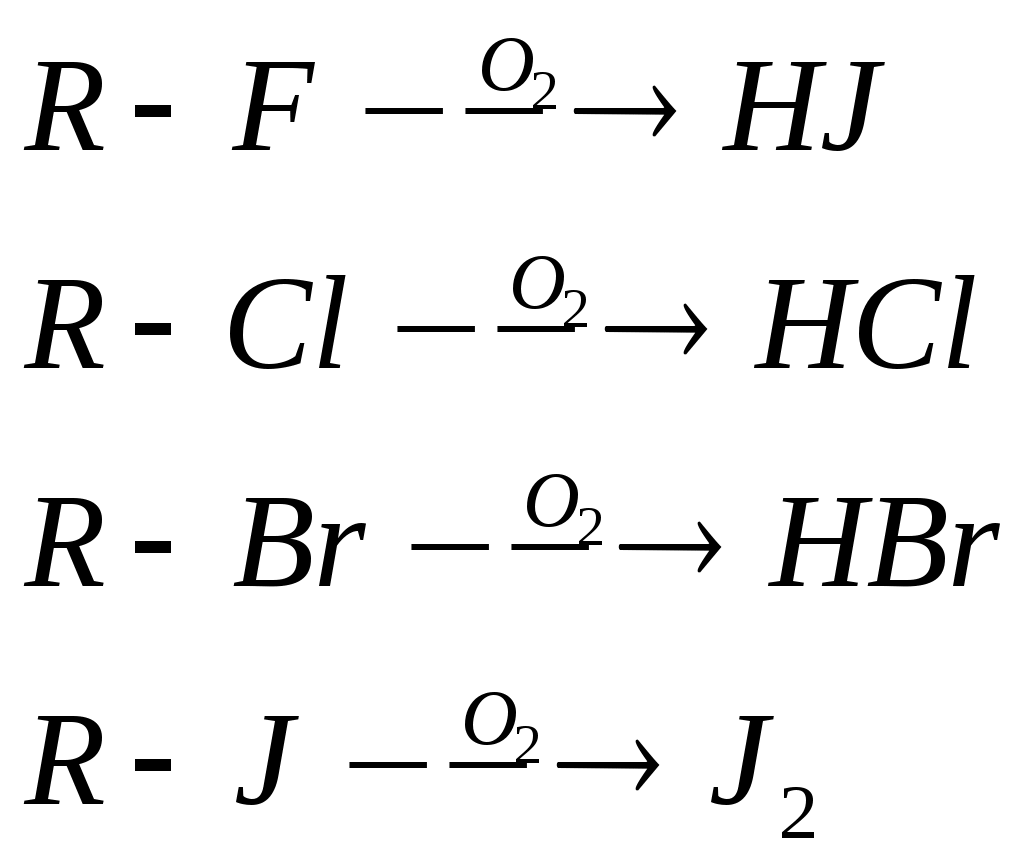 Примеры Энтеросептол (8-гидрокси-7-иод-5-хлорхинолин) Enteroseptolum 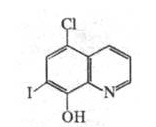 йод в энтеросептоле качественно определяют методом сжигания в колбе с кислородом. В качестве поглощающей жидкости используют раствор крахмала с добавлением сульфаминовой кислоты. Сульфаминовая кислота связывает нитриты, образующиеся при горении:  Выделяющийся при горении препарата йод окрашивает крахмал в характерный синий цвет. Можно поступить другим образом. К 2 каплям раствора прибавляют по 10 капель воды и кислоты серной разведенной, 1 каплю 0,1% раствора калия перманганата и встряхивают. Хлороформный слой окрашивается в фиолетовый цвет (йодиды). После окрашивания водного слоя в устойчивый розовый цвет его сливают в другую пробирку и прибавляют к нему 10 капель хлороформа. Последний не должен окрашиваться. Избыток калия перманганата разрушают прибавлением по каплям раствора водорода пероксида и далее прибавляют 2 капли раствора серебра нитрата. Образуется белый творожистый осадок (хлориды), растворимый при добавлении раствора аммиака: Cl-+AgNO3 = AgCl+NO3- Задание 2. Приведите 3 примера лекарственных средств, содержащих фенольные гидроксилы (один, два и три гидроксила). Предложите методы количественного определения с приведением уравнений реакций и расчетных формул по фенольным гидроксилам. Ответ: 1. Фенол чистый (Phenolum purum) Оксибензол Резорцин (Resorcinum), м-диоксибензол  Пирогаллол, 1,2,3-триоксибензол 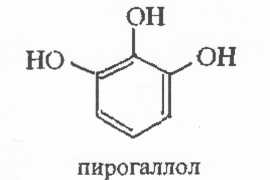 Количественное определение Фенол. Прямая алкалиметрия  F=1. Возможен цериметрический метод. Избыток титранта устанавливают иодометрическим методом, например:  2Ce(SO4)2 + 2KJ →J2 +Ce(SO4)3 +K2SO4 J2 +2Na2S2O3 → 2NaJ + Na2S4O6 Задание 3. Приведите 3 примера лекарственных средств, содержащих сложноэфирную группу. Предложите методы определения подлинности с приведением уравнений химических реакций по сложноэфирным группа. Ответ: Anaesthesinum. Анестезин. Этиловый эфир п-аминобензойной кислоты. Novocainum. Новокаин. β-Диэтиламиноэтилового эфира паминобензойной кислоты гидрохлорид. Cortisoni acetas. Кортизона ацетат. Прегнен-4-диол-17α,21-триона-3,11,20-ацетат. 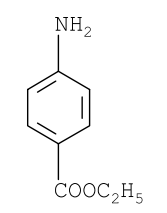 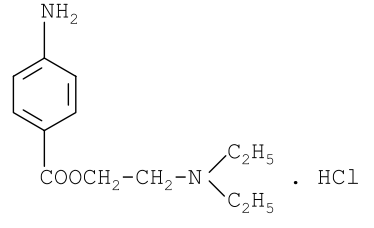 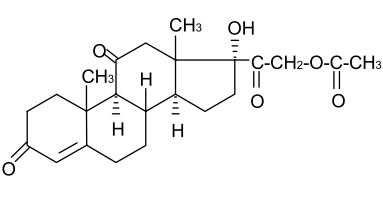 1 2 2 Подлинность устанавливается с помощью гидроксамовой реакции  анестезин гидроксиламин гидроксамовая кислота гидроксамат железа (III) Для кортизона (вишневый цвет): 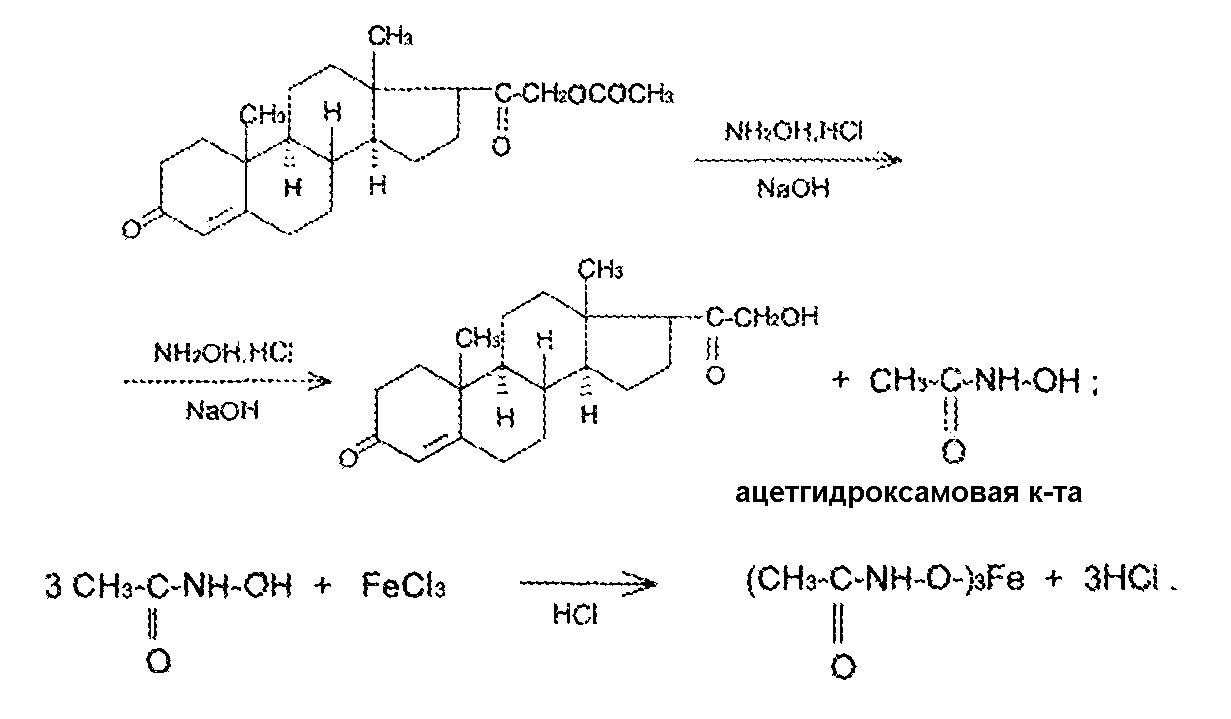 Для новокаина: 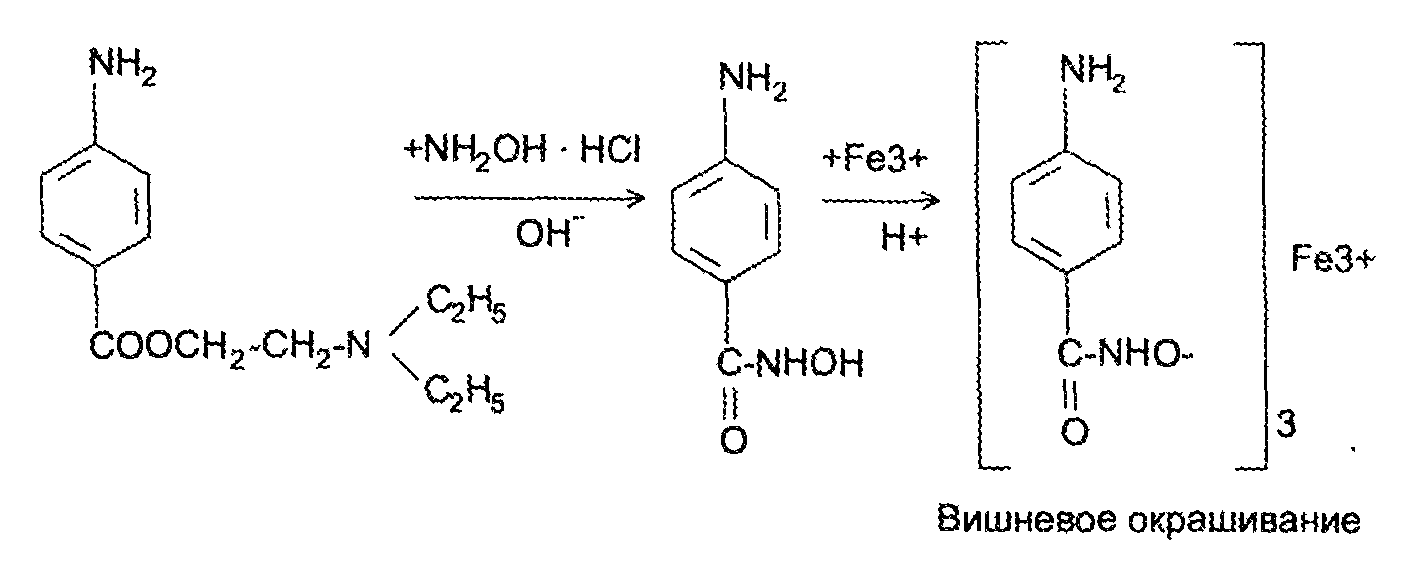 Задание 4. Приведите примеры 3 лекарственных средств, содержащих одновременно алифатические амино- и карбоксильную группу. Напишите структурные формулы, латинские и химические названия, методы определения подлинности и количественного содержания (с приведением уравнений реакций и расчетных формул) по амино- и карбоксильным группам. Ответ: 1. Acidum glutaminicum. Кислота глутаминовая 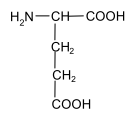 Aminalonum. Аминалон. Кислота γ-аминомасляная или кислота 4-аминобутановая. 3. Methioninum. Метионин. Кислота d,l-α-амино-γ-метилтиомасляная. 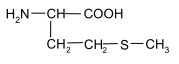 Реакции подлинности С нингидрином. Является общей реакцией на аминокислоты. Нингидрин – стабильный гидрат 1,2,3 – триоксогидриндана: 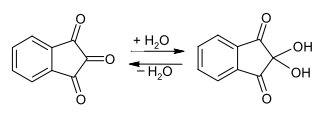 Обе равновесные формы вступают в реакцию: 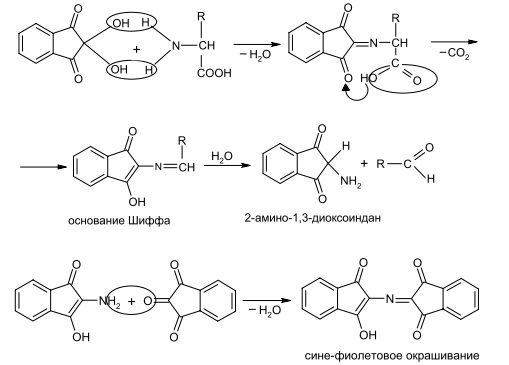 Частные реакции. Кислота глутаминовая Дикарбоновая глутаминовая кислота при нагревании дегидратируется с образованием кислоты пирролидонкарбоновой: 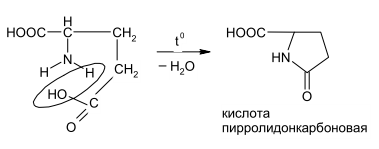 Полученная кислота пирролидонкарбоновая конденсируется с резорцином, образуя продукт, имеющий в растворе аммиака красно-фиолетовое окрашивание с зеленой флуоресценцией: 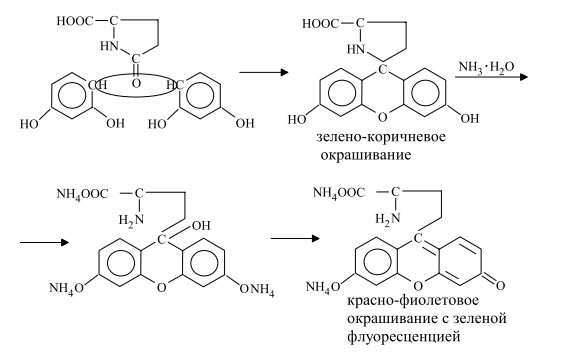 Аминалон Основные свойства аминокислот исчезают после блокирования аминогруппы альдегидами. К аминалону добавляют раствор натрия гидроксида до розового окрашивания по фенолфталеину. После добавления к этому раствору формальдегида окрашивание исчезает: 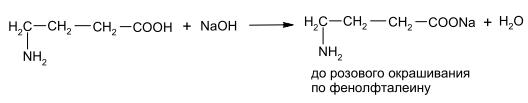 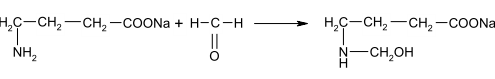 Розовое окрашивание исчезает, так как формальдегид устраняет основные свойства аминогруппы. Метионин. При сплавлении с 30% щелочью и последующем подкислении возникает резкий запах меркаптанов: 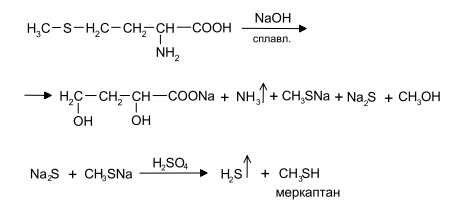 Восстановительные свойства метионина и продуктов его деструкции можно подтвердить и реакцией с натрия нитропруссидом. При нагревании лекарственного вещества с концентрированным раствором щелочи выделяется аммиак, пары которого окрашивают смоченную натрия нитропруссидом фильтровальную бумагу в красно-фиолетовый цвет. Количественное определение Алкалиметрия Аминалон и другие аминокислоты, имеющие одну карбоксильную группу можно оттитровать щелочью, заблокировав предварительно формальдегидом аминогруппу (формольное титрование): 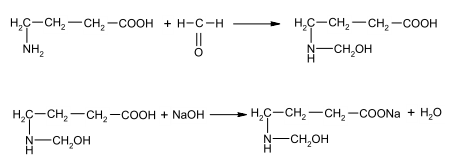 F=1. Кислоту глутаминовую можно определить по одной карбоксильной группе: 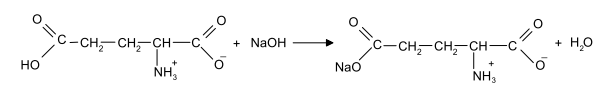 F=1. Если же применить формольное титрование, то кислоту глутаминовую можно количественно определить по двум карбоксигруппам. Метионин Количественное определение метионина также проводят йодометрически способом обратного титрования. В среде фосфатного буферного раствора метионин окисляется до сульфоксида: 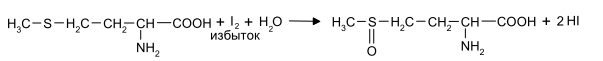 Избыток йода оттитровывают стандартным раствором натрия тиосульфата. J2 +2Na2S2O3 → 2NaJ + Na2S4O6  Задание 5. Обоснуйте связь между условиями хранения субстанции и лекарственных форм новокаина гидрохлорида и его химическими свойствами. Какие стабилизаторы и для чего применяются в растворах новокаина гидрохлорида? Ответ: Являясь сложным эфиром п-аминобензойной кислоты, новокаин способен в щелочной среде подвергаться гидролитическому расщеплению по сложноэфирной группе: 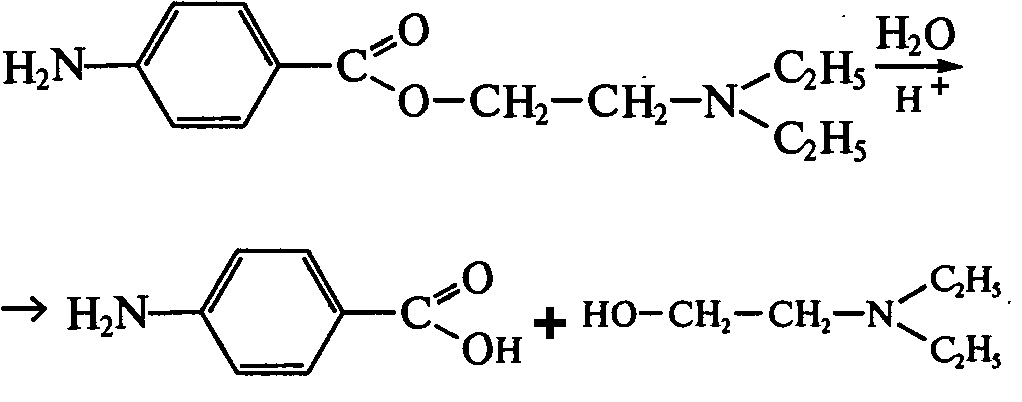 Наилучшими условиями хранения является – слабокислая среда, желтое стекло. Согласно требованию ГФ X (ст. 468), растворы новокаина для инъекций готовят с добавлением стабилизатора — 0,1 н. раствора хлористоводородной кислоты, которая добавляется до рН 3,8 — 4,5. Задание 8. Проведите количественное определение ингредиентов в лекарственной смеси: Калия иодида 3,0 Натрия бромида 7,0 Воды очищенной 200 мл Содержание калия иодида определено аргентометрически и равно 3,1 г. Рассчитайте содержание натрия бромида в граммах, если n=1,3409, n0=1,3330. Ответ: Натрия бромид определяют методом рефрактометрии. Калия йодид определяют методом йодометрии (заместительное титрование). Методика. Калия йодид. К 1 мл раствора прибавляют 5 – 6 капель кислоты серной разведенной, 0,04 г мочевины и медленно по каплям при частом взбалтывании 2 мл 0,1 М раствора натрия нитрита и оставляют на 5 – 10 минут в темном месте в закрытой колбе. Затем прибавляют 0,1 г калия йодида для растворения выделившегося йода и титруют 0,1 М раствором натрия тиосульфата до обесцвечивания. В конце титрования прибавляют 2 – 3 капли крахмала. 1 мл 0,1 М раствора натрия тиосульфата соответствует 0,01660 г KI 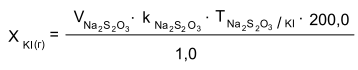 Х=3,1 г Натрия бромид Измеренный показатель преломления 1,3409. Ближайшие табличные значения 1,3400 и 1,3410, соответствующие концентрациям 5,24 % и 6,00%. Разность табличных показателей преломления соответствует одному проценту концентрации. 1,3400 – 1,3410 = 0,001. Разность найденного показателя преломления и одного из табличных значений (например, для 6%-го раствора) 1,3410 – 1,3409 = 0,0001 соответствует Х%. Отсюда 0,001 – 1% 0,0001 – Х Концентрация исследуемого раствора составит: 6– 0,1 = 5,9% (5,9 г/100 мл). Задание 9. Рассчитайте количественное содержание левомицетина стеарата в субстанции. Методика определения. Около 0,04 г (т.н.) левомицетина стеарата растворяют в 95% этаноле в мерной колбе вместимостью 100 мл и доводят объем раствора этанолом до метки (раствор А). 10 мл раствора А переносят в мерную колбу вместимостью 100 мл и доводят объем раствора этанолом до метки (раствор Б). Определят оптическую плотность полученного раствора Б на СФ при длине волны 272 нм в кювете с толщиной слоя 10 мм. Параллельно измеряют оптическую плотность 0,002% раствора стандартного образца левомицетина стеарата при длине волны 275 нм. Оптические плотность испытуемого и стандартного растворов равны соответственно 0,360 и 0,400. Точная масса препарата – 0,0410 г. Ответ: Согласно методу сравнения, применяемому в оптическом методе анализа: Получаем, используя процентные концентрации: Раствор получен разбавлением 10 мл раствора до 100, то есть получено 100 мл раствора с концентрацией 0,0022 % левомицетина стеарата. Тогда исходный раствор имел концентрацию 0,022%, что от 100 мл (масса раствора 0,78*100 = 78 г., здесь 0,78- плотность спирта) составляет 78*0,022/100 = 0,017 г. Процентное содержание 0,017*100/0,0369 = 46,5%. ЛИТЕРАТУРА 1. Фармацевтическая химия: учеб. пособие для вузов/ ред. А. П. Арзамасцев. М.: «ГЭОТАР-Медиа»,2005. – 635 с. 2. Беликов В.Г. Фармацевтическая химия в 2 - х частях / Учеб. для фарм. инст. и фарм. факул. мед. инст. - Ч. 1. - М.: Высшая школа, 1993. - 432 с. Ч. 2. - Пятигорск, 1996. - 608 с. 3. Руководство к лабораторным занятиям по фармацевтической химии: Учеб. Пособие. ред. А.П. Арзамасцев. М:.:Медицина, 2004. 4. Кулешова М.И., Гусева Л.Н., Сивицкая О.К. Анализ лекарственных форм, изготовляемых в аптеках. / Изд. 2-е перераб. и доп. - М.: Медицина, 1989. - 288 с. 5. Лабораторные работы по фармацевтической химии: Учеб. пособие для фарм. инст. и фарм. факул. мед. инст. / Беликов В.Г., Вергейчик Е.Н., Годяцкий В.Е. и др. - М.: Высшая школа, 1989. - 375 с. 6. Фармацевтическая химия: руководство к практическим занятиям для студентов, обучающихся по специальности 060108 фармация / Е.С. Гагарина, А.В. Озерская, Н.В. Кувачева и др. – Красноярск: типография КрасГМУ, 2009. – 176 с. 7. Дудко В.В., Тихонова Л.А. Анализ лекарственных веществ по функциональным группам. – Томск, 2004. – 137 с. |
