Задания репродуктивного типа (на оценку удовлетворительно)
 Скачать 254.88 Kb. Скачать 254.88 Kb.
|
Vдифф.Катализ – это называется изменение скорости химической реакции под действием веществ (катализаторов), которые в результате реакции химически не изменяются. Катализатор – это вещества, изменяющие скорость химической реакции, но не входящие в состав конечных продуктов. Гомогенный катализ – это это когда реагирующие вещества и катализатор находятся в одной фазе. Гетерогенный катализ – это это когда реагирующие вещества и катализатор находятся в разных фазах и химическая реакция протекает на границе раздела фаз. Автокаталитические реакции – это это когда сами продукты реакции могут быть катализаторами, и реакция самоускоряется со временем. Каталитическая активность гомогенного катализатора рассчитывается по уравнению AKK0, Число оборотов катализатора рассчитывается по уравнению А=а*М*10^3 Каталитическая активность гетерогенного катализатора рассчитывается по уравнению AKK0(1),. Основные положения гомогенного катализа (по Шпитальскому): Слитный механизм гомогенного катализа представляет собой Стадийный механизм гомогенного катализа представляет собой Ускоряющее действие гомогенного катализатора обусловлено Ферменты – это это биологический катализатор белковой природы,способный ускорять реакции в живых системах Простые ферменты – это Сложные ферменты – это Уравнение Михаэлиса-Ментен 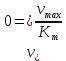 Величину Км и νmax определяют по уравнению Михаэлиса-Ментен I способом Лайнуивера-Берка в координатах от 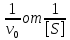 Величину Км и νmax определяют по уравнению Михаэлиса-Ментен II способом Лайнуивера-Берка в координатах 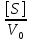 от [S] от [S]Величину Км и νmax определяют по уравнению Михаэлиса-Ментен способом Эдди-Хофсти в координатах 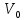 от от 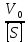 Первичный солевой эффект – это Вторичный солевой эффект – это это если к раствору,катализируемой кислотой добавить соль этой же кислоты,то каталитическое действие этой кислоты увеличится Наличие солевых эффектов зависит от Уравнение Бренстеда-Бьеррума (логарифмическая форма) 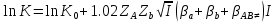 При общем кислотном и основном катализе каталитическое действие проявляют При специфическом кислотном и основном катализе каталитическое действие проявляют При электрофильном и нуклеофильном катализе каталитическое действие проявляют Для разбавленных растворов функция кислотности Гаммета равна Сродство реагирующих веществ к катализатору обеспечивает Избирательность катализатора – это это явление образования различных продуктов реакции с участием различных катализаторов при наличии в системе одинаковых реагентов Отравление катализатора – это, Принцип действия каталитического яда заключается в Уравнение изотермы отравления катализатора при низких концентрациях яда имеет вид Уравнение изотермы отравления катализатора при высоких концентрациях яда имеет вид Обратимое отравление – это если катализатор в течении определённого времени способен восстановить активность Необратимое отравление – это если катализатор в течении определённого времени не способен восстановить активность . Промотирование катализатора – это Ускоряющее действие гетерогенного катализатора обусловлено Скорость гетерогенных химических реакций – это Гетерогенно-каталитическая реакция протекает в кинетической области, если лимитирующей является стадия Гетерогенно-каталитическая реакция протекает в диффузионной области, если лимитирующей является стадия 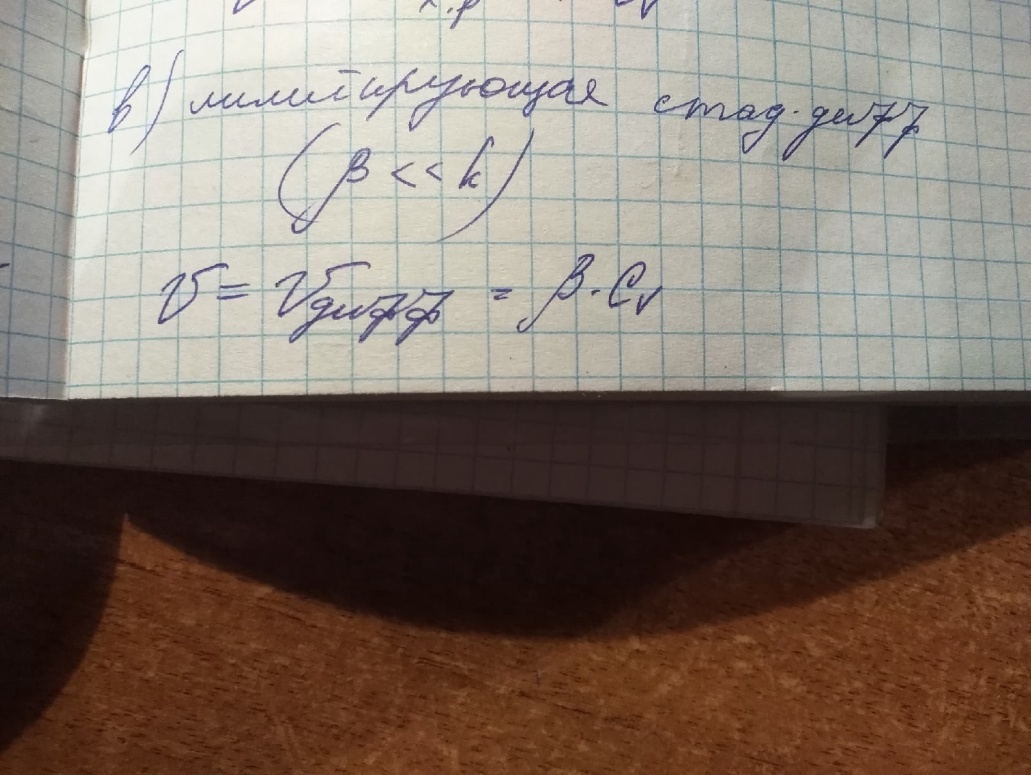 Гетерогенно-каталитическая реакция протекает в переходной области, если лимитирующей является стадия Уравнение скорости гетерогенной химической реакции 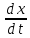 = =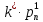 (p в степени ½) (p в степени ½)Активные центры гетерогенного катализатора – это адсорбционный центр, на который происходит хемосорбция реагента на поверхность катализатора с образованием неустойчивого соединения Мультиплетная теория гетерогенного катализа основана на гетерогенного катализа основана на взаимосвязи между строением активного центра катализатора и строении реагента Принцип геометрического соответствия: Активный центр катализатора состоит из адсорбционных центров расположение которых находится в строго геометрическом соответствии со строением реагента Мультиплет – это группа рядом расположенных спектральных линий (совокупность частиц схожих по своим свойствам), обусловленных расщеплением энергетического уровня атома на несколько уровней с различной энергией. Теория активных ансамблей гетерогенного катализа основана на основана на носителе каталитической активности является находящаяся на поверхности атомная (докристаллическая) фаза катализатора, относительно которой поверхность носителя (или кристаллическая фаза самого катализатора) выполняет функцию инертной подкладки. Катализаторы на носителях – это катализатор в котором каталитически активное вещемство нанесено на твердое тело с высокоразвитой поверхностью ( носитель). В качестве носитель выступает активированный уголь, алюмогель, селикогель, полимерные материалы. Адсорбционные катализаторы – это в-во на поверхности которого осуществляется адсорбция Причиной каталитической активности переходных металлов является каталитическая активность обусловлена их строением 1) Недостроенность внешних d-электронных оболочек. 2) Электроны способны переходить с внешних s-оболочек на внешние d-оболочки, образуя один или несколько неспаренных электронов. 3) Наличие неспаренных электронов обеспечивает быстрое образование промежуточного соединения с реагентом. |


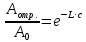 L-это альфа
L-это альфа