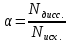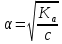теория кислот. Теорий кислот и оснований. Учебник для 10 классов общеобразовательных школ естественноматематического направления. А. Мектеп. 2019 1 часть Ход занятия
 Скачать 46.39 Kb. Скачать 46.39 Kb.
|
|
КГУ «Карагандинский индустриально-технологический колледж» План учебного занятия Тема занятия: Теории кислот и оснований Наименование модуля /дисциплины : Химия Подготовил педагог: Смайлова Г.Б. «___»__________ 20___ года 1. Общие сведения Курс, группы __________________ Тип занятия: Комбинированный урок 2. Цели, задачи: выявить особенности органических соединений, с точки зрения теории Бренстеда-Лоури (протолитическая теория) и теории Льюиса, научиться определять различия между теориями и отличительные особенности. Усвоение понятий кислота и основание с точки зрения разных теорий. Уметь писать уравнения реакций, 3. Ожидаемые результаты: Объяснять условия ионного равновесия в растворах электролитов и определять скорость протекания химической реакции. 4. Необходимые ресурсы: М.К.Оспанова, К.С.Аухадиева, Т.Г. Белоусова. Учебник для 10 классов общеобразовательных школ естественно-математического направления. А.Мектеп. 2019 1 часть 5. Ход занятия Организационный момент - Приветствовать студентов, отметить отсутствующих. - Проверить подготовленность студентов к учебному занятию Обьяснение нового материала: Определение кислот и оснований было предложено шведским химиком Аррениусом в конце XIX в рамках теории диссоциации. Кислота – вещество, которое диссоциирует в воде с образованием ионов водорода. Основание – вещество, которое диссоциирует в воде с образованием гидроксид-ионов. Данные определения иногда являются ограниченными и иногда неточными. Так, ион водорода Н+ не существует в воде, поскольку Н+ – голый протон, такая концентрация положительного заряда позволяет ему быстро реагировать с неподелённой парой на кислороде в молекуле воды: Н2О + Н+ = Н3О+ (гидроксоний). Кроме того, некоторые соединения не содержат ионов гидроксила ОН-, но все же обладают основными свойствами, например аммиак NH3. Поэтому существует более общее определение кислот и оснований, предложенное Брёнстедом и Лоури в начале XX века и широко используется в наши дни. Кислота (acid) Брёнстеда-Лоури – донор протонов Н+. Основание (base) Брёнстеда-Лоури – ацептор протонов. Затем на основе электронных представлений Льюисом было еще более расширено понятие кислоты и основания. Кислота Льюиса – молекула или ион, имеющие вакантные электронные орбитали, вследствие этого они способны принимать электронные пары. Основание Льюиса – молекулы или ионы, способные быть донором электронных пар. Кислоты и основания между собой классифицируются по способности отдавать Н+ или ОН-, т.е. по способности диссоциировать, или, проще говоря, по силе. Сильные кислоты легко отдают протон, по существу 100% кислоты диссоциирует на ионы. Слабая кислота диссоциирует с трудом, только небольшая её часть распадается на ионы. Точно такие же рассуждения применимы и для оснований. Количественно способность к диссоциации выражается отношением числа продиссоциированных частиц (Nдисс.) к исходному числу частиц (Nисх.) и называется степенью диссоциации ( 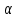 ): ):
Если α=1, то все исходные частицы в растворе распались на ионы, такие электролиты сильные. Если α<1, то только часть частиц распалась на ионы, такие электролиты слабые. Процесс электролитической диссоциации протекает обратимо, поэтому можно применять принцип Ле Шателье. Разбавление раствора будет смещать равновесие в сторону увеличения степени диссоциации. Таким образом, диссоциация слабых электролитов в разбавленных растворах протекает лучше, чем в концентрированных. Применение закона действующих масс к электролитической диссоциации слабых электролитов позволяет получить выражение для константы диссоциации (К). Рассмотрим, равновесие в водном растворе слабого электролита – уксусной кислоты: CH3COOH 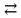 СH3COO- + H+ СH3COO- + H+Запишем выражение для константы химического равновесия данного процесса: 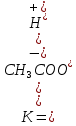 Поскольку константа равновесия не зависит от концентрации, поэтому константы диссоциации электролитов можно найти в справочных таблицах, для уксусной кислоты Ка=1,8·10-5, значение очень маленькое, это означает, что она будет посылать в раствор мало ионов и, соответственно, будет являться слабой. Это можно доказать, посчитав степень ее диссоциации, например в 0,1 М растворе: 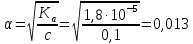 , что составляет всего 1,3 %. Т.е. только 1,3% всех молекул кислоты будут распадаться на ионы. Здесь α – степень диссоциации кислоты, а выражение для расчета степени диссоциации – есть закон разбавления Оствальда: , что составляет всего 1,3 %. Т.е. только 1,3% всех молекул кислоты будут распадаться на ионы. Здесь α – степень диссоциации кислоты, а выражение для расчета степени диссоциации – есть закон разбавления Оствальда:
В водных растворах слабых оснований рассуждения идентичны, например диссоциация NH4OH: NH4OH 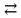 NH4+ + OH-. NH4+ + OH-.Выражение для константы диссоциации водного раствора аммиака: 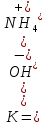 Общие выражения для расчета констант диссоциации кислоты 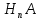 (19) и основания (19) и основания 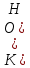
Закрепление: Давайте подведем итог сегодняшней беседы и сделаем небольшой вывод. Кислотно-основные взаимодействия чрезвычайно распространены в природе и находят широкое применение в научной и производственной практике. Теоретические представления о кислотах и основаниях имеют важное значение в формировании всех концептуальных систем химии и оказывают разностороннее влияние на развитие многих теоретических концепций во всех основных химических дисциплинах. Классификация кислот. Соотнесите: Тип кислот: Формула вещества: Кислородсодержащие а) H2SiO3 бескислородные б) HCOOH одноосновные в) H2SO4 двухосновные г) HBr сильные д) HNO3 слабые Домашнее задание: Изучите теоретический материал, и просмотрите записи в тетради. | ||||||||||||||||||||||||||||||