Молекулярно–кинетическая теория идеальных газов. Закон БойляМариотта
 Скачать 116.01 Kb. Скачать 116.01 Kb.
|
|
Оглавление стр. Введение………………………………………………………………………...3 1. Основные положения молекулярно-кинетической теории газов………...4 2. Идеальный газ………………………………………………………………..7 3. Законы идеального газа……………………………………………………...8 3.1 Закон Бойля-Мариотта……………………………………………………8 3. 2 Закон Гей-Люссака……………………………………………………….8 3. 3 Закон Шарля………………………………………………………………9 3. 4 Вывод уравнения состояния идеального газа…………………………..9 Заключение…………………………………………………………………….12 Список используемой литературы……………………………………………13 Введение Ещё 200 лет назад все законы природы представлялись как разрозненные правила, которые были выведены из опытов и не были связаны между собой. Многие учёные пытались превратить теории, правила, открытые законы, явления и эффекты в строгую науку. Но удавалось это с большим трудом, не всегда и не легко. Некоторые физики считали, что все явления следует объяснять, исходя из законов механики, что всё в природе состоит из мельчайших частиц. Другие учёные настаивали на том, что первичными в природе являются жидкости и что вселенная заполнена эфиром. Тепло также считалось одной из жидкостей. Истина, как и всегда, рождалась в трудной борьбе идей и мнений. История о том, как человек обнаруживает и изучает законы природы, как открывается новое, неопознанное, как создаётся великая наука естествознания – история поучительная и интересная. Физика непрерывно изменяется. Постоянно открываются новые связи между разными явлениями природы, обнаруживаются новые эффекты, формулирующие законы. Самое удивительное в нашем необъятном мире – это то, что он познаваем. Но понять и узнать его можно только изучив истоки физической науки, а это очень важно. В физике различают понятия микромир и макромир. Микромир изучает область физических микрочастиц, очень малых объектов, Частицы неотделимы от создаваемых ими полей и каждое поле вносит свой вклад в структуру частиц /4, стр. 83/. В макромире изучаются привычные нам объекты природы, с которыми обычно сталкивается человек. В данной работе рассмотрены молекулярно-кинетическая теория газа, основные газовые законы для идеальных газов. 1. Основные положения молекулярно-кинетической теории газов Привычный нам микромир можно описать тремя концепциями: 1. Классической механикой Ньютона описывается механическое движение системы. 2. Молекулярно-кинетическая теория описывает внутреннее строение системы и её свойства. 3. Классической термодинамикой описываются процессы превращения энергии в системе. Молекулярно-кинетическая теория также имеет свои особенные основные положения. 1. Все атомы и молекулы находятся в непрерывном хаотическом тепловом движении. Интенсивность их движения зависит от температуры. 2. Между всеми частицами существуют силы взаимодействия, природа которых – электромагнетизм. С помощью этих сил частицы могут притягиваться и отталкиваться. 3. Только нагревание и охлаждение систем, в отличие от механического движения, может привести к изменению их физических свойств. Молекулярная физика объясняет свойства вещества в различных агрегатных состояниях на основе молекулярно-кинетических представлений о строении вещества. Кинетическая теория газов может строиться на основании некоторых общих представлений, а также и на опытных данных. В основе молекулярно-кинетической теории лежат факты броуновского движения, которое доказывает молекулярное движение и зависимость этого движения от температуры. В основе молекулярно-кинетической теории лежит и явление диффузии – самопроизвольное перемешивание жидкостей и газов. Движение молекул полностью хаотично. Причём средняя скорость молекул пропорциональна корню квадратному из абсолютной температуры. Средние кинетические энергии молекул разных газов, находящихся при одинаковой температуре, равны между собой. Существование беспорядочного, хаотичного движения молекул легко доказать. Газ всегда стремиться занять весь предоставленный ему объём. Броуновское движение – беспорядочное движение мельчайших, видимых только в микроскоп частиц вещества, находящихся во взвешенном состоянии и нерастворимых в ней. Это движение происходит под действием беспорядочных ударов молекул, находящихся в постоянном хаотическом движении. При диффузии молекулы одного тела, непрерывно двигаясь, проникают в промежутки между молекулами другого соприкасающегося с ним тела и распространяются между ними. Диффузия проявляется во всех телах – в газах, жидкостях, в твёрдых телах. Диффузия в газах наблюдается практически сразу, если сосуд с газом, обладающим резким запахом, открыть в помещении. Через некоторое время газ распространится по всему помещению. Диффузия в жидкостях происходит медленнее, чем в газах. Если в стакан нальем раствор медного купороса, а затем, очень осторожно добавим слой воды и оставим стакан в помещении с постоянной температурой, и где он не будет подвергаться сотрясениям, то через некоторое время будем наблюдать исчезновение резкой границы между купоросом и водой, а через несколько дней жидкости перемешаются, несмотря на то, что плотность купороса больше плотности воды. Диффузия в твердых телах происходит еще медленнее, чем в жидкостях. Все положения молекулярно-кинетической теории экспериментально доказаны. Подтверждаются явлениями диффузии, броуновского движения. Количественное подтверждение этой концепции – газовые законы для идеальных газов /3, стр. 54/. 2. Идеальный газ Идеальный газ является простейшей термодинамической системой и описывается моделью. 1. Молекулы имеют массу, которая равна массе реальных молекул. Но они не имеют размеров, поэтому молекулы можно считать материальными точками. 2. Расстояния между молекулами настолько велики, что силами притяжения и силами отталкивания между молекулами можно пренебречь. 3. При взаимных столкновениях и соударениях со стенками сосуда молекулы ведут себя как абсолютно упругие шары и столкновения и соударения осуществляются по законам абсолютно упругого удара. Идеального газа не существует, но можно приблизиться к идеальному газу – при низком давлении и высокой температуре молекулы движутся, практически не задевая друг друга. Вещество звезд, находящихся на главной последовательности диаграммы Герцшпрунга-Рессела, на определенной глубине находится в состоянии, очень близком к идеальному газу, несмотря на высокую плотность /2, стр 111/. При комнатных температурах и небольших давлениях реальные газы ведут себя как идеальные. Уравнением состояния простой системы называется функциональная зависимость равновесного давления в системе от объёма и температуры: 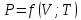 3. Законы идеальных газов Законы идеальных газов сформулированы для равновесных изопроцессов. Изопроцессами называются термодинамические процессы, происходящие в системе с постоянной массой при одном постоянном параметре состояния термодинамической системы. 3.1 Закон Бойля-Мариотта Для данной массы газа при изотермическом процессе (Т = const) отношение давлений газа обратно пропорционально отношению объемов (рисунок 1). 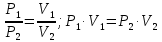  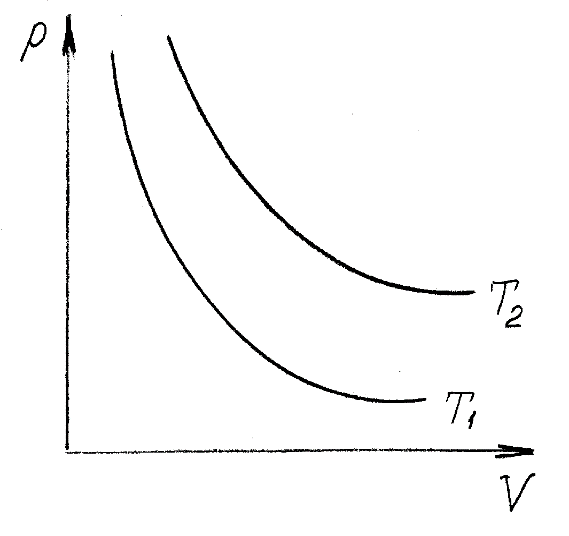 Рисунок 1 3. 2 Закон Гей-Люссака Для данной массы газа при изобарном процессе (P = const) объем газа линейно изменяется с температурой. 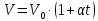 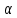 – температурный коэффициент объемного расширения, определяет относительное изменение объема при изменении температуры на 1º; – температурный коэффициент объемного расширения, определяет относительное изменение объема при изменении температуры на 1º;t – температура по шкале Цельсия; 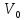 – объем данной массы газа при t = 0 °C и давлении – объем данной массы газа при t = 0 °C и давлении Объемы газа при изобарном процессе относятся как абсолютные температуры (рисунок 2). 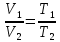 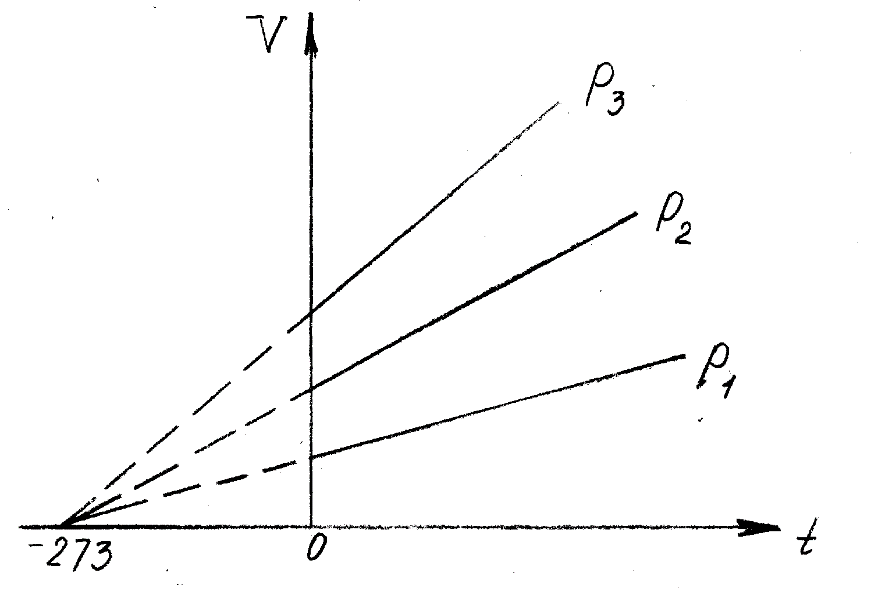 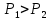 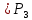 Рисунок 2 3. 3 Закон Шарля Для данной массы газа при изохорном процессе (V = const) давление газа линейно изменяется с температурой. 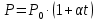 α – термический коэффициент давления, характеризует относительное изменение давления при изменении температуры на 1º; 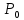 – давление данной массы газа при t = 0 °C – давление данной массы газа при t = 0 °C Давления газа при изохорном процессе (V = const) относятся как абсолютные температуры (рисунок 3). 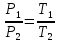 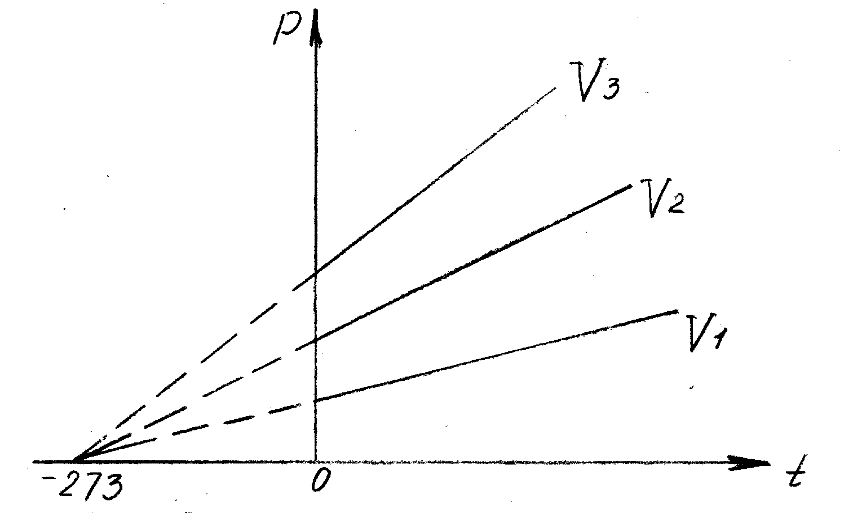  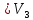 Рисунок 3 2. 4 Вывод уравнения состояния идеального газа Переведем один моль идеального газа из состояния 1 в состояние 1' изотермически, из состояния 1' в состояние 2 – изохорически (рисунок 4). 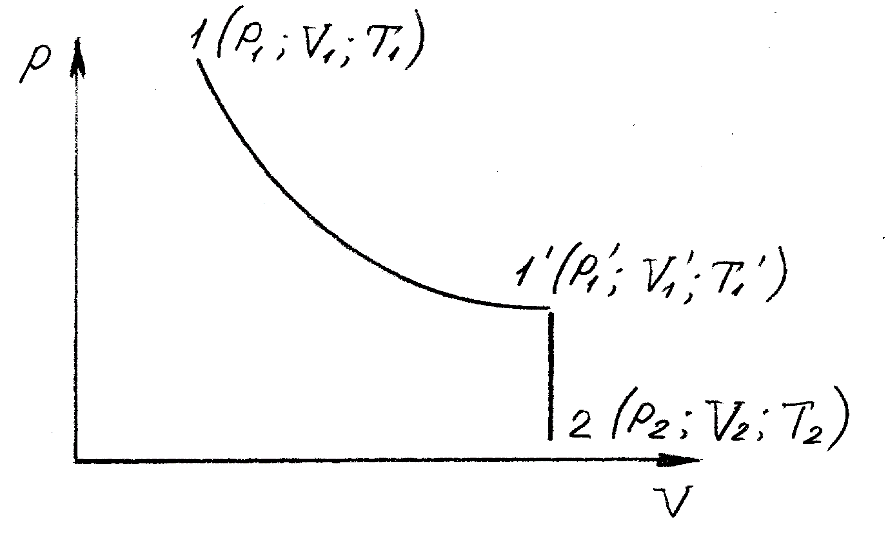 Рисунок 4 Для перехода 1-1' 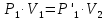 Для перехода 1' – 2 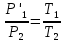 Отсюда 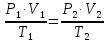 Следовательно 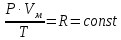 R = 8,31 Дж/ моль ⋅ К – универсальная газовая постоянная. Для одного моля идеального газа: 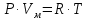 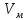 – объем одного моля – объем одного моляПусть m – масса газа, M – молярная масса, тогда 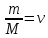 – число молей газа. – число молей газа. Для любого числа молей газа: 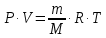 Это уравнение Менделеева-Клайперона, где 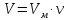 Заключение В данной работе рассмотрена молекулярно-кинетическая теория идеальных газов. Изучены концепции и положения молекулярно-кинетической теории, а также выявлено, что идеальный газ, который можно описать моделью, является простейшей термодинамической системой. На примерах доказано существование броуновского движения и диффузии. Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу. А если внести поправки, учитывающие собственный объём молекул газа и действующие молекулярные силы, можно перейти и к теории реальных газов. В работе рассмотрены законы идеальных газов, которые сформулированы для равновесных процессов. Изучены основные законы идеальных газов – закон Бойля-Мариотта, закон Гей-Люссака, закон Шарля, выведено уравнение состояния идеального газа.   Список используемой литературы 1. Кибец И. Н., Кибец В. И. Физика. Справочник. – Ростов-на-Дону: Феникс, 2003 2. Кудрявцев П. С. Курс истории физики. – М.: просвещение, 2001 3. Липсон Г. Н. Великие эксперименты в физике. – М.: Мир, 2000 4. Рузавин Г. И. концепции современного естествознания. – М.: Культура и спорт, 2003 5. Тэйлор Э., Уилер Дж. Физика пространства-времени. – М.: Мир, 2001 6. Фокин В. М., Бойков Г. П. Видин Ю. В. Основы технической теплофизики.– М.: МГУ, 2004 7. Цветков В. С., Григорьев М. Н. Тепломассобмен. – М.: Просвещение, 2005 |
