основные формулы гидрологии. Закон Дарси
 Скачать 19.57 Kb. Скачать 19.57 Kb.
|
|
Формула Шези 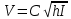 C- коэффициент Шези (С=30-80 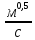 ), зависит от глубины и шероховатости русла; n – коэффициент шероховатости (n=0,02-0,03) ), зависит от глубины и шероховатости русла; n – коэффициент шероховатости (n=0,02-0,03)h-гидравлический радиус, м I-уклон водной поверхности (I=0,00003-0,001) Скорость потока растет с увеличением гидравлического радиуса или средней глубины. С увеличением глубины ослабевает влияние шероховатости дна на величину скорости в отдельных точках вертикали и за счет этого уменьшается площадь на эпюре скоростей, занятая малыми скоростями. Увеличение гидравлического радиуса приводит к увеличению коэффициента Шези. Скорость потока растет с увеличением уклона. Закон Дарси 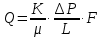 Q-расход жидкости, 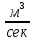 К-проницаемость, 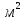 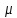 -динамическая вязкость, Па*сек -динамическая вязкость, Па*секF-площадь сечения, перпендикулярно потоку, 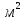 L-длина участка, м 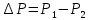 - изменение по длина участка L, Па - изменение по длина участка L, ПаРасход воды прямо пропорционален площади и градиенту давления и обратно пропорционален длине участка. Закон Бернули следствие закона сохранения энергии Для стационарного потока несжимаемой жидкости: 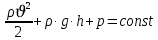 Для горизонтальной трубы: 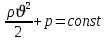 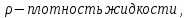 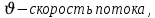 h – высота, p – давление g – ускорение свободного падения. При уменьшении сечения потока, из-за возрастания скорости (динамического давления) статическое давление падает. Закон действующих масс для химической кинетики 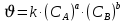 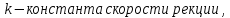 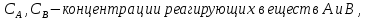 a, b – коэффициенты в уравнении реакции При постоянной температуре скорость химической реакции пропорциональная произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции. Закон действующих масс для химической термодинамики {\displaystyle K_{a}=\prod _{i=1}^{n}a_{i}^{{\nu }_{i}}} 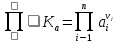  {\displaystyle a_{i}}— активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов); {\displaystyle a_{i}}— активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов);{\displaystyle {\nu }_{i}} 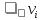 — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным); — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);{\displaystyle K_{a}} 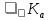 — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле. — константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.{\displaystyle K_{c}={c^{\mathrm {c} }(\mathrm {C} )\cdot c^{\mathrm {d} }(\mathrm {D} ) \over c^{\mathrm {a} }(\mathrm {A} )\cdot c^{\mathrm {b} }(\mathrm {B} )}} В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции. |
