Химия4. Закон действующих масс
 Скачать 23.3 Kb. Скачать 23.3 Kb.
|
|
1. Скорость химических реакций. Закон действующих масс. Взаимодействие между различными веществами происходит при различных условиях и с различной скоростью. Понятие о скорости химической реакции является одним из важнейших в химии. Скорость химической реакции характеризуется изменением концентрации реагирующих веществ за единицу времени. Концентрация выражается числом молей в 1 л, время — секундами, минутами или часами в зависимости от скорости данной реакции. Так как все реагирующие вещества связаны между собой уравнением реакции, по изменению концентрации одного вещества можно судить об изменениях концентрации всех остальных. Например, исходная концентрация одного из реагирующих веществ составляла 2 моль/л, а через 5 мин от начала реакции она стала 1,5 моль/л; таким образом средняя скорость реакции будет равна (2-1,5)/5=0,1 моль/л в минуту. Для того чтобы произошло химическое взаимодействие веществ, молекулы или ионы должны столкнуться. Только при этом станет возможным образование молекул новых веществ (продуктов реакции). Ясно, что скорость реакции будет пропорциональна числу столкновений, которое будет тем больше, чем выше концентрация реагирующих веществ. В 1867 г. К. М. Гульберг и П. Вааге открыли так называемый закон действия масс, устанавливающий зависимость скорости химической реакции от концентрации. Согласно этому закону скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ. Так, для реакции А+В=АВ выражение для скорости реакции будет иметь вид V = k[A] [В], где V — скорость реакции; [А] — концентрация вещества А; [В]—концентрация вещества В; k — коэффициент пропорциональности, или константа скорости. Опыт показывает, что скорость химической реакции зависит от температуры, причем при повышении температуры скорость большинства реакций увеличивается. Это объясняется тем, что при повышении температуры увеличивается скорость движения молекул, а следовательно, и число столкновений между ними. Кроме того, скорость реакции зависит от природы реагирующих веществ. Эти два фактора влияют на величину константы скорости и, следовательно, она зависит от температуры и природы реагирующих веществ, а также от присутствия катализатора. Если [А]=1 и [В]=1, то V=k. Константа скорости k численно равна скорости данной реакции, если кон центрации реагирующих веществ или их произведение равны единице. Если 2 моля вещества А вступят в реакцию с 3 молями вещества В, т. е. 2А +ЗВ = С, то скорость данной реакции V= k [А]2 [B]3 Таким образом, для реакции mА + nВ = рС выражение для скорости реакции будет следующее: V = k [A]m [В]n 2.Составте электронные уравнения, подберите коэффициенты методом электронного баланса и укажите восстановитель и окислитель: 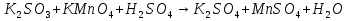 . .Решение: 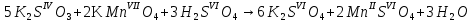 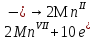 восстановитель восстановитель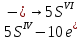 окислитель окислитель3. Вычислите молярную концентрацию раствора и количество Na2CO3, содержащееся в 100см3, если в 200 см3 раствора содержится 10,599 г Na2CO3. Ответ 0,5 моль/дм3, 0,05 моль Решение: Молярная масса Na2CO3=22,9*2+12,01+15,99*3=105,78 г/моль Если в 200 см3 содержится 10,599 Na2CO3, то содержание в 100 см3 найдем с помощью пропорции: 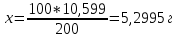 Молярная концентрация 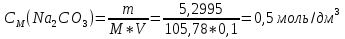 Количество вещества: 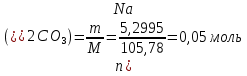 4. Вычислите рН растворе, содержание 2,48 г гидроксида натрия в 1 дм3 раствора. Решение: 1. NaOH-сильный электролит, поэтому 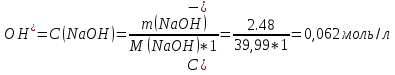 2. Произведение 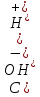 (ионное произведение воды) =10-14 (ионное произведение воды) =10-14 найдем С(Н+)=10-14/0,062=1,61*10-13 3. 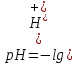 рН=12,7 рН=12,7 5. Вычислите аналитические множители для определения Ag, FeO, если их гравиметрические формы соответственно имеют химические формулы AgCl и Fe2O3 Аналитический множитель (фактор пересчета), является отношением молярных масс определяемого вещества и его весовой формы, взятых в соответствии с коэффициентами их образования, число атомов определяемого компонента в числителе и знаменателе дроби должно быть одинаковым. 1. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (Ag) и гравиметрической (весовой) формы (AgCl), то аналитический множитель будет иметь следующее значение: 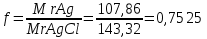 2. В рассматриваемом примере химическая эквивалентность соединений в числителе и знаменателе устанавливается простым уравниванием числа атомов определяемого элемента, общего для определяемого вещества (FeО) и гравиметрической (весовой) формы (Fe2О3), то аналитический множитель будет иметь следующее значение: 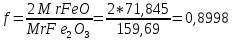 Ответ: 0,7526, 0,8998 6. Навеска сухого кальцита CaCO3 массой 1,5120 г после прокаливания до постоянной массы составила 0,8470 г. Вычислите массовую долю (%)CO в образце. Ответ:56,02%. Решение: 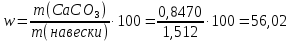 7. В 200 см3 раствора карбоната калия содержится 1,3821 г К2СО3. Определите титр, и молярную концентрацию и молярную концентрацию эквивалентов данного раствора. Ответ: 0,006911г/см3; 0,05 моль/л, 0,1моль/л Решение: Молярная масса К2СО3=39*2+12+16*3=138 г/моль Молярная концентрация определяется по формуле: 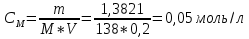 Находим титр: 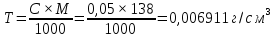 Молярная концентрация эквивалентов или нормальность - это молярность, умноженная на заряд иона (2- для карбоната или 2*+1 для ионов калия) . Нормальность р-ра: 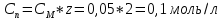 8. На титрование 200 см3 воды израсходовано 2,60 см3 раствора HCl. Титр раствора HCl равен 0,004023 г/см3. Определите карбонатную жесткость воды. Ответ: 1,43 ммоль/л. Решение: 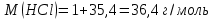 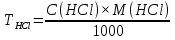 Отсюда 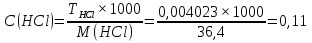 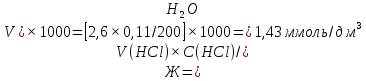 9. Как можно обнаружить катионы Al3+ и Cr3+ при их совместном присутствии в растворе? Напишите соответствующие уравнения реакций. Решение: Al 3+ + 3NH3 *3H2O = Al(OH)3↓+3NH4 + Аммиак осаждает из растворов солей алюминия белый студенистый осадок гидроксида алюминия. Осадок растворим как в кислотах, так и в щелочах. Cr 3+ + 3NH3 *3H2O = Cr(OH)3↓+3NH4 + Аммиак осаждают Cr3+ в виде гидроксида серо-зеленого цвета. |
