|
|
проверка. Проверка закона изотермического процесса Бойля - Мариотта (2). Закон для любой постоянной массы газа (а значит, и для одного моля газа) имеет вид
2.01. Проверка закона изотермического процесса Бойля -‑ Мариотта
Установка моделирует лабораторную работу «Проверка закона изотермического процесса Бойля - Мариотта».
Цель работы: экспериментальным путем проверить верность закона Бойля – Мариотта (доказать постоянную PV).
Краткая теория
Для реальных и идеальных газов, уравнение состояния можно описать тремя параметрами P, V, T и получить уравнение состояния идеального газа:
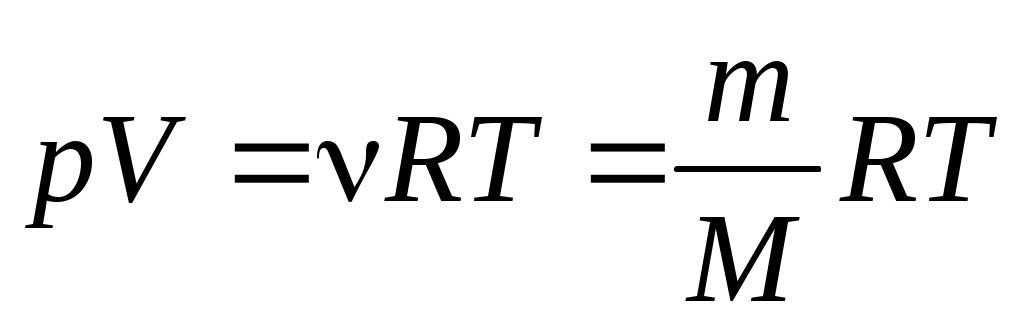 . (1.1) . (1.1)
Это соотношение может принять такой вид (с учетом для одного моля любого газа):
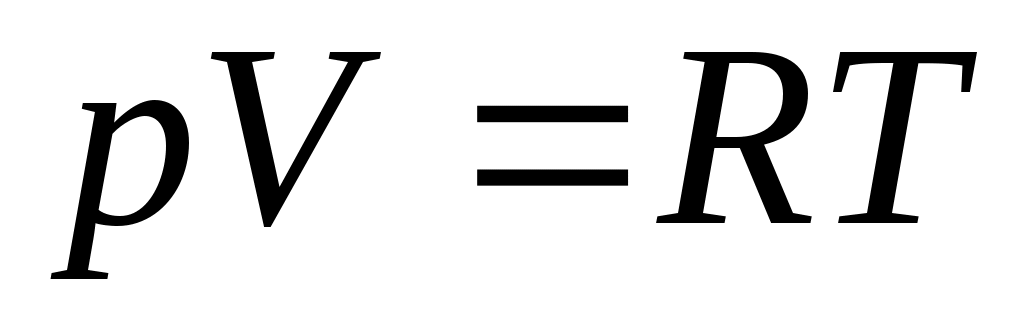 . .
В 1834 году, физиком Бенуа Поль Эмиль Клапейрон, было открыто уравнение устанавливающее зависимость между давлением, объемом и температурой газа. Это уравнение имеет вид:
pV = (ν1 + ν2 + ν3 + ...)RT.
В форме (1.1) оно было впервые записано Дмитрием Ивановичем Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона – Менделеева.
Объединенный газовый закон для любой постоянной массы газа (а значит, и для одного моля газа) имеет вид:
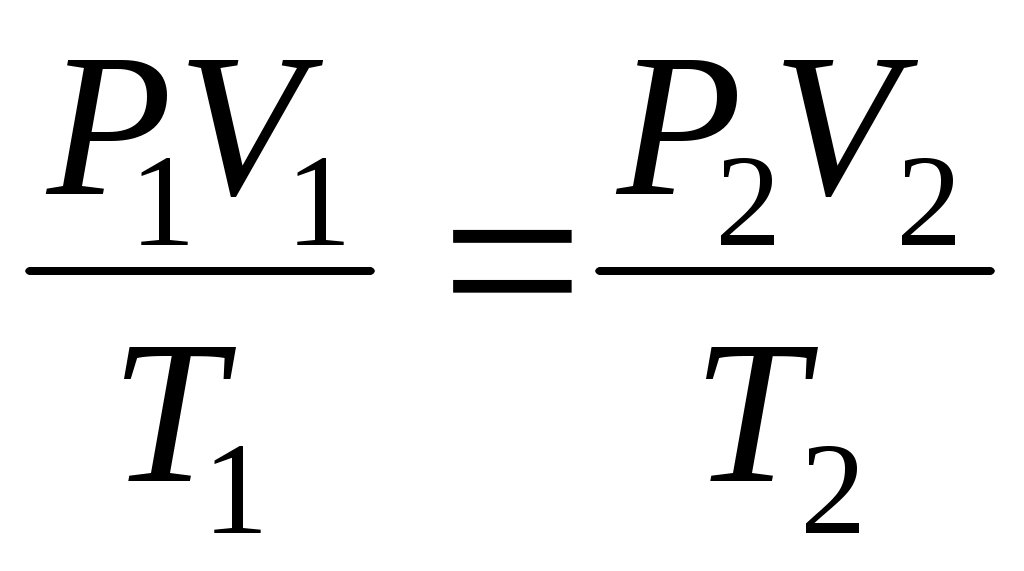 , ,
или
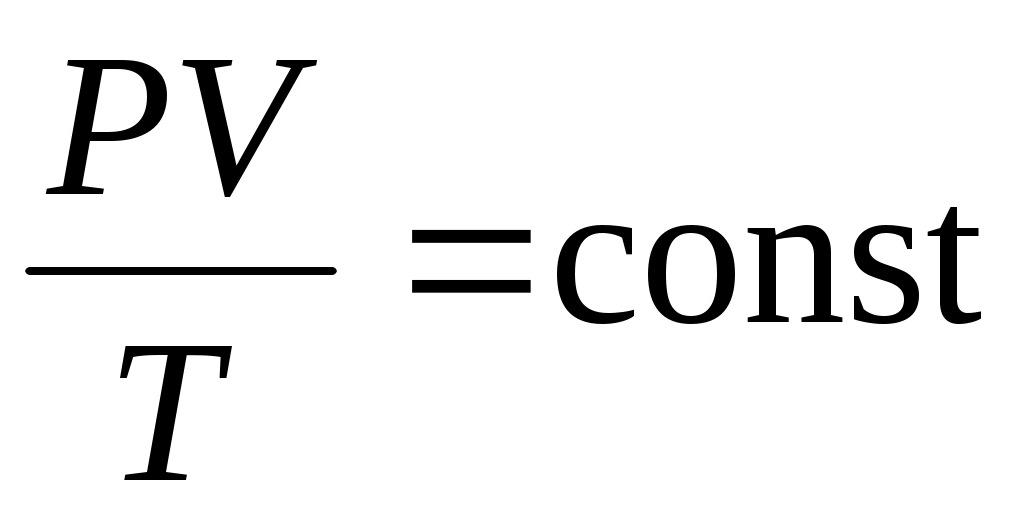 . .
Необходимо выделить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо исследованы опытным путем. Поэтому уравнение 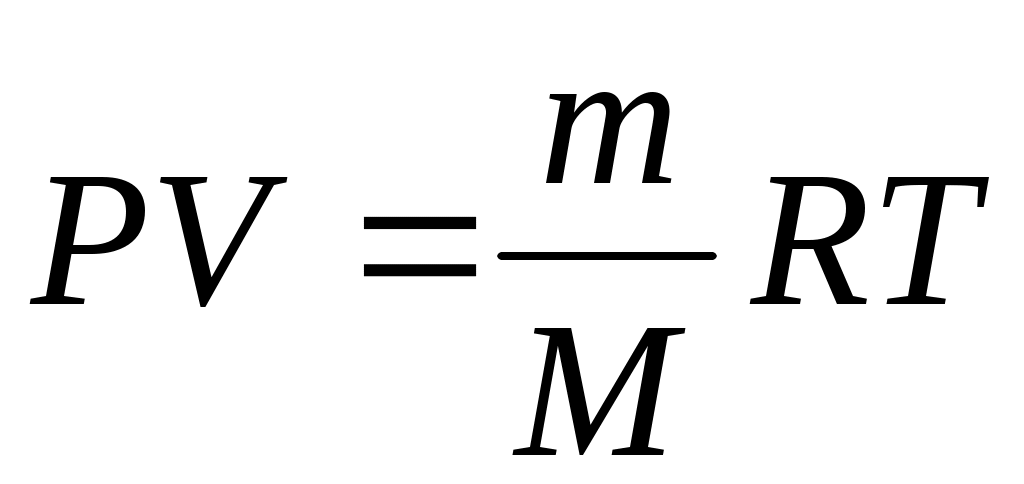 можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории. можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (P, V и T). Процессы могут быть изображены на диаграмме состояний (например, в координатах P, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние.
Интерес представляют процессы, в которых один из параметров (P, V или T) остается неизменным. Такие процессы называются изопроцессами.
Для пояснения приведем пример.
Возьмем цилиндрический сосуд с плотно притертым поршнем. Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако если охлаждая сосуд при сжатии газа или нагревая при расширении можно достичь того, что температура будет постоянной при изменениях объема и давления, такой процесс называется изотермическим (Т = const).
Предоставим газу возможность расширяться и производить при этом работу против сил внешнего давления. Это можно осуществить следующим образом. Пусть в большой бутыли находится сжатый воздух, имеющий комнатную температуру. Сообщим бутыль с внешним воздухом, дадим воздуху в бутыли возможность расширяться, выходя из небольшого отверстия наружу, и поместим в струе расширяющегося воздуха термометр. Термометр покажет температуру, заметно более низкую, чем комнатная, а что будет указывать на понижение температуры воздуха в струе.
Следовательно, сжатие газа внешней силой вызывает его нагревание, а расширение газа сопровождается его охлаждением.
Из уравнения 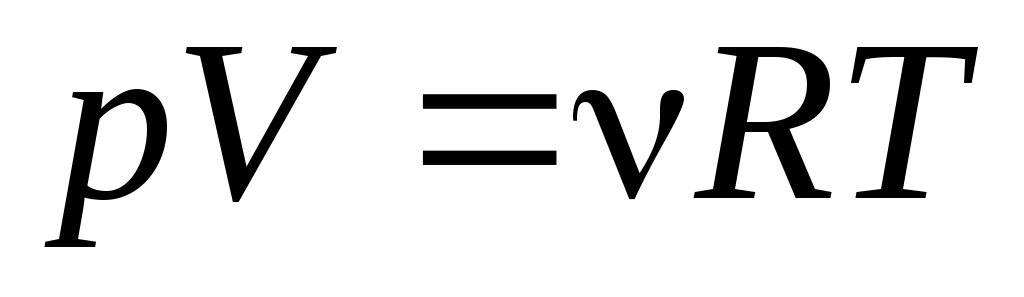 состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления P газа на его объем V должно оставаться постоянным: состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления P газа на его объем V должно оставаться постоянным:
pV = const
Процесс изменения давления и объема газа при постоянной температуре называется изотермическим процессом.График зависимости давления газа от его объема при изотермическом процессе называется изотермой. На плоскости (P, V) изотермы изображаются при различных значениях температуры T семейством гипербол P 1 / V (рис. 1.1).
Так как коэффициент пропорциональности в этом соотношении увеличивается с ростом температуры, изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры.
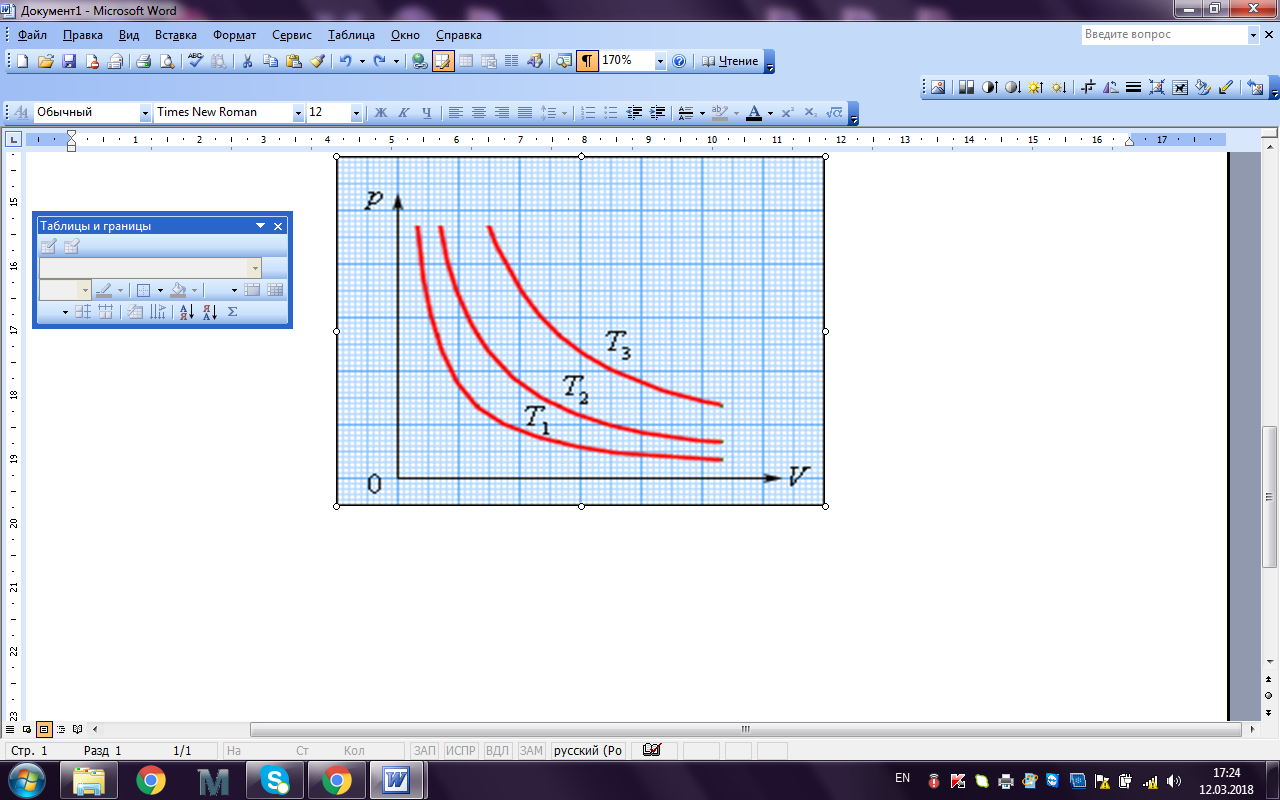
|
Рис. 1.1. Семейство изотерм на плоскости (p, V): T3 > T2 > T1
|
Уравнение изотермического процесса, выражающее зависимость давления от объема газа при постоянной температуре было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта
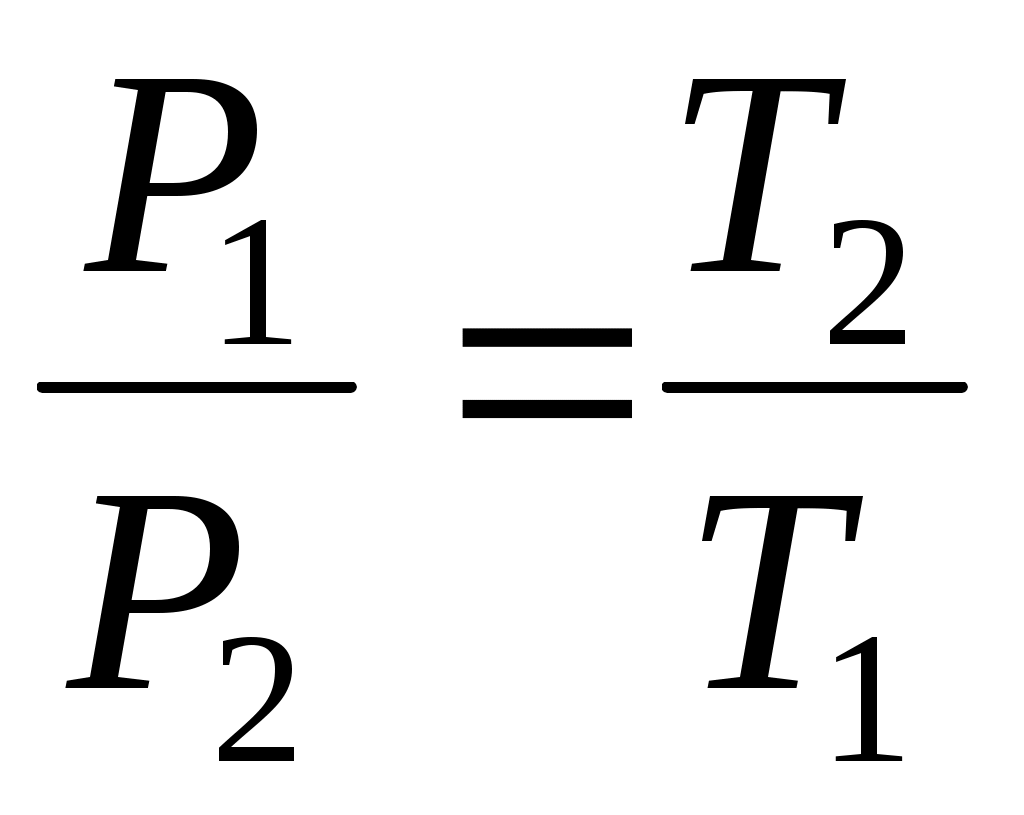 . .
Однако закон Бойля-Мариотта перестает оправдываться, если перейти к большим давлениям.
Ход работы
Запустить виртуальный стенд.
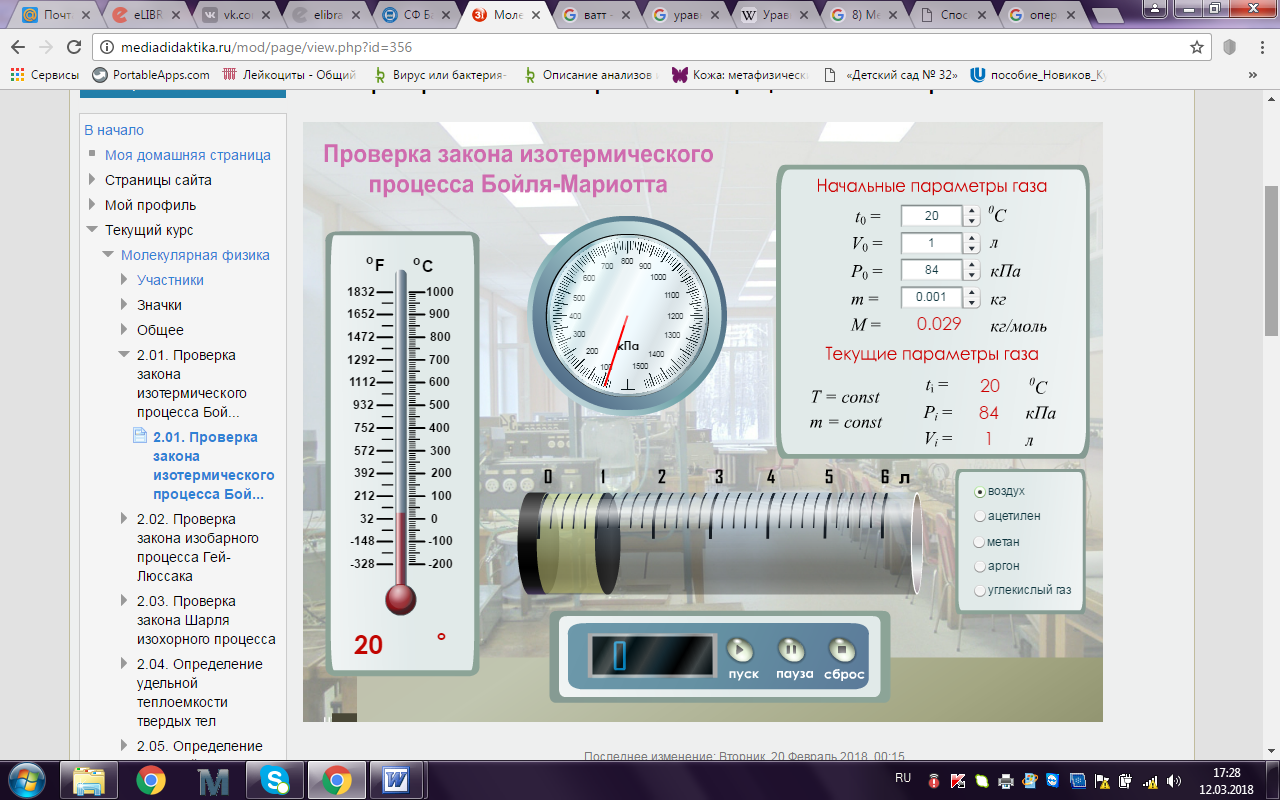
Установить начальные параметры газа: давление P0, температуру t0 и объем V0.
Выбрать для исследования газ из пяти возможных: воздух, ацетилен, метан, аргон, углекислый газ.
Нажать на кнопку «Пуск» для начала нагревания газа.
При достижении кратных температур или давлений останавливать нагрев кнопкой «Пауза».
Снять показания установившегося объема газа Vi и давления Pi и найти произведение РiVi.
Продолжить нагрев, нажав на кнопку «Пуск».
Вновь останавливать нагрев кнопкой «Пауза».
Записать значения конечного объема Vi при увеличении давления Pi.
Найти произведение РiVi и убедиться в их примерном равенстве, т.е. в справедливости закона Бойля‑Мариотта.
Определить оценку абсолютной и относительной погрешностей измерения.
Данные исследования занести в таблицу.
№, п/п
|
газ
|
М, кг/моль (молярная масса)
|
m, кг (масса газа)
|
Начальные показатели
|
P0, кПа (давление)
|
V0, м3 (объем)
|
t0, С (температура по Цельсии)
|
T0, К (температура Кельвина)
|
1
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Конечные показатели
|
РiVi,
кПа м3
|
Р0V0,
кПа м3
|
(PV),
кПа м3
|
(PV),
%
|
Рi, кПа
(давление)
|
Vi, м3 (объем)
|
ti, С
(температура по Цельсию)
|
Ti, К
(температура Кельвина)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сформулировать выводы.
Контрольные вопросы
Записать уравнение состояния идеального газа.
Объяснить в чем состоит суть закона Бойля – Мариотта.
Зарисовать график изотермического процесса, и рассказать в чем его отличие от других изопроцессов.
Каким физиком было получено уравнение устанавливающее связь между давлением, объемом и температурой газа? Записать это уравнение.
Из чего состоит экспериментальная установка? Для чего служат те или иные приборы?
Запишите основные приборы и оборудование, необходимые для проведения данной работы.
Список литературы
1. Курс физики. Т. 1: Механика. Молекулярная физика / И.В. Савельев. – М.: Наука, 2019.
2. Молекулярная физика / А.К. Кикоин, И.К. Кикоин. – М.: Наука, 1976.
3. Лабораторный практикум по физике / Под ред. А.С. Ахматова – М.: «Высшая школа», 1980.
4. Техническое описание экспериментальной установки ФПТ1-8.
5. Практические рекомендации по обработке результатов измерений: Методические указания / Сост.: Л.П. Муркин, Н.В. Мышкина. – Куйбышев: КуАИ, 1992. . |
|
|
 Скачать 0.93 Mb.
Скачать 0.93 Mb.

