Отчёт. Закон эквивалентов
 Скачать 40.42 Kb. Скачать 40.42 Kb.
|
|
Цель работы: Усвоить понятие о химическом эквиваленте и научиться определять эквивалентные массы веществ. Краткое теоретическое содержание: Эквивалент вещества – это такое количество данного вещества, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Эквивалентная масса вещества – это масса одного эквивалента данного вещества. Масса вещества и количество эквивалентов связаны уравнением: n 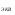 = =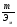 . .Закон эквивалентов: Массы (или объемы) реагирующих веществ пропорциональны молярным массам эквивалентов (или эквивалентным объемам) этих веществ, 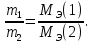 Ход эксперимента: 1. Наполнить водой кристаллизатор и бюретку (стеклянную трубку с делениями и краном для выпуска жидкости внизу). Проверить, плотно ли закрыт кран бюретки. 2. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в кристаллизатор с водой. Палец убрать под водой, при этом вода из бюретки не вытечет. 3. Закрепить бюретку в штативе. Уровень воды в ней не должен быть выше крайнего деления шкалы. 4. В колбу Вюрца (круглодонная колба боковым отводом) при помощи мерного цилиндра отобрать 15-20 мл соляной кислоты. 5. Вытереть насухо горло колбы фильтром. 6. Расположив колбу горизонтально, поместить в её горло навеску металла и плотно закрыть колбу пробкой. 7. Стеклянную трубку бокового отвода колбы Вюрца соединить с расположенной под водой частью бюретки. 8. Отметить уровень жидкости в бюретке. Показания следует снимать по положению нижнего края вогнутого мениска жидкости при нахождении его на уровне глаз. Цифры на шкале бюретки - объём в миллилитрах (мл), при снятии показаний необходимо учитывать, что бюретка со шкалой перевёрнута. 9. Перевести колбу в вертикальное положение, сбрасывая навеску металла в кислоту. В результате реакции выделяется водород, который вытесняет воду из бюретки. Во время протекания реакции не следует держать колбу в руках во избежание её нагрева и искажении результатов за счёт теплового расширения газа. 10. Когда выделение пузырьков водорода прекратится, отметить конечный уровень воды в бюретке. 11. При помощи полоски миллиметровой бумаги измерить высоту столба воды в бюретке от нижнего края мениска до уровня воды в кристаллизаторе. 12. По показаниям барометра и термометра определить атмосферное давление и температуру в лаборатории. Экспериментальные данные: Масса навески металла mMe = 0,0122 г Объём соляной кислоты VHCl = 7 мл Объём воды в бюретке в начале эксперимента V1 = 16,9 мл Объём воды в бюретке по окончании эксперимента V2 = 3,6 мл Объём выделившегося водорода Vизм = V1 – V2 = 13,3 мл Высота столба воды в бюретке h = 163 мм Атмосферное давление в лаборатории Pатм = 757 мм. рт. ст. = 100925 Па Температура в лаборатории T =25 °C = 298 К Основные расчётные формулы: Давление водорода: P =Pатм –P  –P –P P1 – давление столба воды в бюретке, Па, P 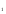 =9,8hdaq, где daq – плотность воды, равная 1 г/см3; 9,8 – переводной коэффициент из мм. вод. ст. в Па; h – высота столба жидкости в бюретке, м, P =9,8hdaq, где daq – плотность воды, равная 1 г/см3; 9,8 – переводной коэффициент из мм. вод. ст. в Па; h – высота столба жидкости в бюретке, м, P – давление насыщенного пара воды, Па (данные из таблицы). – давление насыщенного пара воды, Па (данные из таблицы).Масса выделившегося водорода: m(H  ) = ) = 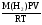 , ,где 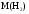 - молярная масса водорода, равная 2 г/моль; V- объем водорода, м3, R - универсальная газовая постоянная, равная 8,314 Дж/моль·K. - молярная масса водорода, равная 2 г/моль; V- объем водорода, м3, R - универсальная газовая постоянная, равная 8,314 Дж/моль·K.Формула для расчёта эквивалентной массы металла по закону эквивалентов: 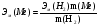 , ,где Эм(H) - эквивалентная масса водорода, равная 1г\экв. Общая формула для вычисления эквивалентных масс веществ: Эм = 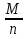 , ,где M - молярная масса вещества, г/моль; n - число эквивалентов в 1 моле вещества. Формула относительной погрешности эксперимента:  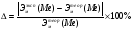 . .Обработка результатов эксперимента: 1) Давление водорода: P  = 9,8 · h · daq = 9,8 м/с2 · 0,16 м · 1000 кг/м3 = 9,8 · h · daq = 9,8 м/с2 · 0,16 м · 1000 кг/м3P  = 3172,5 Па (данные из таблицы) = 3172,5 Па (данные из таблицы)P = Pатм – P  – P – P = 100925 Па – 1597,4 Па – 3172,5 = 96155,1 Па = 100925 Па – 1597,4 Па – 3172,5 = 96155,1 Па2) Масса выделившегося водорода: m(H2) = 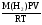 = = 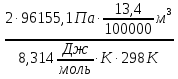 = 0,00104 г = 0,00104 г3) Эквивалентная масса металла: 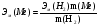 = = 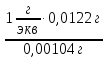 = 11,73 г/экв = 11,73 г/экв4) Молярная масса металла, тип металла (степень окисления металла = 2): 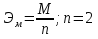 M = Э 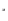 · 2 = 11,73 г/экв · 2 = 23,46 г/моль · 2 = 11,73 г/экв · 2 = 23,46 г/моль  металл - Mg металл - Mg5) Точное значение эквивалентной массы металла и относительная погрешность эксперимента: 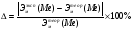 = = 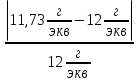 = 2% = 2%Вывод: На основе проведённых вычислений можно сделать вывод, что металл, который я определял – магний. Относительная погрешность опыта составляет 2%, что подтверждает правильность сделанного заключения. |
