Химия вар50. Закон эквивалентов (задания 120) 11. На восстановление 3,6 г оксида металла пошло 1,67 л водорода, измеренного при нормальных условиях. Рассчитать эквивалентные массы металла и оксида
 Скачать 250.53 Kb. Скачать 250.53 Kb.
|
Закон эквивалентов (задания 1-20)11. На восстановление 3,6 г оксида металла пошло 1,67 л водорода, измеренного при нормальных условиях. Рассчитать эквивалентные массы металла и оксида. Решение. Химический эквивалент – это условная, или реальная, частица вещества (это часть молекулы, иона и т.д.), которая в кислотно-основной реакции эквивалентна (равноценна, тождественна) по своему химическому действию одному катиону водорода (1Н+) или в окислительно-восстановительной реакции ОВР одному электрону (1ē). МеО + Н2 → Ме + Н2О Н20 – 2ē → 2Н+, z = 2 fэкв(Н2) = 1 / z = ½. Vэкв(Н2) = ½ ‧ Vm. Закон эквивалентов – массы (объемы) реагирующих веществ относятся между собой как их молярные массы эквивалентов (как их молярные объемы эквивалентов). По закону эквивалентов: n(МеО) = n(Н2) m(МеО) / Мэкв(МеО) = V(Н2) / Vэкв(Н2) Мэкв(МеО) = Vэкв(Н2) ‧ m(МеО) / V(Н2) Мэкв(МеО) = 22,4 л/моль ‧ 3,6 г / (2 ‧ 1,67 л) Мэкв(МеО) = 24,14 г/моль. Ме + О2 → МеО О20 – 2‧2ē → 2О2–, z = 4 fэкв(О2) = 1 / z = 1/4 Мэкв(О) = М(О) ‧ fэкв(О2) = 32 / 4 = 8 г/моль. Мэкв(МеО) = Мэкв(Ме) + Мэкв(О)Мэкв(Ме) = Мэкв(МеО) – Мэкв(О)Мэкв(Ме) = 24,14 – 8,00 = 16,14 г/моль.Ответ: эквивалентные массы металла и оксида соответственно равны Мэкв(Ме) = 16,14 г/моль и Мэкв(МеО) = 24,14 г/моль. Строение атома (задания 21-40)33. Почему марганец проявляет металлические свойства, а хлор – неметаллические? Дайте ответ, исходя из строения атомов этих элементов. Марганец находится в 4 периоде в VII группе побочной подгруппы. 25Мn 1s22s22р63s23р64s23d5 Электронно-графическая схема распределения электронов по предвнешнему и внешнему уровню марганца:   3s 3р 3d 4s 3s 3р 3d 4s
Марганец в возбужденном состоянии:  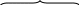 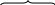 3s 3р 3d 4s 4р 3s 3р 3d 4s 4р
имеет семь неспаренных электронов, высшая степень окисления +7. В основном состоянии марганец имеет 2 электрона на внешнем 4s-уровне, и 5 электронов на 3d-уровне. Все d-элементы являются металлами. Марганец относится к амфотерным металлам. Проявляет основные свойства в степени окисления +2, +3 (Мn(ОН)2 – гидроксид марганца II), в степени окисления +4 – амфотерные свойства (Мn(ОН)4 – гидроксид марганца IV), кислотные свойства в степени окисления +6 (Н2МnО4 – марганцовистая кислота), +7 (НМnО4 – марганцевая кислота). Хлор находится в 3 периоде в VII группе главной подгруппы. 17Cl 1s22s22р63s23р5 Электронно-графическая схема распределения электронов по предвнешнему и внешнему уровню хлора: 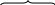 3s 3р 3s 3р
Хлор в возбужденном состоянии: 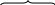 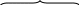 3s 3р 3d 3s 3р 3d
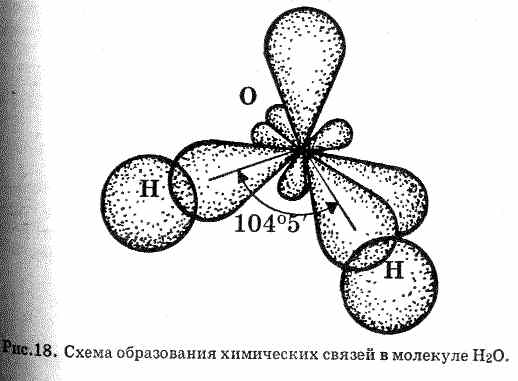
имеет семь неспаренных электронов, высшая степень окисления +7. В основном состоянии хлор имеет 5 электронов на внешнем 3р-уровне. Поэтому он относится к неметаллам, так присоединить 1 электрон для завершения внешнего уровня легче, чем отдать 5 р-электронов. Проявляет кислотные свойства в степени окисления +1 (НСlО – хлорноватистая кислота), +3 (НClО2 – хлористая кислота), +5 (НClО3 – хлорноватая кислота), +7 (НClО4 – хлорная кислота). Химическая связь. Строение вещества (задания 41-60)55. Изобразить в виде схем строение молекул: Cl2, H2O, CaS. Какой тип химической связи наблюдается в каждой из них? Решение. Молекула хлора образована двумя атомами хлора с одинаковой электроотрицательностью – связь ковалентная неполярная. 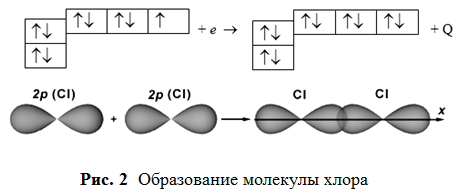 Перекрывание р-облаков происходит вдоль оси, образуется σ-связь. Линейная молекула. Перекрывание р-облаков происходит вдоль оси, образуется σ-связь. Линейная молекула. Молекула воды образована двумя атомами водорода и одним атомом кислорода с разной электроотрицательностью (ΔЭО = 1,40) – связь ковалентная полярная. Кислород О Водород Н ↑ ↑ 2s 2р 1s 1s
Электрон с 1s-орбитали водорода переходит на 2р-орбиталь кислорода. Н2О 2s 2р
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ↓↑ | | | |
Сера S
3s 3р
| ↓↑ | ↓↑ | ↓ | ↓ |
2 электрона с 4s-орбитали кальция переходят на 3р-орбиталь серы.
Кальций Са2+
4s 4р
| | | | |
Сера S2–
3s 3р
| ↓↑ | ↓↑ | ↓ | ↓ |
Координационная геометрия у катиона Са2+ и аниона S2– – октаэдрическая.
Кристаллическая структура – кубическая (как у хлорида натрия).
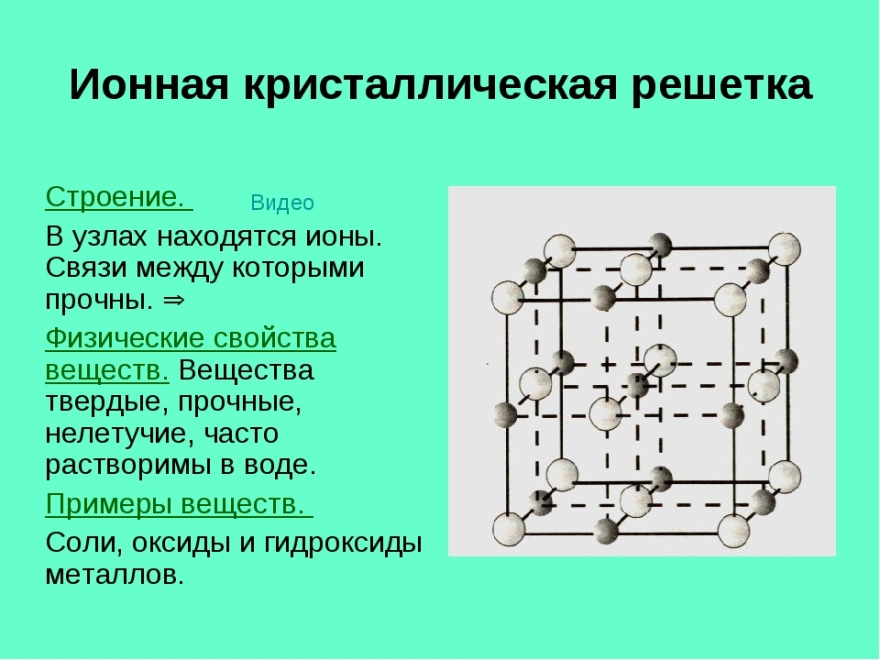
Черные шарики Са2+, белые – S2– (атомный радиус серы больше, чем у кальция, 3 энергетических уровня).
Химическая кинетика. Химическое равновесие (задания 61-80)
77. При 1000℃ константа равновесия реакции FeO(ТВ) + CO(Г) ↔ Fe(ТВ) + CO2(Г) равна 0,5. Чему равны равновесные концентрации СО и СО2, если их начальные концентрации следующие: [СО]0 = 0,05 моль/л; [СО2]0 = 0,025 моль/л.
Решение. Химическое равновесие – состояние системы реагирующих веществ, при котором скорость прямой и обратной реакций равны. Химическое равновесие является динамическим. Это значит, что в системе идут и прямая, и обратная реакции, но, так как их скорости равны, концентрации исходных веществ и продуктов остаются неизменными. Эти концентрации называются равновесными.
По мере течения реакции концентрация исходных веществ уменьшается, а концентрация продуктов реакции увеличивается. Изменение концентрации идет в строгом соответствии со стехиометрическими соотношениями, которые берутся из уравнения реакции. В равновесии участвуют как газообразные, так и твердые вещества, но изменение концентрации твердых веществ незначительно влияет на константу равновесия.
Примем изменение концентрации [СО] до равновесия за х моль/л тогда в момент равновесия его концентрация станет 0,05 – х, а у СО2 увеличится на х, т.е. будет 0,01 + х. Согласно уравнению реакции n(CO) = n(CO2). Для момента равновесия:
Кравн = [СО2]равн / [СО]равн
Подставляем значения:
0,5 = 0,01 + х / (0,05 – х)
0,025 – 0,5х = 0,01 + х
1,5х = 0,015
х = 0,01 (моль/л)
Тогда в момент равновесия:
[СО2]равн = 0,01 + 0,01 = 0,02 моль/л
[СО]равн = 0,05 – 0,01 = 0,04 моль/л.
Ответ: [СО]равн = 0,04 моль/л и [СО2]равн = 0,02моль/л.
Способы выражения концентрации растворов (задания 81-100)
98. Плотность 15%-ного раствора серной кислоты равна 1,105 г/см3. Вычислить молярную, молярную эквивалента и моляльную концентрации H2SO4 в растворе.
Решение. Массовой долей (ω) называется отношение массы растворенного вещества к массе раствора, она выражена в долях единицы:
ω = m (в-ва) / m(р-ра).
Массовая доля может быть выражена в процентах (ω % или С% = ω · 100), промилле (‰ = ω · 103) и миллионных долях (млн−1 или ppm1= ω · 106).
По условию задачи масса раствора не дана, известна плотность раствора:
m(р-ра) = V(р-ра) ‧ ρ(р-ра),
m (в-ва) = ω ‧ V(р-ра) ‧ ρ(р-ра)
Массовая доля дана в %, V(р-ра) = 0,1 л.
С% = ω · 100
Концентрацией раствора называется количество (моль) растворенного вещества, содержащегося в определенном массовом или объемном количестве раствора или растворителя.
Молярная концентрация выражается числом молей растворенного вещества, содержащегося в 1 литре раствора [моль/л] или [М].
СМ = n(в-ва) / V(р-ра) [моль/л];
n(в-ва) = m (в-ва) / М(в-ва).
СМ = m (в-ва) / М(в-ва) ‧ V(р-ра)
В этом случае V(р-ра) = 1 л.
СМ = ω ‧ 0,1 ‧ ρ(р-ра) ‧ 100 / М(в-ва) ‧ 1
СМ = ω ‧ 0,1 ‧ ρ(р-ра) ‧ 100 / М(в-ва) ‧ 1
СМ = ω ‧ ρ(р-ра) ‧ 10 / М(в-ва)
СМ = 15 ‧ 1,105 ‧ 10 / 98
СМ = 1,691 моль/л.
Молярная концентрация эквивалента вещества (эквивалентная или нормальная) выражается числом моль эквивалентов растворенного вещества, содержащегося в одном литре раствора [моль/л] или [н].
СN = nЭ / V(р-ра) [н],
nЭ(в-ва) = m(в-ва) / МЭ(в-ва).
МЭ(в-ва) = М(в-ва) / z.
В серной кислоте Н2SO4 содержится 2 атома водорода:
МЭ(Н2SO4) = М(Н2SO4) / z = 98 / 2 = 49 г / моль.
СN = nЭ / V(р-ра)
СN = ω ‧ ρ(р-ра) ‧ 10 / (М(Н2SO4) / z)
СN = ω ‧ ρ(р-ра) ‧ 10 ‧ 2 / (М(Н2SO4)
СN = СМ ‧ 2 = 1,691 ‧ 2 = 3,382 моль/л.
Моляльная концентрация выражается числом молей растворенного вещества в одном килограмме растворителя [моль/кг]. Растворитель – вода, плотность воды 1 г/см3.
Сm = n(в-ва) / m(р-ля) [моль/кг].
Сm = m(в-ва) / М(в-ва) / (V(р-ля) ‧ ρ(р-ля)).
В 1 литре раствора серной кислоты, массой 1,105 кг содержится 1,691 моль серной кислоты, массой 1,691 ‧ 98 = 165,750 г.
Масса растворителя равна 1105,00 – 165,750 = 939,25 г.
В 1л раствора 15% Н2SO4 содержится 165,75 г Н2SO4 и 939,25 г воды.
Пересчитываем на 1 кг воды:
1,691 / 935,25 = х / 1000,00
х = 1,691 ‧ 1000,00 / 935,25
х = 1,808.
Сm = 1,808 моль/кг Н2O.
Ответ: молярная концентрация серной кислоты равна СМ = 1,691 моль/л, молярная концентрация эквивалента серной кислоты равна СN = 3,382 моль/л и моляльная концентрации H2SO4 в растворе воды равна Сm = 1,808 моль/кгН2O.
Гидролиз солей (задания 101-120)
119. Написать в ионном и молекулярном виде уравнения реакций гидролиза (I ступень) нитрита калия и хлорида аммония. Укажите реакцию среды (рН).
Решение. Нитрит натрия КNO2 – соль, образованная сильным основанием КOH и слабой кислотой HNO2. В данном случае гидролиз протекает по аниону.
Краткое ионное уравнение:
NO2– + НОН ↔ HNO2 + ОН–, среда щелочная рН > 7.
Полное ионное уравнение: К+ + NO2– + НОН ↔ H+ + NO2– + К+ + ОН–.
Молекулярное уравнение: КNO2 + НОН ↔ HNO2 + КОН.
Хлорид аммония NН4Сl – соль, образованная сильной кислотой HСl и слабым основанием NН4OH. В данном случае гидролиз протекает по катиону.
Краткое ионное уравнение:
NН4+ + НОН ↔ NН4OH + Н+, среда кислая рН < 7.
Полное ионное уравнение: NН4+ + Сl– + НОН ↔ H+ + Сl– + NН4+ + ОН–.
Молекулярное уравнение: NН4Сl + НОН ↔ NН4OH + HСl.
Комплексные соединения (задания 121-140)
1. Назвать комплексное соединение.
2. Указать значение координационного числа.
3. Написать формулу комплексного соединения в виде молекулярных формул соединений первого порядка (простых солей).
4. Написать уравнения диссоциации комплексного соединения.
5. Составить выражение константы нестойкости комплексного иона (комплекса).
6. Указать в первом или во втором комплексном соединении комплексный ион является более слабым электролитом (см. в приложении табл.9).
Таблица 2
| Номер варианта | Комплексное соединение | |
| 1 | 2 | |
| 140 | [Co(H2O)4(NH3)2]Cl3 | [Cr(NH3)3(H2O)2Br]Br2 |
Решение.
1. 1). [Co(H2O)4(NH3)2]Cl3 – хлорид диамминтетрааквакобальта (III).
2). [Cr(NH3)3(H2O)2Br]Br2 – бромид бромодиакватриамминхрома (III).
2. Значение координационного числа 1). кобальта равно 6 (6 лигандов: 4-H2O и 2-NH3).
2). КЧ = 6, у Cr 6 лигандов:1-Br; 2-H2O; 3-NH3.
3. Формула комплексного соединения в виде молекулярных формул соединений первого порядка (простых солей):
1). CoCl3 и NH4Cl. 2) CrBr3 и NH4Br
4. Уравнение диссоциации комплексного соединения:
1) [Co(H2O)4(NH3)2]Cl3 ↔ [Co(H2O)4(NH3)2]3+ + 3Сl–
2) [Cr(NH3)3(H2O)Br]2+ + 2Br–.
5. Составить выражение константы нестойкости комплексного иона (комплекса). Свободные молекулы воды не включаются в выражение константы нестойкости.
1) [Co(H2O)4(NH3)2]3+ ↔ Co3+ + 4H2O + 2NH3
Кнест = [Co3+] ‧ [NH3]2 / [Co(H2O)4(NH3)2]3+
2) [Cr(NH3)3(H2O)2Br]2+ ↔ Cr3+ + 3NH3 + 2H2O + Br–.
Кнест = [Cr3+] ‧ [NH3]3 ‧ [Br–] / [Cr(NH3)3(H2O)Br]2+
6. Указать в первом или во втором комплексном соединении комплексный ион является более слабым электролитом (см. в приложении табл.9).
Константы нестойкости комплексных ионов характеризуют прочность (устойчивость) внутренней сферы комплексного соединения. Чем меньше константа нестойкости, тем устойчивее комплекс, т. е. тем меньше концентрация продуктов его распада.
Кнест ([Co(H2O)4(NH3)2]3+) = 4‧10–4
Константа стойкости (нестойкости) аммиакатного комплекса хрома 3+ не дана в справочниках. В состав комплексного иона [Cr(NH3)3(H2O)2Br]2+ помимо нейтральных лиганд NH3 и H2O входит Br–. Благодаря наличию аниона брома, [Cr(NH3)3(H2O)2Br]2+ является более сильным электролитом, чем [Co(H2O)4(NH3)2]3+. Т.е. [Co(H2O)4(NH3)2]3+ является более слабым электролитом.
Окислительно-восстановительные реакции (задания 141 -160)
157. Составить полное уравнение реакции. Коэффициенты подобрать методом электронно-ионного баланса.
MnS2 + HNO3 + PbO2 → H2MnO4 + PbSO4 + Pb(NO3)2;
Решение. Mn+4S2–2 + HNO3 + Pb+4O2 → H2Mn+6O4 + Pb+2S+6O4 + Pb+2(NO3)2
Марганец окисляется со степени окисления +4 до степени +6.
Сера окисляется со степени окисления –2 до степени +6.
Свинец восстанавливается со степени окисления +4 до степени +2.
В левой части уравнения 1 соединение со свинцом, в правой части уравнения – 2.
В левой части уравнения HNO3 (ион водорода и нитрогруппа), в правой части уравнения H2MnO4 (ион водорода и манганат-ион).
M

 n4+ – 2ē → Mn6+ 2 18 1 восстановитель, окисляется
n4+ – 2ē → Mn6+ 2 18 1 восстановитель, окисляется2S2– – 2‧8ē → 2S6+ 16 восстановитель, окисляется
Pb4+ + 2ē → Pb2+ 2 2 9 окислитель, восстанавливается
MnS2 + 14HNO3 + 9PbO2 → H2MnO4 + 2PbSO4 + 7Pb(NO3)2 + 6Н2О.
В уравнение в правую часть добавляем воду, для баланса ионов водорода и кислорода.
Коррозия металлов (161-180)
179. Приведите пример металла катодного покрытия для изделия из стали. Составьте уравнения реакций катодного и анодного процессов, протекающих при коррозии этого изделия в аэрированной воде.
Решение. Основной компонент стали – железо. Стандартный электродный потенциал железа E0Fe2+/Fe = ‒0,440 В.
Катодным покрытием для железа будет металл, чей потенциал больше, чем потенциал железа. Например, олово, E0Sn2+/Sn = ‒0,136 В. При покрытии железа оловом получаем луженое железо.
В аэрированной воде присутствует кислород, среда нейтральная (рН = 7). При нарушении целостности оловянного покрытия будет происходить электрохимическая коррозия.
Так как железо электрохимически более активно, чем олово, оно будет окисляться (коррозировать). На олове будет протекать восстановительный процесс (в нейтральной среде – кислородная деполяризация):
О2 + 2Н2О + 4ē → 4ОН‒ , Е0 = 0,82 В (в нейтральной среде).
А: Fe0 ‒ 2ē → Fe2+
К: О2 + 2Н2О + 4ē → 4ОН‒
Суммарный процесс:
Fe0 + ½О2 + Н2О + 2ē → Fe(ОН)2.
Электролиз растворов солей (задания 181-200)
181-200. Через раствор электролита пропустили ток силой хА в течение у минут. Написать уравнения электродных процессов, происходящих при электролизе (инертный анод) и указать какие продукты и в каком количестве были получены.
Таблица 3
| № | Раствор электролита | Сила тока, А (х) | Время электролиза, мин (у) |
| 199 | KNO2 | 6,0 | 60 |
Решение. В водном растворе:
КNO2 (р) ↔ К+ + NO2– , H2O ↔ ОН- + H+
Вместо катиона калия на инертном катоде восстанавливается водород из воды: 2H2O + 2ē → H2↑ + 2ОН–.
На инертном аноде нитрит-ион окисляется в нитрат-ион:
NO2– + H2O − 2ē → NO3– + 2Н+
К(–): 2H2O + 2ē → H2↑ + 2ОН–
А(+): NO2– + H2O − 2ē → NO3– + 2Н+
Суммарное уравнение: 2H2O + NO2– + H2O → H2↑ + 2ОН– + NO3– + 2Н+
Уравнение электролиза:
К
 NO2 + H2O электролиз КNO3 + H2↑.
NO2 + H2O электролиз КNO3 + H2↑.Согласно закону Фарадея, объем водорода, восстановившегося на катоде при электролизе водного раствора КNO2 с нерастворимым катодом:
V(Н2) = Vэкв(Н2) ‧ I ‧ t / F,
где V(Н2) – объем водорода, выделившегося на катоде;
Vэкв(Н2) – молярный объем эквивалента водорода;
I – сила тока, А;
t – время электролиза, с;
F – постоянная Фарадея, 96500 Кл/моль или 26,8 А·ч.
В восстановлении водорода на катоде из воды принимает участие 2 электрода, следовательно, Vэкв(Н2) = Vm / 2 = 22,4 / 2 = 11,2 л/моль.
V(Н2) = 11,2 л/моль ‧ 6А ‧ 1ч / 26,8 А‧ч = 2,5 л.
По уравнению реакции:
n(Н2) = n(КNO3)
m(КNO3) / Мэкв(КNO3) = V(Н2) / Vэкв(Н2)
m(КNO3) = V(Н2) ‧ Мэкв(КNO3) / Vэкв(Н2)
Мэкв(КNO3) = М(КNO3) / z = 101 / 2 = 50,5 г/моль.
m(КNO3) = 2,5 л ‧ 50,5 г/моль / 11,2 л/моль = 11,272 г.
Ответ: m(КNO3) = 11,272 г; V(Н2) = 2,5 л.
Гальванический элемент (задания 201-220)
210. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод – в 0,01 М растворе сульфата никеля.
Решение. Гальванический элемент, электроды которого сделаны из одного и того же металла будет работать при условии, что электроды будут опущены в растворы солей с разной концентрацией.
Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
Е = Е0 +
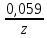 ‧ lgС, где
‧ lgС, гдеЕ0 – стандартный электродный потенциал металла; z – число электронов, принимающих участие в электрохимическом процессе; С – концентрация ионов металла в растворе его соли (при точных вычислениях – активность).
Определим электродные потенциалы никелевых электродов при разных концентрациях ионов серебра Ni2+, получим:
ЕNi2+/ Ni = Е0Ni2+/ Ni +
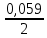 ‧ lg10–3 = –0,25 + 0,0295 ‧ (–3) = –0,3385 В;
‧ lg10–3 = –0,25 + 0,0295 ‧ (–3) = –0,3385 В;ЕNi2+/ Ni = Е0Ni2+/ Ni +
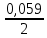 ‧ lg10–2 = –0,25 +
‧ lg10–2 = –0,25 + 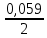 ‧ (–2) = –0,3090 В.
‧ (–2) = –0,3090 В.Для определения ЭДС гальванического элемента из потенциала катода (более положительного электрода) следует вычесть потенциал анода (более отрицательного электрода), получим:
ЭДС = Екатода – Еанода = –0,3090 – (–0,3385) = 0,0295 В.
Схема гальванического элемента, в котором один никелевый электрод находится в 0,001М растворе, а другой – в 0,01М растворе сульфата никеля имеет вид:
(–) Ni | Ni2+ (0,001М) || Ni2+ (0,01М) | Ni (+).
Ответ: 0,0295 В.
Жесткость воды (задания 221-240)
221-240. Рассчитать массу умягчителя, необходимого для умягчения х л воды, жесткость которой у. Вычислить жесткость, зная массу умягчителя. Написать реакцию умягчения в молекулярной и ионно-молекулярной форме с жесткой солью.
Таблица 4
| № п/п | Объем воды, л | Жесткая соль | Умягчитель | Жесткость воды, мэкв/л | Масса умягчителя, г |
| 232 | 400 | гидрокарбонат магния | гашеная известь | 20 | рассчитать |
Решение.
Жесткость природных вод обусловлена наличием в ней растворимых солей кальция (Са2+), магния (Mg2+) и железа(Fe2+). Различают следующие типы жесткости общую, карбонатную (временную, устранимую) и некарбонатную (постоянную, неустранимую). Все типы жесткости, мэкв/л, рассчитывают, применяя одно и то же выражение:
Ж = m(соли) / Мэкв (жесткой соли) · V воды или
Ж = m(умягчителя) / Мэкв(умягчителя) · V воды, где
Ж – жесткость воды, мэкв/л;
m – масса умягчителя, мг;
Мэкв – эквивалентная масса умягчителя, г/моль;
V – объем воды, л.
Отсюда масса умягчителя:
m(умягчителя) = Ж ‧ Мэкв(умягчителя) ·V воды
Молярная масса умягчителя – гашеной извести М(Са(ОН)2) = 74,09 г/моль, молярная масса эквивалента Мэкв(Са(ОН)2) = М(Са(ОН)2) / z; Мэкв(Са(ОН)2) = 74,09 / 2 = 37,05 г/моль.
m(Са(ОН)2) = Ж ‧ Мэкв((Са(ОН)2) ·V воды
m(Са(ОН)2) = 20 мэкв/л ‧ 37,05 г/моль ‧ 0,4 л = 296,40 мг.
Записываем реакцию умягчения в молекулярной форме:
Mg(НCО3)2 + Са(ОН)2 = MgCО3↓ + СaCО3↓ + 2Н2О
в ионной форме:
Mg2+ + 2НCО3– + Са2+ + ОН– = MgCО3↓ + СaCО3↓ + 2Н2О
Ответ: m(Са(ОН)2) = 296,40 мг.
Литература
1. Ахметов Н. С. Общая и неорганическая химия. Учеб. для вузов. – 4-е, изд. испр. – М.: Высш. шк., Изд. центр «Академия», 2001. – 743 с.
2. Глинка Н. Л. Общая химия: Учеб. пособие / Под ред. А. И. Ермакова. – 30-е изд., испр. – М.: Интеграл-Пресс, 2003. – 728 с.
3. Инцеди Я. Применение комплексов в аналитической химии. – Пер. с англ. – М.: Мир, 1979. – 376 с.
4. Комплексные (координационные) соединения: учебно-методическое пособие. Составитель: Гаджиев О.Б. – Нижний Новгород: Нижегородский государственный университет, 2016. – 33 с.
5. Лурье Ю.Ю. Справочник по аналитической химии. Справочное издание. – 6-е изд., перераб. и доп. – М.: Химия, 1989. – 448 с.
6. Романцева Л. М. и др. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец. вузов / Л. М. Романцева, З. Л. Лещинская, В. А. Суханова. – 2-е изд., перераб. и доп. – М.: Высш. школа, 1991. – 288 с.