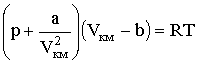Физхимия. КОЛЛОКВИУМ 2. Закон (принцип) соответственных состояний. Вириальное уравнение состояния. Термические и калорические коэффициенты
 Скачать 279.03 Kb. Скачать 279.03 Kb.
|
|
Термические и калорические уравнения состояния . Идеальный газ. Физический смысл модели. Отклонения от идеальности. Уравнение Ван-дер-Ваальса, его параметры и анализ. Критические параметры. Закон (принцип) соответственных состояний. Вириальное уравнение состояния. Термические и калорические коэффициенты. Ошибка! Недопустимый объект гиперссылки. Идеальный газ — это модель реального газа. Молекулы идеального газа представляют собой материальные точки, которые не взаимодействуют друг с другом на расстоянии, но взаимодействуют при столкновениях друг с другом или со стенками сосуда. При работе с идеальным газом можно пренебречь потенциальной энергией молекул (но не кинетической). Модель идеального газа В физике есть такое понятие, как модель. Модель — это что-то идеализированное, она нужна в случаях, когда можно пренебречь некоторыми параметрами объекта или процесса. Важно знать Модель идеального газа не может описать ситуацию, когда газ сжимают так сильно, что он конденсируется — переходит в жидкое состояние. Свойства идеального газа Расстояние между молекулами значительно больше размеров молекул. Молекулы газа очень малы и представляют собой упругие шары. Силы притяжения между молекулами пренебрежимо малы. Молекулы взаимодействуют только при соударениях. Молекулы движутся хаотично. Молекулы движутся по законам Ньютона. А) 2 Отклонение от идеальности объясняется очень просто. При получении уравнения состояния идеальных газов считалось, что молекулы не обладают размерами и собственным объемом и не взаимодействуют между собой на расстоянии. На самом деле, этими фактами пренебрегать нельзя. Покажем это на расчетах. Радиусы атомов примем равным 10-10 м. Тогда объем занятый атомом равен Б) Самым простым и дающим хорошие результаты по писанию поведения реальных газов оказалось уравнение Ван-дер-Ваальса, полученное путем введения поправок в уравнение состояния идеального газа pVкм = RT:
где р - давление, оказываемое на газ извне и равное давлению газа на стенки сосуда, а и b - константы Ван-дер-Ваальса, имеющие для разных газов различные значения, определяемые опытным путем. В) Критическим состоянием вещества называется такое, при котором исчезает различие (граница) между его жидкой и паровой фазами, т. е. они имеют одни и те же основные свойства. Для каждого вещества существует такая температура, выше которой оно никаким повышением давления не может быть переведено в жидкость. Эта температура называется критической температурой Ткр. Давление насыщенных паров, соответствующее критической температуре, называется критическим давлением Ркр. Объем паров при критической температуре и давлении называется критическим объемом. 3 Поскольку критические константы являются характеристическими свойствами газов, их можно использовать для создания соответствующей относительной шкалы, введя безразмерные приведенные переменные: приведенное давление pr, приведенный объем Vr и приведенную температуру Tr: Соответственными называются состояния разных веществ, имеющие одинаковые значения приведенных переменных. Согласно закону соответственных состояний, если для рассматриваемых веществ значения двух приведенных переменных одинаковы, должны совпадать и значения третьей приведенной переменной. Таким образом, уравнения состояния различных веществ, записанные в приведенных переменных, должны совпадать. Это утверждение эквивалентно постулату о существовании общего универсального приведенного уравнения состояния 45   |