2_коллоквиум_химия_Автосохраненный-1-1. Закон Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов
 Скачать 6.16 Mb. Скачать 6.16 Mb.
|
|
2 коллоквиум. Химия. 1) Периодический закон и периодическая система элементов Д.И. Менделеева. Принцип построения группы, периода. s-, p-, d-, f- блоки элементов. Их расположение в периодической системе. Д.И.Менделеев в 1869 г. впервые сформулировал периодический закон: «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов». На базе современных представлений периодический закон формулируется так: «Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера)». Периодическая таблица элементов- графическое выражение Периодического закона. Горизонтальные строчки Периодической таблицы называются ПЕРИОДАМИ, а вертикальные – ГРУППАМИ. В группах собраны элементы с похожими химическими свойствами, а в периодах химические свойства постепенно изменяются. Если сравнить между собой элементы разных периодов, то можно отметить важную особенность: номер ПЕРИОДА, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода. В этом заключается физический и химический смысл номера периода. Как же изменяются свойства элементов одного периода? Каждый период Периодической таблицы начинается активным металлом и заканчивается инертным газом. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. Номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. В этом заключается физический смысл номера группы. Заряд ядра Z совпадает с ПОРЯДКОВЫМ НОМЕРОМ элемента в Периодической таблице. Свойства элементов периодически изменяются в соответствии с их атомным весом. Все элементы разделяются на 4 электронных семейства. 1) s-элементы – это элементы в атомах которых последним заполняется s – подуровень внешнего электронного слоя. Первые два элемента каждого периода. Они составляют главные подгруппы 1 и 2 групп. 2) р- элементы – это элементы в атомах которых последним заполняется р –подуровень внешнего электронного слоя. Р – элементы составляют главные подгруппы 3-8 групп. 3) d- элементы – это элементы, в атомах которых последним заполняется d- подуровень предвнешнего электронного слоя. Это элементы побочных подгрупп всех восьми групп. 4) f- элементы – это элементы в атомах которых последним заполняется f- подуровень третьего снаружи электронного слоя. Это элементы располагающиеся в нижней части периодической системы лантаноиды и актиноиды. Валентные электроны – это электроны, которые могут участвовать в образовании химических связей. В атомах s- и р- элементов валентными являются, все электроны внешнего слоя. В атомах d – элементов валентными являются электроны s- и d- подуровней. В атомах f – элементов валентными являются электроны s- и f- подуровней. Число валентных электронов для большинства элементов равно номеру группы. 2) Важнейшие характеристики элемента: энергия ионизации, относительная электроотрицательность, от каких свойств атомов зависит его ЭО, сродство атома элемента к электрону и их зависимость от радиуса атома. Атомные и ионные радиусы. Такие свойства атомов, как их размер, энергия ионизации, сродство к электрону, электроотрицательность, степень окисления связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность. Атомы не имеют строго определенных границ, что обусловлено волновой природой электронов. В расчетах пользуются так называемыми эффективными и кажущимися радиусами, т.е. радиусом шарообразных атомов, сближенных между собой при образовании кристалла. Обычно их рассчитывают из рентгенометрических данных. Радиус атома - расстояние от ядра атома до максимума электронной плотности его валентных электронов. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. И, наоборот, с уменьшением атомного радиуса электрона притягиваются к ядру сильнее. Атомы, лишившиеся одного или нескольких электронов, становятся заряженными положительно, т.к. заряд ядра атома превышает сумму зарядов оставшихся электронов. Атомы, присоединяющие к себе лишние электроны, заряжаются отрицательно. Образующиеся заряженные частицы называются ионами. Потеря атомом электронов приводит к уменьшению его эффективных размеров, а присоединение избыточных электронов – к увеличению. Поэтому радиус положительно заряженного иона (катиона) всегда меньше, а радиус отрицательно заряженного иона (аниона) всегда больше радиуса соответствующего электронейтрального атома: r аниона > r ат.> rкатиона Энергия ионизации – это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. Она обычно выражается в электрон-вольтах. При отрыве электрона от атома образуется соответствующий катион. Потенциал ионизации - наименьшее напряжение поля, при котором скорость электронов становится достаточной для ионизации атомов. Выражается в вольтах Энергия ионизации, выраженная в электронвольтах, численно равна потенциалу ионизации, выраженному в вольтах. Электроотрицательность характеризует способность атомов притягивать к себе электроны, которые участвуют в образовании химических связей с другими атомами в молекуле. Металличность – это способность атомов элемента отдавать электроны. Неметалличность – это способность атомов элемента присоединять электроны. Чем больше металличность, тем меньше ЭО. Чем больше неметалличность, тем больше ЭО. Количественной характеристикой неметалличности является сродство к электрону. Сродство к электрону – это энергия, которая выделяется при присоединении электрона к нейтральному атому т.е. при превращении атома в отрицательно заряженный ион: Э0 + е = Э- + Еср Чем больше сродство к электрону, тем легче атом присоединяет электрон, тем, сильнее неметаллические свойства элемента. Закономерности, связанные с металлическими и неметаллическими свойствами элементов. 1) При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические. Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. 2) При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее. 3) СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ - ВОССТАНОВИТЕЛЬНЫЕ свойства элементов. 4) По той же причине, что и окислительные свойства элементов, их ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. Не последнюю роль в этом играет степень завершенности валентной оболочки, ее близость к октету. 5) При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее. 6) Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. Это объясняют тем, что электроны все сильнее притягиваются к ядру по мере возрастания заряда ядра. Даже увеличение числа электронов на внешней оболочке (например, у фтора по сравнению с кислородом) не приводит к увеличению размеров атома. Наоборот, размеры атома фтора меньше, чем атома кислорода. 7) При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек. С позиции строения атома объяснимо положение Н в периодической системе. Атом Н – имеет 1е, который может быть отдан атомам других элементов. Т.к это свойство проявляют атомы всех элементов, начинающих периоды, - то и Н должен стоять в главной подгруппе 1 группы. Поскольку атом Н обладает способностью, подобно атомам галогенов, присоединять 1 е (Н +е = Н-), т.е. проявляет НеМе свойства, он должен находится в главной подгруппе 7 группы. Такая двойственность в химическом поведении водорода является причиной того, что его помещают в двух подгруппах. В четырех местах ПС элементы расположены не в порядке возрастания их атомных масс: Аr (39,948) - К (39,098), Со (58,933) – Ni (58,70). Те (127,60) - I(126,904), Тh (232,038) - Ра (231,035). Эти отступления считали недостатками ПС. Учение о строении атомов объяснило указанные (недостатки) отступления. Ранее был сделан вывод, что свойства элемента зависят от величины положительного заряда ядра, а не от атомных масс. Опытное определение зарядов ядер четырех пар элементов подтвердило, что Д.И.Менделеев расположил их правильно: 18Аr - 19К , 27Со –28 Ni , 52Те - 53I, 90Тh - 91Ра . Как же объяснить то, что атомная масса аргона больше атомной массы К. Как правило, атомная масса элемента равна среднему значению массовых чисел его изотопов. Очевидно, атомная масса аргона в основном определяется изотопом с большим массовым числом, тогда как у калия преобладает изотоп с меньшим массовым числом. Т.о. с точки зрения величин зарядов атомных ядер элементы расположены правильно. Закономерности изменение свойств атомов, простых веществ и соединений, образованных химическими элементами, в пределах главных подгрупп и периодов системы Д.ИМ.Менделеева. Значение Периодического закона Д.И.Менделеева. ПЗ Д.И.Менделеева имеет исключительное значение. Он положил начало современной химии, сделал, ее единой целостной наукой элементы стали рассматриваться во взаимосвязи в зависимости от того, какое место они занимают в периодической системе. Учение о строении атома привело к открытию атомной энергии и использованию ее для нужд человека. ПЗ является первоисточником всех открытий химии и физики ХХ в. ПЗ и система лежат в основе решения современных задач химической науки и промышленности. С учетом ПС ведутся работы по получению новых полимерных и полупроводниковых материалов жаропрочных сплавов, веществ с заданными свойствами, использованию ядерной энергии, исследуются недра. 3) Химическая связь. Параметры химической связи: энергия связи, длина связи, валентный угол. Виды химической связи. Причины образования химической связи. Зависимость энергии молекулы Н2 от межъядерного расстояния. Атомы большинства элементов могут взаимодействовать между собой или атомами других элементов с образований молекулярных частиц. И теоретические, и экспериментальные данные показывают, что в результате получается система, состоящая из атомных ядер и окружающих их валентных электронов. Химической связью называется совокупность взаимодействующих ядер и электронов, приводящая к образованию молекул. К основным параметрам, характеризующим химическую связь относят: а) энергию связи; б) длину связи; в) валентные угол, если молекула угловая. Энергия связи Есв - это энергия которую необходимо затратить для её разрыва, при этом молекула должна быть в основном (не возбуждённом) состоянии, то есть Есв - это величина, определяющая прочность связи. Чем больше Есв, тем прочнее связь. Единица измерения Есв - кДж/моль. По величине Есв можно судить и о реакционной способности молекулы. Длина связи - это среднее расстояние между ядрами атомов, соответствующее min E системы. 1) В ряду аналогичных молекул длина связи изменяется закономерно. Например, в ряду галогеноводородов сверху вниз длина связи увеличивается с возрастанием радиуса атома, а энергия связи - уменьшается и соответственно возрастает реакционная способность, а электроотрицательность- уменьшается. 2) В молекулах, близких по химической природе в пределах одного гомологического ряда длины связей между ядрами элементов мало различаются, т.е. можно считать постоянными. Например, длины связей С-С в предельных углеводородах. 3) Кроме того на длину связи влияет ее кратность, которая определяется числом электронных пар, связывающих два атома. С увеличением кратности связей происходит их упрочнение, между ядрами расстояния уменьшаются так, длина связи: С-С = 0,154 нм; С=С = 0,135 нм; С=-С = 0, 121 нм. Валентные углы - это углы между связи в молекуле, их схематично можно представить, как углы между прямыми линиями, соединяющими ядра атомов в молекуле. Эти воображаемые прямые линии, проведенные через два ядра называют линиями связи. Величина валентного угла зависит от природы атомов и характера связи. Простые двухатомные молекулы всегда имеют линейную структуру: С = О Трехатомные и более сложные молекулы обладают различными конфигурациями: Например, в молекуле Н2О угол между линиями связи Н-О = 104,5 градусов.   О Н Н Т.е. валентный угол – это есть угол между направлениями связей данного атома с другими атомами в молекуле. 4) Ковалентная связь. Основные положения метода валентных связей (МВС). Полярная и неполярная ковалентная связь. Механизмы образования. Двухэлектронная, двухцентровая химическая связь, осуществляемая электронными парами, называется ковалентной. Метод валентных связей (МВС). Ковалентная связь. Основным универсальным типом химической связи является ковалентная связь. а) Ковалентная связь между двумя взаимодействующими атомами осуществляется за счет образования общей электронной пары. Каждый из атомов предоставляет на образование общей электронной пары один неспаренный электрон:  Таким образом, по методу ВС химическая связь двухцентровая и двухэлектронная.  б) Общая электронная пара может образоваться только при взаимодействии электронов с антипараллельными спинами: б) Общая электронная пара может образоваться только при взаимодействии электронов с антипараллельными спинами:в) При образовании ковалентной связи происходит перекрывание электронных облаков. В области перекрывания облаков электронная плотность максимальна, т.е. вероятность пребывания двух электронов в пространстве между ядрами значительно больше, чем в других местах. Возникает система, в которой два ядра электростатически взаимодействуют с парой электронов. Это приводит к выигрышу в энергии, и система становится более устойчивой, образуется молекула. Ковалентная связь тем прочнее, чем в большей степени перекрываются электронные облака. Ковалентной связью называется связывание атомов с помощью общих электронных пар, поделенных между ними. Различают две разновидности ковалентной связи: неполярную и полярную. Если двухатомная молекула состоит из атомов одного элемента, например, О2, Сl2, N2, то каждое электронное облако, образованное общей парой электронов и осуществляющее ковалентную связь, распространяется в пространстве симметрично относительно ядер обоих атомов. Такая связь называется неполярной или гомеополярной (например, молекула хлора). Рассмотрим связывание двух атомов хлора (заряд ядра Z = 17) в двухатомную молекулу с позиций строения электронных оболочек хлора. На внешнем электронном уровне хлора содержится 7 электронов. Поскольку электроны нижних уровней не принимают участия в химическом взаимодействии, точками мы обозначили только электроны внешнего, третьего уровня. Эти внешние электроны (7 штук) можно расположить в виде трех электронных пар и одного неспаренного электрона. После объединения атомов в молекулу из двух неспаренных электронов атомов получается новая электронная пара:  При этом каждый из атомов хлора оказывается в окружении ОКТЕТА электронов. В этом легко убедиться, если обвести кружком любой из атомов хлора. Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой. Остальные пары электронов называют неподеленными парами. Они заполняют оболочки и не принимают участия в связывании. Атомы образуют химические связи в результате обобществления такого количества электронов, чтобы приобрести электронную конфигурацию, подобную завершенной электронной конфигурации атомов благородных элементов. Если двухатомная молекула состоит из атомов различных элементов, то общее электронное облако смещено в сторону одного из атомов, так что возникает ассиметрия в распределении зарядов. Такая связь называется полярной или гетерополярной.  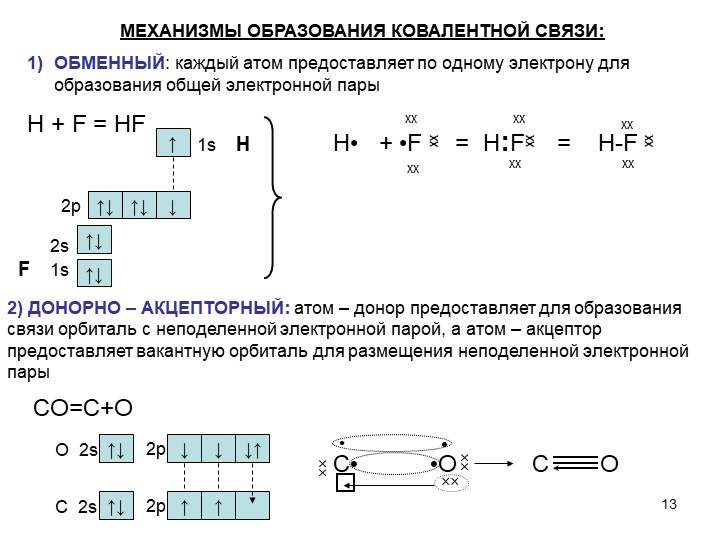 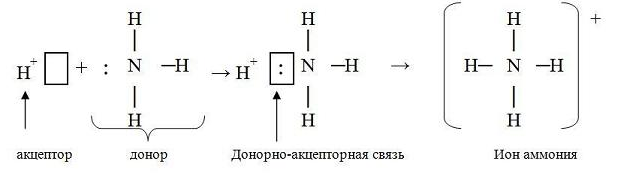 5) Свойства ковалентной связи: длина, насыщаемость, направленность. Диполь, дипольный момент. Свойства ковалентной связи: Насыщенность - способность атомов образовывать определённое число ковалентных связей, то есть одна орбиталь атома может принимать участие в образовании только одной ковалентной связи. Направленность - способность ковалентной связи, определяющее геометрическую структуры молекулы. Причина направленности объясняется тем, что перекрывание электронных орбиталей возможно, только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания. Полярность - способность разрыва ковалентная связи. В силу того, что у полярной молекулы электроны смещены в сторону более электроотрицательного атома - центры тяжести положительных и отрицательных зарядов -не совпадают в результате образуются электрический диполь. Способность атома данного элемента оттягивать к себе общую электронную пару характеризуется величиной относительной электроотрицательности. Чем она больше, тем сильнее атом притягивает к себе общую электронную пару, т.е. сильнее смещение общего электронного облака. В результате средняя плотность отрицательного электрического заряда оказывается выше вблизи более электроотрицательного атома и ниже — вблизи менее электроотрицательного. Т.е. первый атом приобретает избыточный отрицательный, а второй — избыточный положительный заряд, который называются эффективными зарядами атомов в молекуле. Так, например, в молекуле НСl общая электронная пара смещена в сторону более электроотрицательного хлора, что приводит к возрастанию у него эффективного отрицательного (-0,18 заряда электрона), а у атома водорода — эффективного положительного (+0,18 заряда электрона) зарядов. Следовательно, такая молекула является полярной, которую можно рассматривать как систему из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определенном расстоянии друг от друга. Такие системы называются электрическими диполями. Хотя суммарный заряд равен «0», в окружающем его пространстве образуется электрическое поле, напряженность которого пропорциональна дипольному моменту молекулы μ, который равен произведению абсолютного значения заряда электрона q на расстояние l между центрами положительных и отрицательных зарядов в молекуле: μ=ql Электрический момент диполя выражается в Дебаях, 1Д=3,33*10-30 Кл/м. Он является векторной величиной, например, от отрицательного полюса к положительному. Если µ=0 - молекула неполярна и имеет линейную структуру. Например, молекула СО2 является неполярной вследствие линейного строения, хотя отдельные связи С-О плярны. Если µ≠0 - молекула полярна и имеет угловую структуру. Например, в молекуле Н2О µ≠0 и она является полярной. 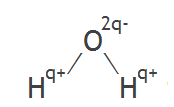 Способы разрыва ковалентной химической связи делятся на два типа: 1) Гомолитический; 2) Гетеролитический. Чтобы разорвать химическую связь, необходимо затратить столько энергии, сколько выделось при ее образовании. При гомолитическом разрыве ковалентной связи электронная пара, осуществляющая химическую связь, разрывается и с каждым атомом остается по одному электрону, т.е. разрыв с образованием радикалов.  При гетеролитическом разрыве химической связи электронная пара целиком переходит к одному из атомов (более электроотрицательному), в результате чего образуется два иона.  6) Ионная связь. Поляризация и поляризующая способность ионов. Механизм образования, свойства. Водородная и металлическая связь. Ионная связь, она ничем принципиально не отличается от ковалентной связи. Движущей силой ее образования является все то же стремление атомов к октетной оболочке. Но в ряде случаев такая “октетная” оболочка может возникнуть только при передаче электронов от одного атома к другому. Поэтому ионная связь, в отличие от ковалентной, возникает только между атомами разного вида. При образовании ионной связи атомы типичных металлов отдают электроны, а атомы типичных неметаллов принимают электроны. В результате этих процессов атомы металлов превращаются в положительно заряженные частицы, которые называются положительными ионами, или катионами; а атомы неметаллов превращаются в отрицательные ионы – анионы. Связь между ионами называется ионной связью. Энергия, которая требуется для разрыва связи, называется энергией химической связи. Рассмотрим конкретный пример: реакцию между атомами натрия (Z=11) и фтора (Z=9). При образовании связи между ними оба элемента приобретают внешнюю электронную оболочку благородного газа неона (Z=10). Для того, чтобы убедиться в этом надо записать электронные формулы всех трех элементов: Na: 1S2 2S2 2P6 3S1 F: 1S2 2S2 2P5 Ne: 1S2 2S2 2P6 В электронных формулах нам важны только электронные конфигурации внешних электронных уровней (они подчеркнуты): 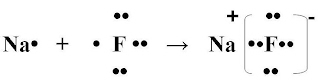 Натрий, отдав фтору свой 3S1 электрон, становится ионом Na+ и остается c заполненной 2S2 2P6 оболочкой, что отвечает электронной конфигурации атома неона. Точно такую же электронную конфигурацию приобретет атом F, приняв один электрон, отданный натрием теперь это ион F-. Разумеется, при этом ионы Na+ и F- продолжают оставаться все теми же элементами фтором и натрием, потому что никакие электронные переходы не могут изменить природу элемента – число протонов в его ядре: 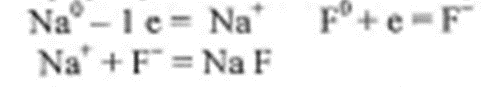 В отличие от ковалентной связи, ионная связь не обладает направленностью. Это объясняется тем, что электрическое поле иона обладает сферической симметрией, т. е. убывает с расстоянием по одному и тому же закону в любом направлении. Поэтому взаимодействие между ионами осуществляется одинаково независимо от направления. Система из двух зарядов, одинаковых по абсолютной величине, но противоположных по знаку, создает в окружающем пространстве электрическое поле. Это означает, что два разноименных иона, притянувшиеся друг к другу, сохраняют способность электростатически взаимодействовать с другими ионами. В этом состоит еще одно различие между ионным и ковалентным типами связи: ионная связь не обладает насыщаемостью. Поэтому к данному иону может присоединиться различное число ионов противоположного знака. Это число определяется относительными размерами взаимодействующих ионов, а также тем, что силы притяжения разноименно заряженных ионов должны преобладать над силами взаимного отталкивания, действующими между ионами одного знака. Неполное разделение зарядов в ионных соединениях можно объяснить взаимной поляризацией ионов, т. е. влиянием их друг на друга, которое приводит к деформации электронных оболочек ионов. Причиной поляризации всегда служит действие электрического поля, смещающего электроны и ядра атомов в противоположных направлениях. Каждый ион, будучи носителем электрического заряда, является источником электрического поля. Поэтому, взаимодействуя, противоположно заряженные ионы поляризуют друг друга. Наибольшее смещение испытывают при поляризации электроны внешнего слоя; в первом приближении можно считать, что деформации подвергается только внешняя электронная оболочка. Однако под действием одного и того же электрического поля различные ионы деформируются в разной степени. Иначе говоря, поляризуемость различных ионов неодинакова: чем слабее связаны внешние электроны с ядром, тем легче поляризуется ион, тем сильнее он деформируется в электрическом поле. У ионов одинакового заряда, обладающих аналогичным строением внешнего электронного слоя, поляризуемость возрастает с увеличением размеров иона, так как внешние электроны удаляются все дальше от ядра, экранируются все большим числом электронных слоев и, в результате, слабее удерживаются ядром. Так, у ионов щелочных металлов поляризуемость возрастает в ряду: Li+ < Nа+ < К+ < Rb+< Сs+ Точно также поляризуемость ионов галогенов изменяется в следующем порядке: F- < Сl- < Вr- < I- Превращение атома в положительно заряженный ион всегда приводит к уменьшению его размеров. Кроме того, избыточный положительный заряд катиона затрудняет деформацию его внешних электронных облаков. Напротив, отрицательно заряженные ионы всегда имеют большие размеры, чем нейтральные атомы, а избыточный отрицательный заряд приводит здесь к отталкиванию электронов и, следовательно, к ослаблению их связи с ядром. По этим причинам поляризуемость анионов, как правило, значительно выше поляризуемости катионов. Поляризующая способность ионов, т. е. их способность оказывать деформирующее воздействие на другие ионы, также зависит от заряда и размера иона. Чем больше заряд иона, тем сильнее создаваемое им электрическое поле, следовательно, наибольшей поляризующей способностью обладают многозарядные ионы. При одном и том же заряде напряженность электрического поля вблизи иона тем выше, чем меньше его размеры. Поэтому поляризующая способность ионов одинакового заряда и аналогичного электронного строения падает с увеличением ионного радиуса. Так, в ряду катионов щелочных металлов поляризующая способность изменяется в порядке, обратном порядку изменения поляризуемости: Li+ > Nа+ > К+ > Rb+ > Сs+ . Металлическая связь. Существенные сведения о природе химической связи в металлах можно получить на основании их двух характерных особенностей по сравнению с ковалентными и ионными соединениями. Металлы, во-первых, отличаются от других веществ высокой электрической проводимостью и теплопроводностью, во-вторых, в обычных условиях являются кристаллическими веществами. Из первого характерного свойства металла следует, что по крайней мере часть электронов может передвигаться по всему объему куска металла. Из второго свойства металлов следует. Что их атомы не связаны друг с другом локализованными двухэлектронными связями. Число валентных электронов атома металла недостаточно для образования подобных связей со всеми его соседями. Природу химической связи и характерные особенности металлов можно объяснить на примере лития следующим образом. В кристалле лития орбитали соседних атомов перекрываются. Каждый атом предоставляет на связь четыре валентные орбитали и всего лишь один валентный электрон. Значит. В кристалле металла число электронов значительно меньше числа орбиталей. Поэтому электроны могут переходить из одной орбитали в другую. Тем самым электроны принимают участие в образовании связи меду всеми атомами кристалла металла. К тому же атомы металлов характеризуются невысокой энергией ионизации – валентные электроны слабо удерживаются в атоме, т.е. легко перемещаются по всему кристаллу. Возможность перемещения электронов по кристаллу определяет электрическую проводимость металла. Таким образом, в отличие от ковалентной и ионных соединений в металлах небольшое число электронов одновременно связывает большое число атомных ядер, а сами электроны могут перемещаться в металле. Иначе говоря, в металлах имеет место сильно делокализованная химическая связь. Связь, которую осуществляют относительно свободные электроны между ионами или атомами металлов в кристаллической решетке – называется металлической. Металлическую связь образуют элементы, атомы которых на внешнем уровне имеют мало валентных электронов по сравнению с общим числом внешних энергетически близких орбиталей. Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Электроны, осуществляющие связь, обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального. Металлическая связь характерна для металлов твердом и жидком состоянии. Водородная связь. Водородная связь представляет собой результат электростатического притяжения положительно поляризованных атомов водорода к отрицательному полюсу полярных молекул. Образование водородной связи обязано ничтожно малому размеру положительно поляризованного атома водорода и его способности глубоко внедряться в электронную оболочку соседнего (ковалентно с ним не связанного отрицательно поляризованного атома). Вследствие этого при взаимодействии водородной связи наряду с электростатическим взаимодействием проявляется и донорно-акцепторное взаимодействии. Энергия связи водородной связи Н---О в димере воды составляет 21,5 кДж/моль, а ее длина 2,04 А. Таким образом, эти связи более длинные и примерно в 10-20 раз менее прочные, чем обычные ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар. 7) Полярность ς- и π- связи. Форма молекул. Область перекрывания электронных облаков — это область высокой плотности отрицательного заряда, который притягивает положительно зараженные ядра атомов. ς-связи - это ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов. π-связи - это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов. 1) ς-связь возникает при перекрывании s-s, s-p, d-d облаков вдоль по осевой линии, соединяющей центры атомов (линии связи). 2) π-связи осуществляются при перекрывании рy -рy, рz -рz и d-d облаков в плоскости перпендикулярно линии связи. 3) связи возникают при перекрывании двух d-d облаков, расположенных в параллельных плоскостях, перпендикулярных линии связи. Порядок связи — это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь. 8) Гибридизация атомных орбиталей: Sp1-, Sp2-, Sp3 – гибридизация. Возбуждение атомов приводит к тому, что у них появляются орбитали, способные к образованию химических связей (валентные орбитали). Как правило эти орбитали получаются различных типов (s,p,d,f), и следовательно обладают различными энергиями и казалось бы связи в таких молекулах как ВеСI2, ВСI3, ССI4 должны были быть разные, но они одинаковы, что противоречит в свою очередь эквивалентности химической связи в молекуле т.е. все связи в молекуле – одинаковы. Для объяснения этих фактов в методе валентных связей вводится понятие гибридизация. Гибридизация – это изменение формы всех валентных орбиталей таким образом, что они приобретают одинаковую конфигурацию, обеспечивающую наибольший уровень перекрывания с орбиталями других атомов. А образующиеся в результате орбитали называются –гибридными. Гибридизация атомных орбиталей – это смешение атомных орбиталей (электронных облаков) различного типа , в результате которого образуются одинаковые по форме и энергии гибридные орбитали . 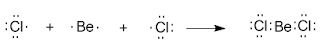 Электронная конфигурация валентной оболочки бериллия. Для реакции с двумя атомами хлора необходим переход электронов бериллия в возбужденное состояние: 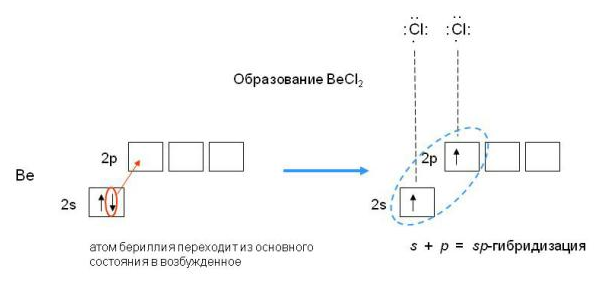 Если бы один атом хлора связывался с бериллием за счет 2s-электрона бериллия, а другой - за счет 2p-электрона бериллия, то связи Be—Cl не были бы равноценными. Однако на самом деле обе связи имеют одинаковую длину, прочность и расположены под одинаковым углом. Чтобы объяснить равноценность связей Be—Cl, говорят о sp-гибридизации валентных атомных орбиталей бериллия, при которой одна s-орбиталь и одна p-орбиталь как бы смешиваются и выравниваются по форме и энергии, давая две одинаковые sp-гибридные орбитали. 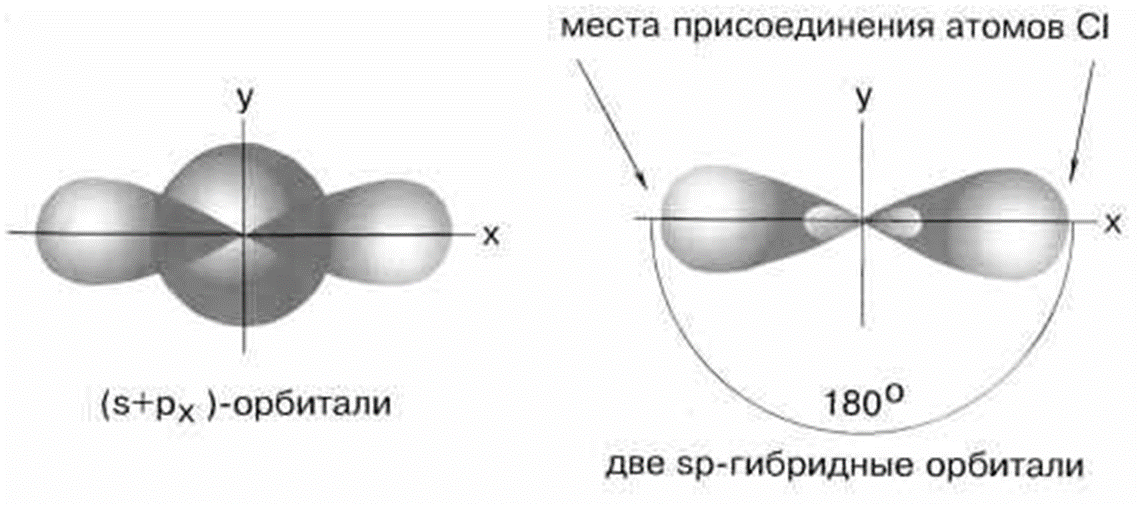 Каждая гибридная орбиталь несимметрична (вытянута в сторону от ядра). Обе гибридные орбитали бериллия лежат на одной прямой, под углом 180 градусов. Считается, что благодаря sp-гибридизации молекула имеет линейную форму и все три ее атома находятся на одной прямой, а обе связи Be—Cl совершенно одинаковы. Такова геометрия и у всех других sp-гибридизованных молекул - независимо от элементов, которые входят в эти молекулы. Если валентная оболочка атома включает электроны на одной s-орбитали и двух p-орбиталях, то имеет место sp2-гибридизации орбиталей. Примером может служить sp2-гибридизация бора при образовании молекулы. 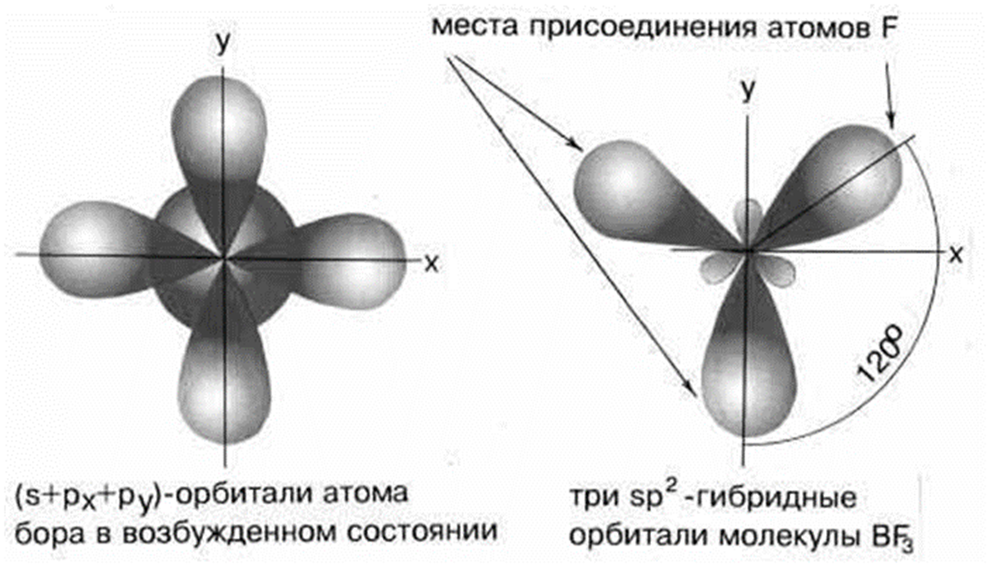 Три sp2-гибридные орбитали бора лежат в одной плоскости под углом 120 градусов. Наконец, когда смешиваются одна s- и три p-орбитали, возникают sp3-гибридизованные молекулы, имеющие геометрию тетраэдра. Примером может служить молекула метана.  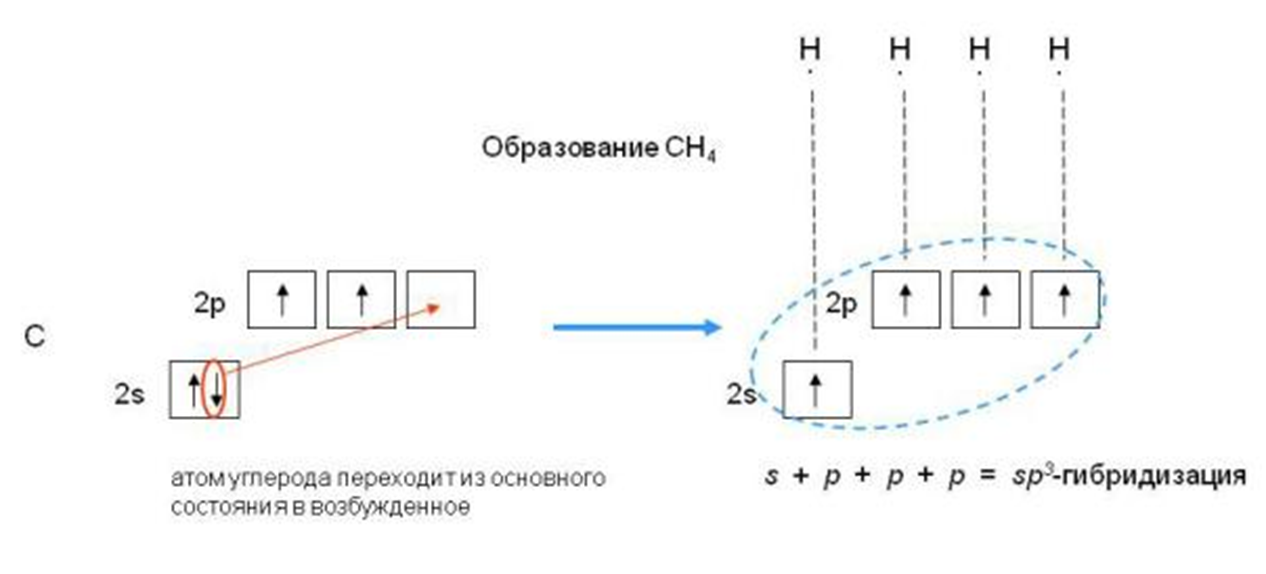 Четыре sp3-гибридные орбитали углерода направлены в вершины правильного тетраэдра. Атом углерода находится в центре тетраэдра. Углы между всеми связями равны и составляют 109°. 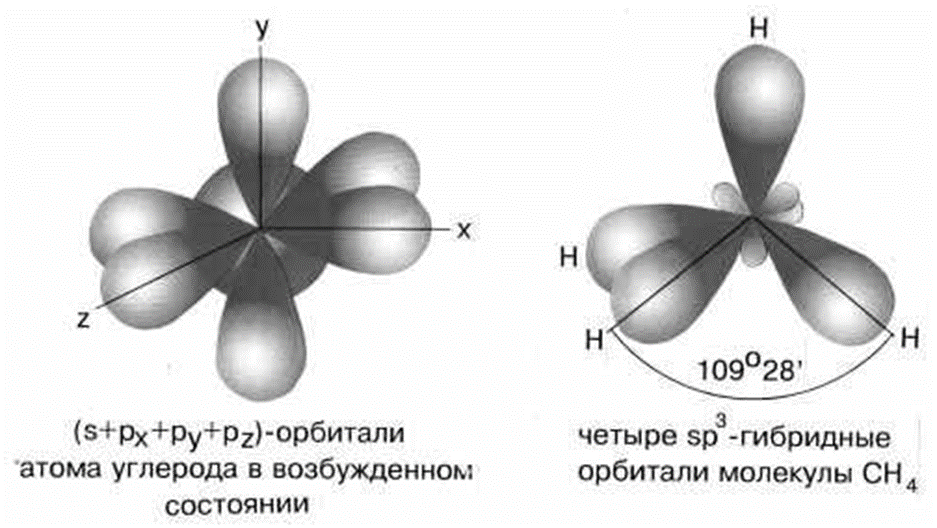 Существует важное правило: При гибридизации ЧИСЛО ГИБРИДНЫХ ОРБИТАЛЕЙ всегда РАВНО ЧИСЛУ ИСХОДНЫХ АТОМНЫХ ОРБИТАЛЕЙ.
9) Описание молекулы по методу линейной комбинации атомных орбиталей. Молекулярная орбиталь. Связывающие и разрыхляющие МО. Основные положения (ЛКАО-МО). 10) Энергетические схемы образования молекул из одинаковых атомов (гомоядерные) и разных атомов (гетероядерные) на примере NO, CO, O2, F2. По методам МВС и ММО и сравнение этих методов. Для описания ковалентной связи используются два взаимодополняющих и квантовомеханических метода: МВС (метод валентных связей) и ММО (метод молекулярных орбиталей). МВС позволяет получить правдивую информацию о структуре и свойствах различных молекул, ионов, но есть ряд экспериментальных фактов, которые не могут быть объяснены на основе данного метода, так, например, парамагнитные свойства (О2, Br2 и т.д.), существование молекул с нечетным числом электронов (NO, CO и др.) Эти и другие законы способствовали созданию квантово-механического методов описания ковалентной химической связи –ММО. Разница между АО и МО заключается в том, что АО принадлежит ядру одного атома является одноцентровой, а МО- принадлежит сразу двум или нескольким ядрам и является многоцентровой. Таким образом, электроны, находящиеся на МО обобществляются сразу всеми атомами данной молекулы (если по МВС они обобществляются только соседними). Основы ММО и разработаны Робертом Малликеном и французом Хундом ( 1926-1930). Молекулярной орбиталью называют волновую функцию, описывающую состояние электрона в поле всех атомов данной молекулы. Однако форма и энергия МО зависит от того какие электроны участвуют в ее образовании: а) МО, образованные внутренними (не валентными АО) взаимно не перекрываются, а значит и не изменяют своей формы, не изменившиеся АО, перешедшие в МО, называется не связывающими (МО) электроны в них обладают тем же запасом энергии что и атомы б) Валентные АО, вступал в взаимодействие и превращаясь в МО, становятся многоцентровыми, сложными по форме . Наглядно представить изменение формы АО при образование МО можно путем линейной комбинации волновых функцией, описывающих АО обозначим волновые функции: АО через φ МО через Ψ Согласно методу МО молекула рассматривается, как совокупность ядер и электронов, где каждый электрон движется в поле остальных электронов и ядер. Метод МО распространяет квантово-механические закономерности, установленные для атомов, на более сложную систему - молекулу. В основе метода МО лежит представление об «орбитальном» строении молекул, т.е. предположение о том, что все электроны молекулы распределяются по соответствующим молекулярным орбиталям (МО). Специфика молекулярных орбиталей в том, что они являются многоцентровыми. Общее число образующихся МО равно общему числу исходных АО. Описать молекулу по методу МО — это значит определить тип молекулярных орбиталей, их энергию и выяснить характер распределения электронов по МО. Мы рассмотрим самый простой вариант метода МО, называемый линейной комбинацией атомных орбиталей, сокращенно ЛКАО. | |||||||||||||||||||||||||||||||
