Тема 1. Закон у світлі електронної будови атома Питання до самостійної доаудиторної роботи
 Скачать 23.96 Kb. Скачать 23.96 Kb.
|
Питання до самостійної доаудиторної роботи: Що таке атом? З чого складається? Що таке хімічний елемент? У чому полягають відмінності між поняттями «хімічний елемент» та «проста речовина»? Що таке явище алотропії, чим воно зумовлено? Наведіть приклади. Розкрийте зміст величин «атомна маса» та «молекулярна маса» (відносні). Що таке іон? Чим відрізняється аніон від катіона? Порівняйте величини: «молекулярна» і «молярна» маси речовини? Що таке моль? Знайдіть масу 0,2 моль натрiй дигiдрогенфосфату. Маса 1,5·1024 молекул речовини 45 г. Знайдіть молекулярну масу речовини. Де більше молекул в 2,8 г кисню чи 2,3 г азоту? Сформулюйте закони збереження маси речовин, сталості складу речовини та простих об’ємних відношень. Сформулюйте закон Авогадро та наслідки з нього. Що таке відносна густина одного газу за іншим? Сформулюйте закон еквівалентів. Чи завжди еквівалент хімічного елемента однакова величина? Наведіть приклади хімічних елементів, еквіваленти яких можуть змінюватись. Де більше молекул міститься за нормальних умов в 3,36 л карбон (IV) оксиді чи 500 мл азоту? Густина газів за повітрям рівна: а) 0,9 б) 2,45. Визначити їх молярні маси. В результаті прожарювання СаСО3 масою 1 г отримано СаО масою 0,56 г i СО2 об’ємом 224 мл (н.у.). Чи підтверджують ці дані закон збереження маси речовин? У складній речовині ω(Na) = 34,59 %, ω(P) = 23,31 % і ω(O) = 42,10 %. Визначить простішу формулу цієї сполуки. Яку модель атома запропонував Резерфорд? Модель атома гідрогену за теорією Бора. Сформулюйте постулати Бора, основні принципи квантової механіки. Сучасні уявлення про будову атома. Які елементарні частинки називають протонами, нейтронами, електронами? У чому виявляється двоїста корпускулярно-хвильова природа частинок мікросвіту, зокрема, електрона? Гіпотеза Луї де Бройля. Чому неможливо описати рух електрона в атомі за допомогою певної траєкторії? Принцип невизначеності Гейзенберга. Який фізичний зміст квантових чисел (головного, орбітального, магнітного та спінового)? Яка залежність існує між ними? Які два квантових числа характеризують енергію атомної орбіталі? Сформулюйте принцип Паулі та поясніть його значення для створення квантово-механічної моделі електронної будови атома. Сформулюйте правила Клєчковського та Хунда та поясніть їх значення для визначення електронної конфігурації (структури) атома. Вкажіть можливі та неможливі електронні стани: 1s2, 3p4, 2f1, 3d2, 4f16, 3d11, 1p3. Який підрівень атома елементу заповнюється раніше – 4s чи 3d – при збільшенні порядкового номера елементу в Періодичній системі? У чому причина періодичного повторення властивостей хімічних елементів? Яке сучасне формулювання Періодичного закону? За якими ознаками хімічні елементи розміщують в одній групі; в одній підгрупі Періодичної системи? Чому перший період містить лише два хімічні елементи, другий та третій – по вісім, а четвертий і п’ятий – по вісімнадцять? У чому полягають особливості розташування в періодичній таблиці f-елементів? Що характеризує енергія спорідненості до електрона? Як вона змінюється зі збільшенням заряду ядра атома в періоді; у головних підгрупах Періодичної системи? Відповідь обґрунтуйте на прикладах. Які властивості хімічних елементів можна охарактеризувати за допомогою електронегативності елементів? Як її можна оцінити? Практична робота №1 «Основні поняття та закони хімії» 1.1. Розрахуйте всі величини, для яких у таблиці 1 приведені пусті клітинки на основі приведеної величини. Таблиця 1
1.2. Розрахуйте відносні густини газів ( 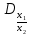 ), та внесіть дані у таблицю 2. ), та внесіть дані у таблицю 2.Таблиця 2
«Електронна будова атома» 1.3. Заповніть у таблиці 3 пусті клітинки. Таблиця 3
Практична робота №2 «Періодичний закон» 2.1. Заповніть пусті клітинки таблиці користуючись Періодичною системою. Таблиця 4
Лабораторна робота №1 «Вплив електронної будови атомів та іонів на хімічні властивості елементів» Дослід 1.1
Лабораторна робота №2 «Дослідження зміни металічних властивостей елементів зі збільшенням їхнього порядкового номера в групі» Дослід 2.1
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||