перегонка. Закона Рауля на кривых общее давление пара состав могут появляться минимумы или максимумы. Второй закон Коновалова
 Скачать 37.77 Kb. Скачать 37.77 Kb.
|
|
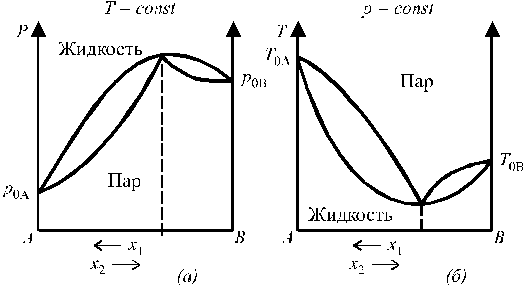
Соотношения между составами равновесных растворов и их паров, а также общим давлением пара над раствором были установлены Д.П. Коноваловым в 1881 году и носят название законов Коновалова. Первый закон Коновалова гласит: общее давление пара над раствором растёт с ростом доли в растворе легколетучего компонента. На этом явлении основана фракционная перегонка (ректификация), позволяющая разделить смесь взаимнорастворимых жидкостей. Второй закон Коновалова касается более частных случаев. Для некоторых реальных растворов с большими отклонениями от закона Рауля на кривых «общее давление пара – состав» могут появляться минимумы или максимумы. Второй закон Коновалова можно сформулировать следующим образом: в точках экстремумов на кривых общего давления насыщенного пара (или температур кипения) составы пара и сосуществующего с ним в равновесии жидкого раствора совпадают. Диаграммы состояния бинарных систем с максимумом на кривой давления пара и минимумом на кривой температур кипения представлены на рис. 6.
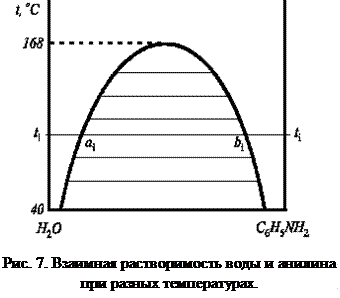
Рис. 6. Диаграммы состояния бинарных систем с максимумом на кривой давления пара (а) и минимумом на кривой температур кипения (б). Растворы, у которых состав жидкой фазы и пара одинаковы, называются азеотропными, или нераздельнокипящими. Путём перегонки азеотропные растворы не разделяются (составы фаз равны). Но их можно разделить следующими методами: - путём химического связывания одного из компонентов; - путем добавления в систему третьего компонента; Простая перегонка жидких смесей. Для разделения смесей жидкостей на практике часто используют метод перегонки, который основан на различии в составах пара и жидкости, из которой пар получен. Рассмотрим диаграмму кипения двухкомпонентной системы, состоящей из двух неограниченно смешивающихся жидкостей А и В.  T0,A > T0,B Возьмем жидкость определенного состава, характеризующегося точкой N, и начнем её постепенно нагревать при p=const. Этому процессу соответствует перемещение фигуративной точки по вертикальной прямой NL. В фазовой точке L (от liquid – жидкость), лежащей на кривой жидкости, начинается переход жидкости в пар. Здесь видно, что уВ > хВ (компонента В в паре больше, чем в жидкости), т.е. в соответствии с первым законом Коновалова, пар, по сравнению с жидкостью, обогащен более летучим компонентом В. При дальнейшем повышении температуры фигуративная точка суммарного состава всей смеси будет подниматься вверх по той же вертикали, а фазовые точки пара и жидкости смещаются соответственно по кривым пара и жидкости. При этом количество жидкости уменьшается, а количество пара - возрастает (в соответствии с правилом рычага). При температуре Т1 состав пара характеризуется точкой V1, а состав жидкости - точкой L1, а суммарный состав смеси - фигуративной точкой N1, лежащей на ноде L1N1V1. При температуре Т2 жидкость полностью переходит в пар состав пара соответствует точке V2, т.е. он имеет такой же состав, как и состав исходной жидкости (точка N). При дальнейшем повышении температуры (выше Т2) фазовое состояние системы не изменяется. В результате простой перегонки в остатке можно получить некоторое количество (обычно небольшое) почти чистого труднолетучего компонента А, а хорошо испаряющийся компонент (В) в результате простой перегонки в чистом виде не выделяется. Существуют жидкости, практически не растворимые одна в другой или растворимые в ограниченных пределах концентраций. Жидкости ограниченно растворимые друг в друге Если смешивать две жидкости с ограниченной растворимостью, то в некотором интервале температур они будут неограниченно смешиваться друг с другом с образованием одной гомогенной фазы (раствора). В другом интервале температур система будет распадаться на две гомогенные фазы: раствор первого компонента во втором и второго компонента в первом. Система в целом гетерогенна, при неизменной температуре состав каждого из равновесных слоев остается постоянным и не зависит от количества той или иной жидкости в смеси. Температура, выше или ниже которой имеет место неограниченная взаимная растворимость компонентов, называется критической. Существуют следующие системы ограниченно растворимых друг в друге жидкостей: 1. Системы с верхней критической температурой растворения (фенол–вода, анилин–вода). В этом случае повышение температуры ведет к увеличению взаимной растворимости жидкостей, так что при некоторой температуре достигается полная взаимная растворимость жидкостей, например при Т =1680С для системы вода–анилин (рис. 7). Кривая abc является кривой расслоения (ликвации). Прямая, соединяющая точки равновесных слоев (сопряженных фаз), например прямая aibi, называется нодой.
2. Системы с нижней критической температурой растворения (триэтиламин–вода). Повышение температуры в этом случае ведет к уменьшению взаимной растворимости жидкостей. 3. Системы с верхней и нижней критическими температурами растворения (вода–никотин). Между двумя критическими температурами существует область, в которой система гетерогенна. Взаимно нерастворимые жидкости. Если жидкости практически не растворимы друг в друге, то система кипит при более низкой температуре, чем температура кипения для каждой отдельной жидкости. Давление насыщенного пара над каждой из таких жидкостей зависит только от температуры: Общее давление пара над системой, состоящей из взаимно нерастворимых жидкостей, равно: Оно превышает давление пара над любой отдельно взятой жидкостью. В результате давление пара над системой становится равным внешнему давлению при более низкой температуре по сравнению с температурами кипения чистых жидкостей. На этом явлении основан метод перегонки с водяным паром. В этом случае, мало летучая жидкость может быть переведена в пар при температуре более низкой, чем температура её кипения, путём совместного кипения с несмешивающейся и химически не взаимодействующей с ней более летучей жидкостью. |