физиология бактерий. Закономерности культивирования бактерий, этапы бактериологического (культурального) метода диагностики
 Скачать 234.6 Kb. Скачать 234.6 Kb.
|
|
Физиология-2 закономерности культивирования бактерий, этапы бактериологического (культурального) метода диагностики Считается, что пигменты защищают бактерии от губительного действия солнечных лучей, поэтому в воздухе так много пигментированных бактерий, кроме того, пигменты участвуют в обмене веществ этих микроорганизмов, являются энергетическими запасами (например, волютин, хлорофилл) Достоинства бактериологического метода: Высокая чувствительность Высокая достоверность идентификации Возможность выбора препаратов для этиотропной терапии Возможность установления эпидемиологической взаимосвязи между разрозненными случаями заболеваний Недостатки: Большая продолжительность исследования (от 3-х дней до 2-х месяцев) Есть некультивируемые или трудно культивируемые возбудители Высокая стоимость исследования, связанная с подбором специальных и не всегда доступных: питательных сред, реактивов, оборудования. Методы культивирования микробов: Непрерывное культивирование. Культивирование производят на различных пит. Средах в термостате при Т=37. Используется открытая система с возможностью подачи свежей питательной среды и вывода из реактора накопленной биомассы. Регулирование процесса проводится по принципу: хемостата – по лимитирующему субстрату, турбидостата – по биомассе. Периодическое культивирование. Используется закрытая система. Питательные вещества не вводятся в систему и продукты обмена не убираются. Система проходит несколько стадий развития: Фаза 1 - исходная стационарная (латентная): микробные клетки адаптируются к питательной среде, при этом повышается интенсивность обменных процессов, увеличивается размер клеток. Фаза 2 - логарифмического роста: бактерии энергично размножаются, вследствие чего количество клеток возрастает в геометрической прогрессии. В этой фазе бактерии обладают наибольшей биохимической и биологической активностью. Фаза 3 - стационарная: концентрация бактериальных клеток в среде остается постоянной. Это обусловлено тем, что число вновь появившихся бактерий почти равно числу отмирающих клеток. Длительность этой фазы у разных бактерий различна. Фаза 4 - отмирания: жизнеспособных клеток бактерий становится все меньше, и постепенно они погибают. Причинами гибели клеток могут быть истощение питательной среды, накопление в ней вредных продуктов обмена. 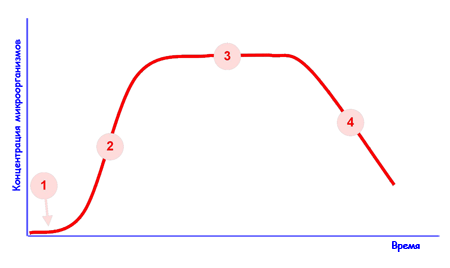   Первый этап 1. Забор материала. Материалы для исследования: слюна, кровь, мокрота, ликвор и др. Материалами могут быть мазки, соскобы со слизистой п-ти рта, щеки, спинки языка, отделяемое пародонтальных карманов или каналов. Забор производят с помощью гладилки, гуттаперчивых штифтов, тампоном. Материал помещают в пробирки для дальнейшей траспортировки. Используют транспортные среды Правила взятия материала: Предотвращение контаминации образца. Уменьшение доступа кислорода. Использование транспортных систем и сред тормозящих активную жизнедеятельность анаэробных видов бактерий (тиогликолевая среда, среда Стюарта, Среда Эймса и т.п.). Доставка материала в ближайшие часы после взятия пробы, охлаждение при 4С до посева. 2. Микроскопическое исследование с применением дифференциально-диагностических и специальных методов окраски позволяет провести ориентировочную идентификацию этих бактерий по морфологическим признакам и определить подходящую питательную среду. 3. Посев исследуемого м-ла на плотную питательную среду. Механическое разобщение микробных клеток при помощи техники сектарального посева или посева змеевидным штрихом, помещение чашки в термостат и культивирование в течение нескольких дней. Получение изолированных колоний разных типов. 4.Выделение чистой культуры из изолированных колоний - отсев выбранной колонии на среду накопления, для которых используются селективные среды Например, желточно-солевой агар – предназначен для выделения чистой культуры стафилококков с подавлением роста сопутствующих микроорганизмов (как грамотрицательных, так и грамположительных). Вырастающие стафилококки дифференцируются по наличию лецитовителазы. Получение изолированных колоний из исследуемого материала лучше проводить на селективных, дифференциально-диагностических, хромогенных средах или кровяном агаре – это сокращает время диагностики. На такой среде можно предварительно определить вид микроорганизма по его специфическому признаку, н-р, по способности расщеплять лактозу- используют для диф.диагностики кишечных инфекций (лактозосодержащие среды Эндо,Плоскирева, Левина) Часто используют универсальную среду – кровяной агар. По хар-ру гемолиза вокруг колонии можно сделать вывод о наличие альфа и бета гемолитических ферментов (позеленение среды вокруг колонии, для бета гемолизы – светлый ободок вокруг колони за счет распада эритроцитов) Кровяной агар – предназначен для выделения чистой культуры требовательных микроорганизмов и их дифференцировке по способности к гемолизу и его типу Второй этап накопление (получение) чистой культуры из полученных изолированных колоний и проверка её чистоты Проверка чистоты выделенной культуры: Визуально (однородность посева) Микроскопически (однородность клеточных элементов в мазке по Граму) 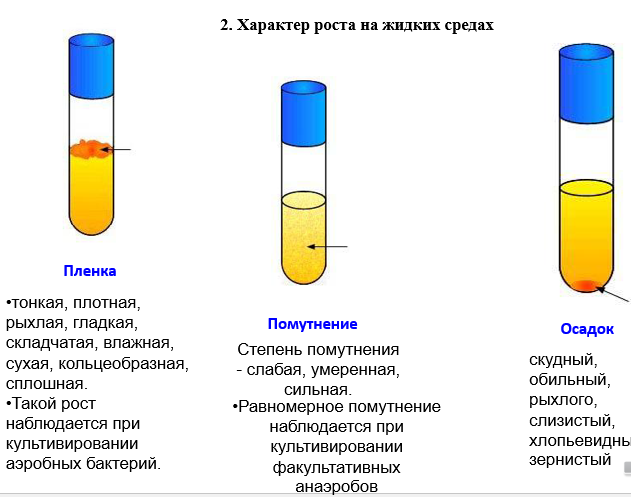 Нередко рост микробов сопровождается появлением запаха, пигментацией среды, выделением газа. Характерный запах культур некоторых видов бактерий связан с образованием различных эфиров (уксусноэтилового , уксусноамилового и др.), индола, меркаптана, сероводорода, скатола, аммиака, масляной кислоты. При росте на полужидких (0,5-0,7% агара ) питательных средах подвижные микробы вызывают выраженное помутнение, неподвижные формы растут только по ходу посева уколом в среду. 3 этап 1.Идентификация выделенной чистой культуры – определение таксономического положения, места в классификации, рода и вида микроба Идентификация проводится в обязательном порядке по следующим свойствам: морфологическим (микроскопическая характеристика) тинкториальным свойствам (отношение к окраске) культуральным (макроскопическая характеристика колоний, пигментообразование) биохимическим (гликолитическим, протеолитическим, липолитическим) При необходимости дополнительно определяют: патогенные свойства (определение факторов патогенности, например, ферментов агрессии, гемолитической активности) антибиотические свойства (отношение к таксономически значимым антимикробным веществам) фаготип (отношение к типовым бактериофагам – фаготипирование) хемотаксономические свойства (выделение вида таксономически значимым метаболитов, например, жирных кислот) антигенную структуру (серотипирование) профиль ДНК и рибосомальной 16S – РНК (генотипирование, филотипирование) Приёмы идентификации чистой культуры по биохимическим свойствам: протеолитическая активность – определяют на среде с белками, посев в пробирку с мясопептонным бульоном с двумя индикат бумажками, бактерии при расщеплении белка выделяют индол или сероводород и соответсвующий индикатор меняет цвет сахаролитическая активность (принцип пестрого ряда Гисса) – посев в пробирке с глюкозой, лактозой, мальтозой сахарозой или манитом – среда поменяет цвета за счет изменения цвета индикатора с помощью тест-системы API Идентификация энтеробактерий по биохимическим свойствам с помощью тест-системы EnteroTube. Через отсеки проходит канал с тонким металлическим стержнем, выступающим концом касаются колонии и затем протягивают его через все отсеки, засевая таким образом все среды. Результаты оценивают после инкубации в течение 24 часов, рез-ты вносят в бланк, затем используют специальную кодовую книгу. Рекомендуют для диагностики Гр- оксидазоотрицательных бактерий 2. Определение чувствительности к антибиотикам Диско-диффузионный метод определения чувствительности к антибиотикам На чашку с плотной пит средой производят посев сплошным газоном. Раскладывают диски, пропитанные различными препаратами. После культивирования вокруг некоторых дисков есть зоны отсутствия роста бакт культуры. Производят замер зон задержки роста: менее 15мм-низкочувствительная, 15-24мм- среднечувствительная, более 25мм-высокочувствительная. Кассетный микрометод Для анаэробов, можно определить чувствительность к антибиотикам без выведения чистой кульуры Забор гнойного отделяемого из очага гнойного воспаления, культивирование в сахарном бульоне не менее 2 ч, введение дисков с антибиотиками, инкубирование в течение2ч. Чем меньше мутность, тем выше чувствительность Бактериологический метод позволяет определить культуральные свойства: Характер роста на плотных средах: При описании колоний учитывают следующие признаки: форму колонии - округлая, амебовидная, ризоидная , неправильная и т.д.; (н-р сибирская язва растет в виде львиной гривы, в-ль чумы – в виде кружевного платочка) размер (диаметр) колонии - очень мелкие (точечные) (0,1-0,5 мм), мелкие (0,5-3 мм), средних размеров (3-5 мм) и крупные (более 5 мм в диаметре); поверхность колонии - гладкая, шероховатая, складчатая, морщинистая, с концентрическими кругами или радиально исчерченная; профиль колонии - плоский, выпуклый, конусовидный, кратерообразный и т.д.; край колонии - ровный, волнистый, зубчатый, бахромчатый и т.д.; прозрачность - тусклая, матовая, блестящая, прозрачная, мучнистая; цвет колонии (пигмент) - бесцветная или пигментированная (белая, желтая, золотистая, красная, черная), особо отмечают выделение пигмента в среду с ее окрашиванием - если пигмент не растворим в воде, окрашивается только культуральный налет, если же он растворим, окрашивается и питательная среда. структура колонии - однородная, мелко или крупнозернистая, струйчатая; край и структуру колонии определяют с помощью лупы или на малом увеличении микроскопа, поместив чашку Петри с посевом на столик микроскопа крышкой вниз; консистенция колонии - определяют прикасаясь к поверхности петлей, колония может быть плотной, мягкой, врастающей в агар , слизистой (тянется за петлей), хрупкой (легко ломается при соприкосновении с петлей). В полости рта есть пигментообразующие бактерии – они пародонтопатогенные. На кровяном агаре образуют черный налет из-за пигмента меланина Staphylococcusaureus - золотисный; водонерастворимый Micrococcusluteus - желтый; водонерастворимый Micrococcusroseus - розовый; водонерастворимый Mycobacteriumphlei - оранжевый; водонерастворимый Serratiamarcescens - оранжевый/красный; водонерастворимый Pseudomonasaeruginosa - зеленый/синий; водорастворимый В природе существуют, так называемые, фосфоресцирующие бактерии, культуры которых светятся в темноте зеленовато-голубоватым или желтоватым светом. Такие бактерии встречаются, главным образом, в речной или морской воде. К светящимся бактериям - фотобактериям - относятся аэробные бактерии (вибрионы, кокки, палочки). Отличия бактериального метода для анаэробов: Транспорт на тиогликолевых средах, среда Стюарта, среда Эймса? Культивацию проводят в анаэростате. В колбу закладываются чашки с посевами, аппарат герметично закрывают, через клапан откачивают воздух, закачивает газовую смесь (N-80%,Н2-10%, СО2-10%), анаэростат помещают в термостат. Анаэробиоз могут создать и с помощью газогенерирующего пакета. Принцип действия основан на активировании газогенерирующих пакетов. Когда пакет вынимается из его упаковки, он активируется, находясь на воздухе. Активированный пакет и образец помещаются в инкубационный контейнер. получение изолированных колоний в условиях анаэробиоза на 5% кровяном агаре с гемином и менадионом получение чистых культур (ЧК); идентификация (ЧК) по морфологическим, культуральным и биохимическим свойствам определение чувствительности к АБ Таким образом, бактерии можно идентифицировать культуральными и молекулярными методами, но некультивируемые бактерии — только молекулярными методами. Идентификация бактерий молекулярными методами чаще основана на анализе нуклеотидных последовательностей их рибосомных 16S-генов. Такой анализ позволяет также выявлять филогенетические связи, что важно для классификации бактерий. |
