Лабораторные работы по биохимии. Занятие Строение, свойства и функции белков
 Скачать 212.5 Kb. Скачать 212.5 Kb.
|
Аскорбиновая кислота легко окисляется в дегидроаскорбиновую кислоту( см. учебник А.Я. Николаева “Биологическая химия”, стр. 402). РЕАКТИВЫ: 1%-ный раствор I2 в KI; порошок аскорбиновой кислоты. ХОД РАБОТЫ. К 5-10 каплям 1%-ного раствора I2 в растворе KI прибавляют небольшое количество аскорбиновой кислоты. Наблюдают обесцвечивание раствора. ЛАБОРАТОРНАЯ РАБОТА № 9. Тема: «КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ВИТАМИНЫ». 1) Реакция восстановления рибофлавина (витамин В2 ). Рибофлавин обладает окислительно-восстановительными свойствами. Физио-логическая роль витамина В2 выяснилась, когда было установлено, что рибофлавин входит в состав коферментов ФАД и ФМН, являющихся простетической группой ряда ферментов, относящихся к классу оксидоредуктаз. Реакция обусловлена восстановлением рибофлавина выделяющимся водородом сначала в рибофлавин (промежуточное соединение красного цвета), а затем в бесцветную лейкоформу: Рибофлавин (окисленная форма Рибофлавин (восстановленная желтого цвета) форма, бесцветная). МАТЕРИАЛ ИССЛЕДОВАНИЯ: 0,25%-ный раствор рибофлавина в воде. РЕАКТИВЫ: цинк металлический в гранулах; HCl (конц.). ХОД РАБОТЫ. В пробирку наливают 10 капель взвеси рибофлавина в воде, добавляют 5 капель концентрированной соляной кислоты и опускают гранулу металлического цинка. Выделяющийся в ходе реакции водород взаимодействует с рибофлавином: раствор приобретает постепенно розовую окраску, затем обесцвечивается. Лабораторная работа №10. “Количественное определение витамина Р в чае”. Действие витамина Р и витамина С взаимно связано, они участвуют в окислительно-восстановительных процессах. Терапевтическое действие витамина С более эффективно в присутствии витамина Р. У человека повышается проницаемость капилляров. Рутин – кристаллическое вещество жёлто-оранжевой окраски. Содержится в тех же продуктах, что и витамин С: в чае, фруктах и ягодах – бруснике, клюкве и др. Количественное определение витамина Р проводят в вытяжке из чая. Принцип метода: рутин способен окисляться перманганатом калия; в качестве индикатора применяется индигокармин, который вступает в реакцию с перманганатом калия после того, как окислится весь рутин. Экспериментально установлено, что 1 мл 0,1 н раствора перманганата калия окисляет 6,4 мкг рутина. Реактивы: Перманганат калия, 0,05 н раствор; Индикатор с индигокармином; Оборудование: стаканчики или колбочки; Пипетка вместимостью 10 мл; Микробюретка; Исследуемый материал: Чай или готовый экстракт. Ход работы. К 100 мг чая приливают 50 мл горячей дистиллированной воды и проводят экстракцию в течение 5 минут. 10 мл экстракта чая отмеривают в стаканчик или колбочку, добавляют 10 мл дистилированной воды и 5 капель индигокармина (появляется синее окрашивание). Титруют из микробюретки 0,05 н раствором KMnO4 до появления устойчивой жёлтой окраски. Определяют процентное содержание рутина в чае. Расчёт производят по следующей формуле: 3,2 ∙ A ∙ V1 ∙ 100  X = X = V2 ∙ P ∙ 1000 Где Х – содержание витамина Р в препарате, %; 3,2 – стандартный коэффициент пересчёта; А – объём 0,05 н раствора перманганата калия, пошедшего на титрование раствора, мл; V1 – объём, в котором растворена взятая для анализа навеска, мл; 100 – общее количество вещества для расчёта процентного содержания, г; V2 – объём раствора, взятого для титрования, мл; Р – навеска, мг; 1000 – перевод микрограммов в миллиграммы (Р = 30-50 мг/100 г). К занятию иметь пакетик чая (2г) на группу! ВЕСЕННИЙ СЕМЕСТР. ЛАБОРАТОРНАЯ РАБОТА № 11. ОРТОТОЛУИДИНОВЫЙ МЕТОД: ОПРЕДЕЛЕНИЕ ГЛЮКОЗЫ В СЫВОРОТКЕ КРОВИ. Глюкоза при нагревании с ортотолуидином в растворе уксусной кислоты дает синезеленое окрашивание, интенсивность которого прямо пропорциональна концентрации глюкозы и определяется на фотоэлектроколориметре: 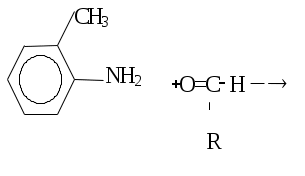 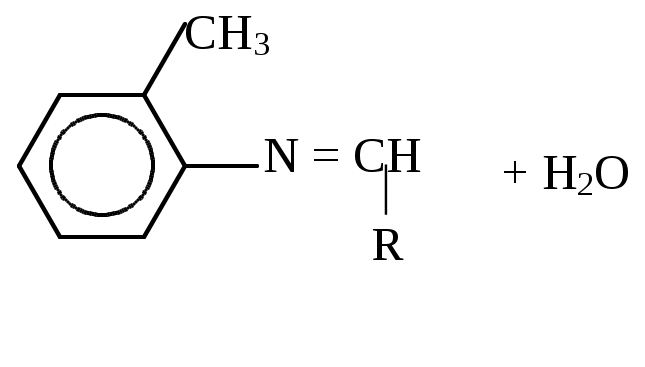 Орто-толуидин глюкоза С ортотолуидиновым реактивом реагируют все альдогексозы, но их содержание в крови невелико, поэтому метод позволяет определить практически одну глюкозу. РЕАКТИВЫ: 1. Трихлоруксусная кислота, 3%-ный раствор. 2. Ортотолуидиновый реактив. 3. Стандартный раствор глюкозы, 1 г/л (100 мг % раствор), готовят ex tempore. ОБОРУДОВАНИЕ: Центрифуга, центрифужные пробирки, микропипетка вместимостью 0,1 мл, пипетка вместимостью 1 мл, ФЭК, кровь или сыворотка крови. ХОД РАБОТЫ: В две пробирки наливают по 0,9 мл (18 капель) 3%-ного раствора трихлоруксусной кислоты, затем в одну из них вносят 0,1 мл (2 капли) крови, взятой из пальца (или сыворотка крови), а в другую – 0,1 мл (2 капли) стандартного раствора глюкозы. Содержимое пробирок перемешивают и центрифугируют при 3000 оборотах в минуту в течение 10 минут. Для определения берут по 0,5 мл (10 капель) надосадочной жидкости из каждой пробирки, вносят в обычные сухие пробирки, добавляют по 4,5 мл ортотолуидинового реактива и помещают пробирки в кипящую водяную баню на 8 мин. Необходимо следить, чтобы вода в бане непрерывно кипела. Вынимают пробирки и охлаждают их водопроводной водой до комнатной температуры. Затем измеряют на фотоэлектроколориметре оптическую плотность проб в кюветах на 10 мм против воды с красным светофильтром (620 нм); поскольку контроль на реактивы на ФЭК равен нулю, окраска ортотолуидинового реактива не развивается. РАСЧЕТ: Содержимое глюкозы в опытной пробе рассчитывают по стандартному раствору глюкозы по формуле: Сст Еоп Соп = ——————, Ест где Соп – концентрация глюкозы в крови в пробе, ммоль/л; Сст – концентрация глюкозы в стандартной пробе,100 мг/100 мл; Еоп – оптическая плотность пробы; Ест – оптическая плотность стандарта глюкозы. Коэффициент пересчета в единицы СИ (ммоль/л) равен 0,0555. Нормальное содержание глюкозы в сыворотке крови человека, определяемое ортотолуидиновым методом, колеблется в пределах 3,33-4,99 ммоль/л (60-90 мг%). ЛАБОРАТОРНАЯ РАБОТА № 12 Тема: «ОПРЕДЕЛЕНИЕ ГЛЮКОЗЫ В МОЧЕ». Исследуемый материал: моча. Реактивы: бумага реактивная «Глюкотест». ХОД РАБОТЫ: Полностью смочить в моче желтую полоску реактивной бумаги. Поместить реактивную бумажку на пластмассовую пластинку и выдержать около 5-10 минут. Сравнить изменившуюся окраску желтой полоски с цветной шкалой. Примечания: Для исследования использовать свеженабранную мочу, взятую до приема пищи. На точность анализа отрицательно влияет присутствие в моче аскорбиновой кислоты. Не дотрагивайтесь пальцами желтой полоски реактивной бумаги. Беречь от солнечных лучей и влаги! ЛАБОРАТОРНАЯ РАБОТА № 13 Тема: «КАЧЕСТВЕННАЯ РЕАКЦИЯ НА НАЛИЧИЕ ФЕНИЛПИРОВИНОГРАДНОЙ КИСЛОТЫ В МОЧЕ». Накопление фенилпировиноградной кислоты в организме (в крови, в тканях) и наличие фенилпировиноградной кислоты в моче связаны с отсутствием у детей в печени фермента 4-фенилаланингидроксилазы. При этом фенилаланин не гидроксилируется и не превращается в тирозин. Накопление фенилаланина и продуктов его аномального распада, в частности фенилпировиноградной кислоты, в крови и тканях приводит к нарушению нормального развития мозга и появлению тяжелых нарушений психики ребенка. Доказательством данного наследственного заболевания – фенилпировиноградной олигофрении (слабоумия) – служит выявление повышенного содержания фенилаланина в крови (10-40 мг%) и наличие фенилпировиноградной кислоты в моче. Метод основан на способности енольной формы фенипировиноградной кислоты образовывать с ионами трехвалентного железа комплексное соединение, окрашенное в сине-зеленый цвет. ИСЛЕДУЕМЫЙ МАТЕРИАЛ: Моча. РЕАКТИВЫ: 1) Серная кислота, 5 Н раствор. 2) Хлорид железа (III) FeCl3, 10%-ный раствор. ОБОРУДОВАНИЕ: 1) Капельницы. 2) Пробирки. 3) Фильтры. 4) Пипетки на 5 мл. ХОД РАБОТЫ: К 5 мл свежепрофильтрованной мочи приливают 4 капли 5 Н раствора серной кислоты, перемешивают и добавляют к смеси 4 капли 10%-ного раствора FeCl3. При наличии в моче фенилпировиноградной кислоты через 30 сек – 1 мин появляется сине-зеленая окраска, исчезающая через 5 – 10 минут. УКАЗАНИЯ К СОСТАВЛЕНИЮ ОТЧЕТА: Написать в тетради образование фенилпировиноградной, фенилмолочной, фенилуксусной кислот из фенилаланина. Записать в тетрадь технику проведения качественной реакции на фенилпировиноградную кислоту. |
