Иммунология: великие открытия учёных. ИММУНОЛОГИЯ 1. Занятие 1 5 Открытия Луи Пастера i. Метод пастеризации
 Скачать 127.23 Kb. Скачать 127.23 Kb.
|
|
Вклад Р. Цинкернагеля и П. Догерти в открытие МНС-рестрикции (двойное распознавание): Цинкернагель и Догерти в опытах на мышах изучали, как иммунная система и особенно Т-лимфоциты, защищают организм от проникших в него вирусов менингита. В организме инфицированных мышей развивались Т-лимфоциты-киллеры, которые in vitro могли убивать клетки,]инфицированные вирусом. Но было сделано и неожиданное открытие: Т-лимфоциты, полученные от мыши линии А, в пробирке успешно уничтожали пораженные вирусом клетки, полученные от мышей той же линии А, но оказывались неактивны против таких же пораженных вирусом менингита клеток, полученных от мышей В. Таким образом, для того,чтобы пораженная клетка была уничтожена лимфоцитами-килерами, она должна быть не только инфицирована вирусом, но и нести на своей поверхности то же вариант антигенов гистосовместимости, что и в организме, из которого были взяты лимфоциты-киллеры. Несколько упрощая, можно сказать что лимфоциты уничтожали пораженные клетки только в собственном организме, а в чужом теряли свою активность. Результаты работы Цинкернагеля и Догерти, которые были опубликованы в Nature в 1974 году, убедительно продемонстрировали, что клеточная иммунная система должна одновременно распознавать и чужеродную молекулу, например, молекулу вируса, и молекулу МНС собственного организма. Стало очевидным, что антигены МНС играют важнейшую роль в нормальном иммунном ответе, а не только в отторжении трансплантатов. Впоследствии Догерти и Цинкернагель предложили две модели. Одна описывает единичное распознавание измененных тканей собственного организма (когда антиген гистосовместимости изменен вирусом). Вторая модель объясняет двойное распознавание «чужого» и «своего». В течение нескольких лет было продемонстрировано, что только те Т-лимфоциты, которые оказываются способными распознавать трансплантационные антигены собственного организма, выживают и созревают, остальные - элиминируются (не получают развития и исчезают). Поэтому, принцип одновременного (двойного) распознавания важен для способности иммунной системы отличать «свое» от «не-своего». Дальнейшие молекулярные исследования подтвердили обе модели Цинкернагеля и Догерти, а также разъяснили структурную основу их открытия. Небольшая часть молекулы, например, пептид из состава вируса, непосредственно привязана к определенной переменной части антигенов гистосовместимости организма. И именно этот комплекс узнается специфичными молекулами распознавания Т-лимфоцитов (рецепторами Т-клеток). Раскрыв механизмы, используемые иммунной системой, для того, чтобы отличать микробы от молекул собственного тела, открытие Догерти и Цинкернагеля существенно изменило представления о развитии и нормальном функционировании иммунной системы и обеспечило новые возможности для направленного влияния на иммунные реакции. Работы Р. Портера и Д. Эдельмана по установлению молекулярной структуры антител: В 60-х годах XX века, в основном благодаря работам Р. Портера и Дж. Эдельмана удалось расшифровать молекулярную структуру антител и их антигенсвязывающих центров, за что эти исследователи получили Нобелевскую премию 1972 года. Установленная еще в самом начале развития иммунологии высочайшая специфичность связывания антител с вызывающими их продукцию антигенами, с одной стороны, в ХХ веке получила широкое применение для очистки и идентификации органических молекул, а с другой стороны, стимулировала исследования, направленные на выяснение причин столь огромного разнообразия антител и распознающих антигены клеточных рецепторов. Две Нобелевские премии 80-х годов как раз и отражают эти два направления в развитии иммунологии в середине второй половины ХХ века. В тоже время прогресс молекулярной биологии позволил С. Тонегава показать, как генетические перестройки в хромосомах лейкоцитов обеспечивают фантастически богатое многообразие антител и антиген распознающих рецепторов, что также было удостоено в 1987 году Нобелевской премии. Клонально-селекционная теория иммунитета Ф. Бернета: Теория Бернета — теория, согласно которой в организме возникают клоны клеток, иммунокомпетентных в отношении различных антигенов; антиген избирательно контактирует с соответствующим клоном, стимулируя выработку им антител. Данная теория была разработана Франком Бёрнетом (1899—1985) для объяснения функционирования иммунной системы. Иммунный ответ должен определять огромное число антигенов . Поэтому человеческий организм должен синтезировать сотни тысяч молекул антител с различными распознающими областями Клонально-селекционная теория утверждает: 1. Антитела и лимфоциты с необходимой специфичностью уже существуют в организме до первого контакта с антигеном. 2. Лимфоциты, участвующие в иммунном ответе, имеют антигенспецифические рецепторы на поверхности своей мембраны. В случае B-лимфоцитов рецепторами являются молекулы той же специфичности, что и антитела, которые лимфоциты впоследствии продуцируют и секретируют. 3. Каждый лимфоцит несет на своей поверхности рецепторы только одной специфичности. 4. Лимфоциты, сенсибилизированные антигеном, проходят несколько стадий пролиферации и формируют большой клон плазматических клеток . Плазматические клетки будут синтезировать антитела только той специфичности, на которую был запрограммирован лимфоцит-предшественник. Сигналами к пролиферации служат цитокины , выделяемые другими клетками. Лимфоциты могут также сами начать выделять цитокины. Благодаря этому механизму клональной селекции антитела могут накапливаться в достаточно высокой концентрации, чтобы эффективно бороться с инфекцией . Подобный же механизм существует для селекции антиген-специфичных T-лимфоцитов. Пролиферирующему клону необходимо время для образования достаточного количества клеток. Вот почему проходит обычно несколько дней после контакта с антигеном, прежде чем в сыворотке обнаруживаются антитела. Поскольку эти антитела образовались в результате антигенного воздействия, мы говорим о приобретенном иммунном ответе. Интенсивность ответа, осуществляемого популяцией примированных лимфоцитов, возрастает, главным образом, за счет увеличения клеток, способных воспринимать антигенный стимул. При этом должна существовать комбинация механизмов, включающих хранение антигена, существование популяции лимфоцитов и постоянное поддерживание отдельных клонов клеток, что и приводит к способности иммунной системы к длительной памяти(приобретенного иммунитета). Один из наиболее эффективных контролирующих механизмов заключается в том, что продукт реакции одновременно служит ее ингибитором. Именно этот тип отрицательной обратной связи имеет место при образовании антител. Вклад Г. Снелла, П. Горрера и др. в открытие главного комплекса гистосовместимости (МНС) и его продуктов: Открытие MHC и роли гистосовместимости в трансплантации было результатом совместных усилий многих ученых в 20 веке . CC Little и Ernest Tyyzer предложили генетическую основу для отторжения трансплантата в статье Nature 1914 года , в которой показано, что опухоли, пересаженные между генетически идентичными мышами, растут нормально, но опухоли, пересаженные между неидентичными мышами, отторгаются и не растут. Питер Медавар предположил роль иммунной системы в отторжении трансплантата, чьи кожные трансплантаты жертвам Второй мировой войныпоказали, что трансплантаты кожи между людьми имеют гораздо более высокие показатели отторжения, чем аутологичные трансплантаты внутри человека, и что подавление иммунной системы задерживает отторжение трансплантата кожи. Медавар частично разделил Нобелевскую премию 1960 года за эту работу. В 1930-х и 1940-х годах Джордж Снелл и Питер Горер по отдельности выделили генетические факторы, которые, будучи сходными, позволяли проводить трансплантацию между линиями мышей, назвав их антигенами H и II соответственно. На самом деле эти факторы были одним и тем же, и локус получил название Н-2. Снелл ввел термин «гистосовместимость» для описания взаимосвязи между белками клеточной поверхности H-2 и принятием трансплантата. Жан Доссе открыл человеческую версию комплекса гистосовместимости в 1950-х годах, когда заметил, что реципиенты переливания крови вырабатывают антитела, направленные только против клеток донора. Было обнаружено, что мишенью этих антител, или человеческих лейкоцитарных антигенов (HLA), является человеческий гомолог MHC мыши Снелла и Горера. Снелл, Дауссет и Барудж Бенасерраф разделили Нобелевскую премию 1980 года за открытие MHC и HLA. Главный комплекс гистосовместимости (MHC) HLA, человеческая форма главного комплекса гистосовместимости (MHC), расположена на хромосоме 6 в позиции 6p21.3. Люди наследуют два разных гаплотипа HLA , по одному от каждого родителя, каждый из которых содержит более 200 генов, помогающих иммунной системе распознавать чужеродных захватчиков. Эти гены включают белки клеточной поверхности МНС класса I и класса II. Молекулы MHC класса I , HLA-A, HLA-B, HLA-C, присутствуют во всех ядерных клетках и отвечают за сигнализацию иммунной клетке о том, что антиген—это внутри клетки. Молекулы MHC класса II, HLA-DR, HLA-DQ и HLA-DP, присутствуют только на антигенпрезентирующих клетках и отвечают за представление молекул от вторгшихся организмов клеткам иммунной системы. Гены MHC очень полиморфны , с тысячами версий рецепторов MHC в популяции, хотя у человека не может быть более двух версий для локуса. Рецепторы MHC кодоминантно экспрессируются, что означает, что все унаследованные аллели экспрессируются индивидуумом. Большое разнообразие потенциальных аллелей и множественных локусов HLA позволяют создавать множество уникальных комбинаций у людей. Роль в трансплантации  Гены HLA и их расположение на хромосоме 6 После получения трансплантата Т-клетки реципиента будут активированы чужеродными молекулами MHC в донорской ткани и заставят иммунную систему атаковать донорскую ткань. Чем более похожи аллели HLA между донором и реципиентом, тем меньше чужеродных рецепторов в донорской ткани, которые иммунная система хозяина может распознать и атаковать. Количество и выбор молекул MHC, которые следует учитывать при определении того, являются ли два человека гистосовместимыми, колеблется в зависимости от применения; однако было показано, что комбинация HLA-A, HLA-B и HLA-DR улучшает результаты лечения пациентов. Гистосовместимость оказывает заметное влияние на трансплантацию целых органов, увеличивая ожидаемую продолжительность жизни как пациента, так и органа. Таким образом, сходство HLA является важным фактором при выборе доноров для трансплантации органов или тканей. Это особенно важно при трансплантации почек и поджелудочной железы . Из-за наследственной природы генов HLA члены семьи с большей вероятностью будут гистосовместимы. Вероятность того, что родной брат получил одинаковые гаплотипы от обоих родителей, составляет 25%, при этом существует вероятность 50%, что родной брат будет иметь только один общий гаплотип, и вероятность 25%, что у них не будет общих гаплотипов. Однако из-за изменчивости из-за межпородного скрещивания гаплотипы могут меняться между поколениями, а братья и сестры могут быть промежуточными совпадениями. Требуемая степень гистосовместимости зависит от индивидуальных факторов, включая тип ткани или органа и состояние здоровья реципиента. В то время как трансплантация целых органов может быть успешной между несовместимыми людьми, повышенная гистосовместимость снижает частоту отторжения, приводит к увеличению продолжительности жизни и, как следствие, снижению общих затрат на больницу. Влияние соответствия HLA различается даже при трансплантации целых органов, при этом некоторые исследования сообщают о меньшей важности трансплантации печени по сравнению с сердцем, легкими и другими органами. Для сравнения, трансплантация гемопоэтических стволовых клетокони часто требуют более высокой степени соответствия из-за повышенного риска реакции «трансплантат против хозяина», при которой иммунная система донора распознает молекулы MHC реципиента как чужеродные и вызывает иммунный ответ. Некоторые трансплантированные ткани не подвергаются воздействию Т-клеток , которые могли бы обнаруживать чужеродные молекулы MHC, такие как роговица , поэтому гистосовместимость не является фактором при трансплантации. Индивидуальные факторы, такие как возраст, иногда влияют на протокол сопоставления, поскольку иммунный ответ пожилых пациентов с трансплантатами на белки MHC медленнее, и поэтому для положительных результатов требуется меньше совпадений. Послеоперационная иммуносупрессивная терапия часто используется для снижения иммунного ответа и предотвращения отторжения ткани за счет ослабления реакции иммунной системы на чужеродные молекулы HLA и может увеличить вероятность успешной трансплантации при неидентичных трансплантатах. Тесты Из-за клинической важности гистосовместимости при трансплантации тканей для проверки экспрессии аллеля HLA используется несколько методов. Серологическое типирование Серологическое типирование включает инкубацию лимфоцитов реципиента с сывороткой , содержащей известные антитела против вариабельных аллелей HLA. Если сыворотка содержит антитела, специфичные для аллеля HLA, присутствующего на лимфоцитах реципиента, антитела будут связываться с клеткой и активировать сигнальный каскад системы комплемента, что приведет к лизису клеток . Лизированная клетка будет поглощать добавленный краситель, такой как трипановый синий, что позволяет ее идентифицировать. Сравнение сывороток, запускающих лизис клеток, позволяет идентифицировать аллели HLA, присутствующие на клеточной поверхности клеток-реципиентов. Преимущество серологического типирования заключается в быстрой идентификации экспрессированных аллелей HLA и игнорировании неэкспрессированных аллелей, которые могут иметь небольшое иммунологическое значение. Однако он не распознает подклассы аллелей, которые иногда необходимы для сопоставления. Молекулярная типизация Аллели HLA можно определить путем прямого анализа локусов HLA на хромосоме 6. Для идентификации аллелей HLA можно использовать специфичные по последовательности олигонуклеотидные зонды, ПЦР -амплификацию специфичных для последовательности праймеров и прямое секвенирование, часто обеспечивающее разрешение аминокислот на уровне генов. Молекулярные методы могут более точно идентифицировать редкие и уникальные аллели, но не дают информации об уровнях экспрессии. Вклад Ж. Доссе и его сотрудников в открытие HLA-антигенов: Интерес к структуре и болезням крови возник у Жана Доссе во время Второй мировой войны, когда он служил военным врачом в армии «Свободной Франции» на территории Северной Африки: ему приходилось множество раз проводить переливание крови раненым солдатам. По возвращении в Париж в 1944 году он начал работать в Региональном центре переливания крови при больнице Cвятого Антония. Первая работа Доссе по гематологии была посвящена обработанным трипсином эритроцитам в плазматической среде. Трипсин — вещество, вырабатываемое в первоначальном виде поджелудочной железой для расщепления белков и пептидов. Техника, предложенная Доссе в той статье, позволила отделять эритроциты от остальных компонентов крови с тем, чтобы изучить, в частности, их собственные параметры. Продолжив свои исследования структуры крови, он в 1952 году предложил способ выделения плазмы из красных кровяных клеток, чтобы можно было с меньшим риском делать переливания крови тем пациентам, которые по какой-либо причине слишком чувствительны к переливаниям. В дальнейшем Доссе сосредоточился на изучении гемолитических анемий, редких заболеваний, при которых возникает малокровие и увеличивается количество распавшихся эритроцитов в крови, а также агглютинации, т. е. склеивании, с последующим сгущением крови, кровяных клеток. В этот период Доссе впервые занялся веществами, препятствующими склеиванию лейкоцитов, кровяных клеток защиты. В 1958 году он обнаружил изоантитела — антитела, образующиеся в результате взаимодействия с изоантигенами, в частности при переливании крови, как реакция иммунитета на инородные клетки. Доссе продолжил исследовать антитела, анемии и агглютинации кровяных клеток и в скором времени обнаружил корреляцию между склеиванием лейкоцитов и приживаемостью пересаженных кожных тканей, что стало его первым наблюдением влияния антигенов на гистосовместимость — совместимость тканей и органов при пересадке, в первую очередь, кожи. После открытия явления, что группа лейкоцитарных антигенов с двумя аллелями влияет на гистосовместимость, и попыток снизить чувствительность организма к пересаживаемой коже, Доссе разработал систему группирования различных лейкоцитарных антигенов по их гистосовместимости. Вслед за этим у него появилась гипотеза о том, что все эти лейкоцитарные антигены являются частью единой системы. Позднее эта система получила название Главного комплекса гистосовместимости (Major Histocompatibility Complex, MHC). В этом комплексе сосредоточено чрезвычайно много генов, которые предоставляют организму фрагменты проникающих в организм антигенов микроорганизмов и кодируют белки, координируя работу иммунитета и способствуя подавлению инфекций. Позднее Доссе изучил значимость MHC для канцерогенеза, патофизиологического процесса, в результате которого возникают и развиваются раковые опухоли. В результате он пришел к выводу, что все изученные им антигены являются частями одной системы, которая была названа человеческим лейкоцитарным антигеном (Human Leucocyte Antigen, HLA); он располагается у человека в хромосоме 6 и играет важнейшую роль в иммунной системе. За эти и другие открытия в области иммунологии Доссе в 1980 году присуждают Нобелевскую премию по медицине и физиологии, которую он разделил с Джорджем Снеллом и Барухом Бенасеррафом. На средства от премии Доссе открывает Исследовательский центр полиморфизма человека (Human Polymorphism Study Center, CEPH). Работы Дж. Келера и Ц. Мильштейна по гибридомной технологии получения моноклональных антител: В 1975 г Келер и Мильштейн предложили гибридомную технологию получения в лаборатории моноклональных антител. В 1084 г они получили Нобелевскую премию за получение гибридомов – искусственные иммунокомпетентные клетки животных, работающие вне организма сколь угодно долго и производящие в неограниченном количестве моноклональные антитела. Принцип получения – в основе метода слияние соматических клеток с последующим выделением и наработкой, культивированием необходимого клона клеток. Клон – группа генетически идентичных клеток, возникающие неполовым путем от общего предка. Для этого берут смертные клетки иммунных лимфоцитов, выделенных из селезенки иммунизированного животного, и сливают их с «бессмертными» раковыми клетками (миеломными). Эти клетки интенсивно размножаются в лаборатории без всякого внешнего стимула. У этих клеток есть редкая особенность: в их цитозоле отсутствует фермент гипоксантинфосфорибозилтрансфераза, необходимый для переработки и усвоения гипоксантина. Это дополнительный (резервный) путь синтеза пуриновых азотистых оснований, без которых невозможен синтез нуклеиновых кислот и, соответственно, белков. Гипоксантин – яд для этих клеток. Зато у них, как у всех живых организмов, функционировал основной путь синтеза пуриновых оснований. Однако, этот путь можно блокировать противоопухолевым препаратом аминоптерином. Итак, гибридомы наследуют признаки обоих родителей: они способны синтезировать и выделять в окружающую среду антитела, содержат фермент гипоксантифосфорибозилтрансферазу и могут прекрасно развиваться на среде с гипоксантином. От раковых клеток они наследуют способность к безудержному и бесконтрольному росту и размножению. Этапы: 1. Антитела, синтезируемые гибридомами, могут быть наработаны в неограниченном количестве. Они моноклональны и идентичны по всем параметрам и взаимодействуют только с одной антигенной детерминантой. Мышей интенсивно иммунизируют антигеном: белком, бактериальной клеткой или клеткой животного происхождения. Через 3 дня берут селезенку и лимфатические узлы и из них готовят взвесь клеток (иммунных лимфоцитов); 2. Эти клетки сливают с раковыми (миеломными) клетками, добавляя полиэтиленгликоль для растворения поверхностных мембран клеток. При этом получают гибридомы с выходом 50%. 3. Отбор гибридом или освобождение от не слившихся родительских клеток. Для этого клетки культивируют в среде ГАТ, содержащей гипоксантин, аминоптерин и тимидин. Миеломные клетки погибают через несколько дней из-за неспособности синтезировать пуриновые основания. Лимфоциты селезенки погибают, т.к. не способны поддерживать свое существование вне организма. Сложно, выживают только гибридомы. 4. Клонирование и отбор нужных клонов антител. Выжившие в среде ГАТ клетки рассевают в специальные 96-луночные пластиковые планшеты. В каждую лунку помещают по 10 гибридомных клеток и культивируют их в присутствии «кормящих» клеток, способствующих их росту. После культивирования в течение нескольких дней проверяют клетки на присутствие нужных антител с помощью ИФА. 5. Реклонирование клеток из лунок с нужными антителами. Для этого их повторно рассевали по таким же лункам планшета, но из расчета 1 клетка на лунку и проверяли на наличие необходимых моноклональных антител. Процедуру повторяли 1-2 раза. 6. Наработка моноклональных антител (субкультивирование): культивируя клетки в неограниченном количестве нарабатывая моноклональные антитела и затем храня их при -70; другой способ наработки антител связан с тем, что полученные клетки вводят внутрибрюшинно мышам, вызывая развитие у мышей опухолей, а через 10-14 дней в асцитной жидкости каждой мыши 8-9 мл моноклональных антител. Делая пересевы от мыши к мыши можно наработать моноклональные антитела. Они настолько однородны, что могут рассматриваться как чистые химические реактивы. 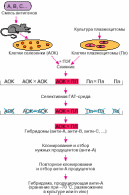 |
