Аллергозы Коллагенозы. Занятие 16 Тема Возбудители особо опасных вирусных инфекций (оои) вирус натуральной оспы, вирусы геморрагических лихорадок. Срс Вирусы семейства Arenaviridae
 Скачать 1.7 Mb. Скачать 1.7 Mb.
|
|
Занятие 16 Тема: Возбудители особо опасных вирусных инфекций (ООИ): вирус натуральной оспы, вирусы геморрагических лихорадок. СРС: Вирусы семейства Arenaviridae. Вопросы для обсуждения: 1. Понятие об особо опасных инфекциях (ООП). 2. Микроорганизмы как биологические патогенные агенты (БПА), которые могут быть потенциально применены в террористических целях. 3. Критерии при выборе микроорганизмов, используемых в качестве биологического оружия. 4. Вирус натуральной оспы: морфология и ультраструктура вириона, культивирование. 5. Патогенез и клинические проявления натуральной оспы. Ликвидация оспы в мире. 6. Принципы лабораторной диагностики особо опасных инфекций. 7. Филовирусы. Особенности морфологии и ультраструктуры вириона. 8. Патогенез и клинические проявления геморрагических лихорадок Марбург и Эбола. 9. Общие принципы противоэпидемических мероприятий, проводимых в отношении особо опасных инфекций. 10. Международные медико-санитарные правила биологической безопасности (MMCП). В настоящее время к особо опасным инфекциям относят чуму, холеру, сибирскую язву, ряд вирусных геморрагических лихорадок (лихорадки Эбола, Марбург, Ласса), желтую лихорадку, птичий грипп, тяжелый острый респираторный синдром (ТОРС) Особо опасные инфекции (ООИ) = группа острых заразных заболеваний человека, которые - способны к внезапному появлению, быстрому распространению и массовому заболеванию населения; - характеризуются тяжелым течением и высокой летальностью. ООИ могут представлять собой чрезвычайную ситуацию в системе охраны здоровья в международном масштабе. Список таких заболеваний сейчас значительно расширен. Он разделен на две группы. Первая группа — «болезни, которые являются необычными и могут оказать серьёзное влияние на здоровье населения» : оспа, полиомиелит, вызванный диким полиовирусом: человеческий грипп, вызванный новым подтипом; тяжелый острый респираторный синдром (ТОРС) или (SARS). Вторая группа - это «болезни, любое событие с которыми всегда оценивается как опасное, поскольку эти инфекции обнаружили способность оказывать серьёзное влияние на здоровье населения и быстро распространяться в международных масштабах»: холера, легочная форма чумы, желтая лихорадка, геморрагические лихорадки (лихорадка Ласса , Марбург, Эбола , лихорадка Западного Нила). Сюда же относят инфекционные болезни, «которые представляют особую национальную и региональную проблему». В России в эту группу включены: сибирская язва и туляремия. Микроорганизмы как биологические патогенные агенты (БПА), которые могут быть потенциально применены в террористических целях Для достижения целей террористических актов потенциально биологические агенты, используемые в этих целях, должны обладать: необходимой поражающей эффективностью; высокой контагиозностью (заразительностью), т.е. способностью с высокой частотой вызывать возникновение заболеваний среди неиммунизированных контингентов при минимальной заражающей дозе; значительной устойчивостью во внешней среде. Важными критериями определения пригодности биологических агентов для применения в террористических целях являются: трудность обнаружения агента после применения в воздухе, воде, на различных объектах внешней среды; сложность и длительность лабораторного определения вида агента; трудность быстрой диагностики возбудителя заболевания; способность инфекции к широкому эпидемическому распространению; отсутствие или недостаточная эффективность имеющихся в данное время средств иммунной и экстренной профилактики заболеваний. Выделяют следующие три категории биологических агентов, критически важных с точки зрения готовности различных служб, участвующих в ликвидации медико-санитарных последствий террористических актов к противодействию: Категория А: натуральная оспа (Variola major), сибирская язва (Bacillus anthracis), чума (Yersinia pestis), ботулизм (Clostridium botilinum), туляремия (francisella tularensis), геморрагические лихорадки (Filoviruses, Arenaviruses и т.д.); Категория В: Ку-лихорадка (Coxiella burnetii), бруцеллез (Brucella spp.), сап (Burkholderia mallei), мелиоидоз (Burkholderia pseudomallei), вирусные энцефалиты (VEE, WEE и т.д.), сыпной тиф (Rickettsia prowazekii), токсические синдромы (Toxins: ricin, Staph.В и т.д.), пситтакоз (Chlamidia psitlaci), агенты в пищевых продуктах (Salmonella spp., Shigella dysenteriae, E-coli 0157:H7, и т.д.), агенты водной среды (Vibrio cholerae, Cryptosporidium parvum и т.д.); Категория С: новые появляющиеся агенты (устойчивые к антибиотикам бактерии, микобактерии, туберкулеза, Нипа-вирус, ВИЧ-инфекция). Особое значение среди вероятных агентов имеют возбудители высококонтагиозных заболеваний чумы, натуральной оспы, лихорадок Марбург и Эбола. Вирус НАТУРАЛЬНОЙ ОСПЫ Натуральная оспа или, как её ещё называли ранее, чёрная оспа - высоко контагиозная (заразная) вирусная инфекция, которой страдают только люди. Её вызывают два вида вирусов: Variola major (смертность 20-40 %, по некоторым данным - до 90 %) и Variola minor (смертность 1-3 %). Люди, выживающие после оспы, могут частично или полностью терять зрение, и практически всегда на коже остаются м ног очи с ленные рубцы в местах бывших язв. Российские санитарно-эпидемиологические правила относят ВНО к I группе патогенности. По степени важности для национальной безопасности США возбудитель натуральной оспы относится к биологическим поражающим агентам категории А. Военными специалистами он рассматривается в качестве потенциального поражающего агента БО из-за низкой инфицирующей дозы для людей; устойчивости к высушиванию и длительному хранению, и при переводе в аэрозоль. Уже само слово «оспа» обладает большим психологическим эффектом. Упоминание в СМИ о появлении натуральной оспы в каком-то населенном пункте способно вызвать панику среди его населения и социальные эксцессы. Поксвирусы (Poxviridae от англ, pox — пустула + вирусы) — семейство крупных ДНК-содержащих вирусов, состоящее из двух подсемейств: Chordopoxvirinaе, содержащее вирусы оспы позвоночных (вирусы натуральной оспы, вакцины, оспы обезьян и др.), Entomopoxvirinae, включающее вирусы оспы насекомых.
Вирус вакцины: ДНК-содержащий вирус рода Orthopoxvirus семейства Poxviridae. Использовался в качестве живой вакцины при осуществлении программы ликвидации оспы на земле. Происхождение вируса вакцины неизвестно; является самостоятельным вирусом, отличающимся от возбудителя оспы коров. Считают, что вирус вакцины существует только в виде лабораторных штаммов. Вирус вакцины вызывает оспоподобные локальные поражения, иногда — генерализованную папулезную сыпь. Вирус оспы обезьян: ДНК-содержащий вирус рода Orthopoxvirus семейства Poxviridae. Вызывает поражения, сходные с проявлениями натуральной оспы. Вирус Орф: ДНК-содержащий вирус рода Parapoxvirus семейства Poxviridae. Вызывает контагиозную эктиму (болезнь Орф) — инфекционный пустулезный дерматит в виде лихорадки и везикулярных высыпаний на лице и руках. Основной резервуар вируса — овцы. Вирус контагиозного моллюска: ДНК-содержащий вирус рода Molluscipoxvirus семейства Poxviridae. Вызывает контагиозный моллюск — образование эритематозных узелков, превращающихся в жемчужно-розовые капсулы; возбудитель передается контактно через микротравмы кожи и слизистых оболочек. Поражает детей и взрослых. У взрослых поражения чаще локализуются в области гениталий. Танапоксвирусы человека: ДНК-содержащие вирусы рода Yatapoxvirus семейства Poxviridae. Вызывают лихорадку и образование на коже одного везикулярного очага. Вирус оспы Тана встречается среди племен в Кении, проживающих в долине реки и озера Тана. Два представителя подсемейства, вируса натуральной оспы и вирус контагиозного моллюска облигатные патогены человека; другие представители могут передаваться от животных к человеку как возбудители зоонозных инфекций. Строение ВНО 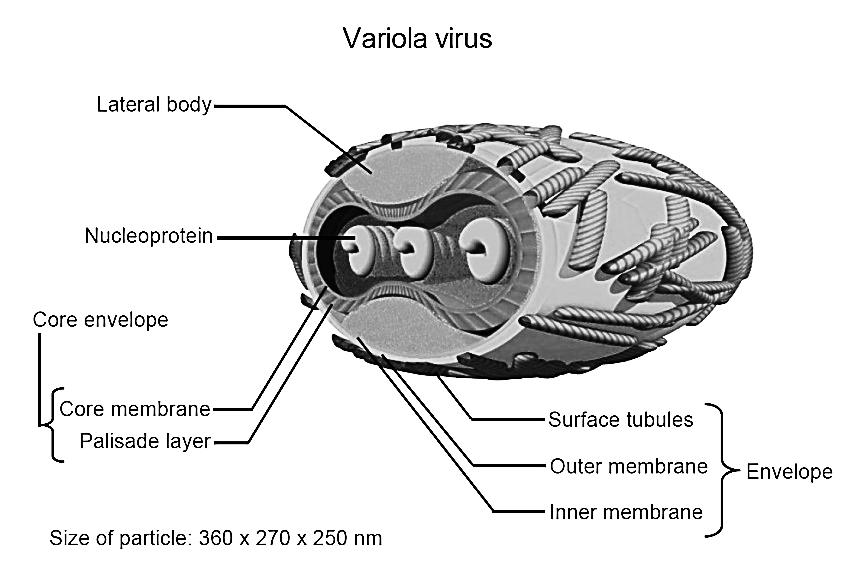 Во внешней оболочке содержится вирусный гемагглютинин, имеющий липопротеиновую природу. В состав вируса натуральной оспы входят 30 белков, более 10 из них — ферменты, катализирующие синтез нуклеиновых кислот. Вирус натуральной оспы проявляет гемагглютинирующие свойства; гемагглютинин состоит из трёх гликопротеинов. Антигены. Важнейшие Аг вируса оспы — нуклеопротеид NP (общий для всего семейства), S-термостабильный и L-термолабильный Аг, а также группа растворимых Аг. Вирусы оспы имеют общие антигены с вирусом оспенной вакцины и эритроцитами человека группы А и АВ. Репродукция ВНО 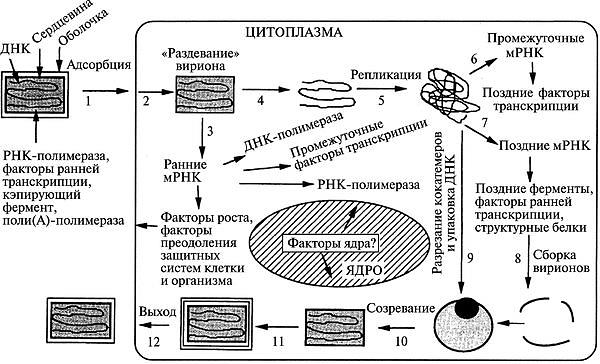 Вирионы ортопоксвирусов адсорбируются на клетке (1) и сливаются с плазматической мембраной клетки, высвобождая сердцевины в цитоплазму (2). Сердцевины синтезируют ранние мРНК, с которых транслируются различные белки, включая факторы роста, молекулы защиты от иммунной системы, ферменты и факторы для репликации ДНК и транскрипции промежуточных генов (3). Происходит «раздевание» сердцевины (4), и вирусная ДНК реплицируется, формируя конкатемер-ные молекулы (5). Промежуточные гены транскрибируются на дочерних молекулах ДНК и с этих мРНК транслируются факторы поздней транскрипции (6). Затем транскрибируются поздние гены. С их мРНК транслируются вирионные структурные белки, ферменты и факторы ранней транскрипции (7). Сборка вирионов начинается с образования дискретных мембранных структур (8). Конкатемерные промежуточные формы вирусной ДНК разделяются на единичные геномы и упаковываются в незрелые вирионы (9). Созревание приводит к образованию внутриклеточных зрелых вирионов (10). Эти вирионы покрываются модифицированными мембранами аппарата Еольд-жи и перемещаются к периферии клетки (11). Слияние таких вирионов с плазматической мембраной завершается высвобождением внеклеточного оболочечного вируса (12). Эпидемиология. Источником инфекции является больной человек, который заразен с последних дней инкубационного периода и до отпадения корок высыпаний. Инфицирование происходит воздушно-капельным, воздушно-пылевым, а также контактно-бытовым путями при соприкосновении с вещами больного, загрязненными слизью, гноем, калом и мочой, содержащими вирус. Патогенез. Вирус оспы проникает через слизистую оболочку дыхательных путей и через кожные покровы. Проникнув в организм, вирусы локализуются в регионарных лимфатических узлах (глоточное кольцо Пирогова-Вальдейера). Размножившись там, они попадают в кровь, обусловливая вирусемию. Из крови возбудитель заносится в кожу и лимфоидные ткани, в которых происходит размножение вирусов, формируются очаги поражения в коже, слизистых оболочках и паренхиматозных органах. Вторичная репродукция (размножение) происходит в лимфоидной ткани и сопровождается клиническими проявлениями заболевания: высокой температурой, головной болью, потерей сознания и т. д. Обладая дермотропными свойствами, вирусы попадают в эпидермис. На коже и слизистых оболочках образуются папулы, везикулы и пустулы. Оспенные папулы характеризуются прозрачным содержимым и имеют вид жемчужин с перламутровым блеском. На месте появления пустул образуется некроз, после заживления которого остаются рубцы. Образование рубцов на слизистой глаз приводит к слепоте (в 25% случаев). Процент смертности при оспе велик, при геморрагической форме - 100%. При этой форме пустулы наполняются кровью - черная оспа. Клинические проявления Различают несколько форм натуральной оспы: тяжелую форму (пустулезно-геморрагическая, или черная оспа, сливная оспа) со 100% летальностью; среднетяжелую форму (рассеянная оспа); легкую форму (модифицированная, вариолоид, оспа без сыпи, оспа без повышения температуры) Инкубационный период болезни — 7-17 сут. Период болезни подразделяется на: а) стадию предвестников (продром), в среднем длящуюся 2-4 сут; б) стадию высыпания продолжительностью 4-5 сут; в) стадию нагноения длительностью 7-10 сут. Обычная форма: Распространенная сыпь, элементы которой проходят характерную эволюцию (макула —» папула —» везикула —» пустула —» корки). Геморрагическая: инкубационный период длится не более 6-9 сут. Температура в первый день болезни поднимается до 41-42°С. Характерным для этой формы натуральной оспы является развитие множественных кровоизлияний в кожу и слизистые оболочки, важным симптомом являются кровоизлияния в субконъюнкти-вальную слизистую оболочку. Возникают обильные кровотечения из носа, рта, дыхательных путей, желудка, почек и других внутренних органов. Смерть обычно наступает на 2-3 сут болезни еще до развития оспенных высыпаний от резкого упадка сердечной деятельности. Сливная оспа (variola confluens). Начало болезни характеризуется высокой температурой (41-42 °С), сильными головными болями, тошнотой, рвотой, болями в мышцах, особенно в области крестца. Сыпь, появившись, быстро распространяется по всему телу, особенно поражая волосистую часть головы, лицо, слизистые оболочки верхних дыхательных путей и конъюнктиву глаз. Оспа средней тяжести (variola vera discreta). Продромальный период заболевания длится 3-4 сут. У больного резко поднимается температура, достигая 39,5-40,5 °С, иногда 41 °С, учащаются пульс и дыхание, наблюдается тошнота, рвота, мучительная головная боль и характерная боль в области крестца. Слизистые оболочки мягкого неба, носоглотки и зева резко воспалены. На 2-3 сут болезни примерно у 40 % больных появляется продромальная, или токсическая, сыпь. Высыпания появляются вначале на лице, затем на конечностях (как правило, на разгибательной поверхности) и на туловище. Вид мелких красных пятен. Обратное развитие продромальной сыпи происходит быстро, обычно в течение 12-24 ч – бледнеет и исчезает. К концу 4 сут в период продромальных явлений у больного резко снижается температура почти до нормы, улучшается общее состояние (характерно именно для НО), и на этом фоне появляется характерная для натуральной оспы сыпь. Высыпания появляются не только на кожных покровах, но и на слизистых оболочках конъюнктив, щек, мягкого неба, носоглотки, бронхов, пищевода и т. д. Раньше всего сыпь появляется на лице, волосистой части головы, шее, затем на руках, туловище и ногах. С образованием пустул начинается период нагноения. Он сопровождается вторичным подъемом температуры и резким ухудшением состояния больного. Температура держится в течение нескольких дней вплоть до подсыхания пустул. Присоединяющаяся вторичная инфекция отягощает клиническую картину болезни. В этот период наступает отек кожи, особенно на лице. Часто наблюдаются кровоизлияния в субконъюнктивальную слизистую оболочку. Это ведет к развитию панофтальмита, кератита и ирита, что в дальнейшем может привести к потере зрения. Резкая боль и отек настолько сильны, что больной не может шевелить пальцами. В этот период больные часто погибают от бронхопневмонии, ослабления сердечной деятельности и от сепсиса, вызываемого вторичной инфекцией. С 12-14 сут гнойное содержимое пустул начинает подсыхать с образованием плотных корок, которые постепенно отпадают. Отечность, воспаление кожи и слизистых оболочек постепенно исчезают, общее состояние больного улучшается, температура снижается. На месте отпавших корок остаются красноватые пятна. В том случае, если нагноением были затронуты глубокие слои кожи, то после отпадения корок образуются стойкие обезображивающие рубцы, особенно заметные на лице. Развитие рубцов в глазу ведет к частичной или чаще к полной потере зрения. В неосложненных случаях болезнь обычно продолжается 5—6 нед. Летальность при этой форме оспы составляет до 15 %. Лабораторная диагностика Диагностика вируса натуральной оспы включает вирусоскопические, вирусологические и серологические методы. Материал для исследования 1. Содержимое папул, везикул, пустул. 2. Отделяемое слизистой оболочки носоглотки. 3. Кровь (с 5-го дня болезни) берут для выявления специфических антител. Способы сбора материала     Основные методы исследования 1. Метод иммунофлюоресценции (экспресс-диагностика). 2. Реакция РСК, РТГА и РНГА. 3. Выделение вируса в куриных эмбрионах и культуре клеток Hela, Нер-2. 4. Обнаружение телец Гварниери в зараженных клетках. 5. Обнаружение телец Пашена в содержимом везикул (окраска по Морозову). • Наиболее эффективный метод диагностики вируса натуральной оспы — электронная микроскопия материала. При отсутствии соответствующего оборудования можно проводить световую микроскопию окрашенных мазков для выявления телец Пашена-Гварниери (ацидофильные овальные структуры, располагающиеся около ядра). Для экспресс-диагностики проводят определение вирусных Аг в мазках-отпечатках с помощью РНИФ. В отделяемом пузырьков и пустул вирусные Аг определяют в реакциях иммунодиффузии, РСК или ИФА. • Выделение возбудителя натуральной оспы проводят заражением хорион-аллантоисной оболочки куриных эмбрионов, где вирус образует белёсые бляшки. Также можно использовать культуры фибробластов эмбриона человека или клеток почек обезьян и оценивать цитопатический эффект (изменение морфологии и гибель клеток). Характер повреждений, а также предельная температура размножения вируса помогают дифференцировать возбудителя натуральной оспы от вирусов оспы животных (обезьян, верблюдов, коров и т.д.). 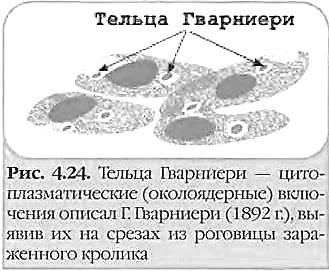 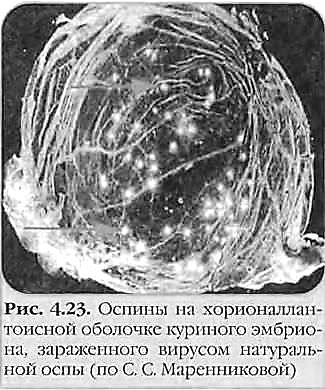 • Идентификацию возбудителя натуральной оспы проводят в РН, РТГА и РПГА. Лечение и профилактика 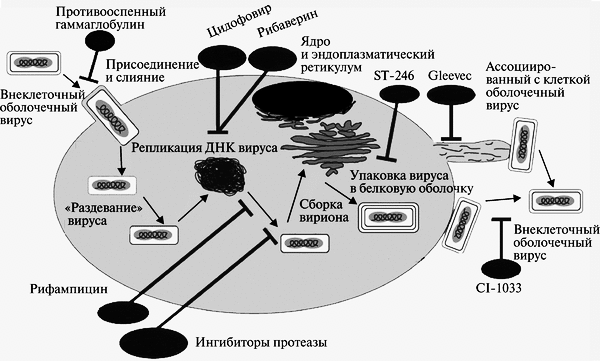 Антивирусные препараты. Для лечения и экстренной профилактики оспы используется метисазон (марборан), подавляющий внутриклеточную репродукцию вируса оспы. Он особенно эффективен на ранних стадиях заболевания и в инкубационном периоде. Метисазон нарушает процесс сборки вирионов, угнетает синтез вирусных структурных белков. Рифампицин — подавляет ДНК-зависимую РНК-полимеразу микроорганизмов. Размножение поксвирусов рифампицин блокирует, предотвращая расщепление прекурсорных белков. Клиническая эффективность показана только при применении очень высоких доз, что исключает его широкое применение. Цидофовир — ациклический нуклеозид фосфонат. Селективно ингибирует вирусную ДНК-полимеразу, тем самым блокирует вирусную репликацию и транскрипцию. Рекомендуется для лечения поксвирусных инфекций, в том случае, если гипериммунный противооспенный иммуноглобулин оказывается неэффективным. Адефовир — ациклический аналог адено-зина монофосфата. В клетке фосфорилируется под действием клеточных киназ в активный метаболит — адефовира дифосфат. Он ингибирует ДНК-полимеразу ДНК-вирусов (обратную транскриптазу), конкурируя с естественным субстратом дезоксиаденозина трифосфатом и вызывая обрыв цепи ДНК после его инкорпорации в вирусную ДНК. Профилактика В 1967 г. ВОЗ разработала детальную программу мероприятий по ликвидации оспы во всем мире, широкую материальную помощь ей оказали СССР, США, Швеция и другие страны. Использовались живые вакцины, в состав которых входил вирус осповакцины. Иммунизация осповакциной защищала также от инфекции вирусом оспы обезьян. В результате выполнения программы натуральная оспа как заболевание была глобально ликвидирована. В 1977 г. в Сомали был зарегистрирован последний случай оспы в мире. Таким образом, оспа исчезла как нозологическая форма благодаря вакцинации населения. В дальнейшем согласно рекомендациям ВОЗ обязательная вакцинация населения против оспы была отменена. Ее следует проводить только персоналу лабораторий, работающих с вирусом оспы обезьян и другими ортопоксвирусами, а также сотрудникам научных и медицинских групп, обследующих природные очаги оспы обезьян. С учетом длительного срока, прошедшего после отмены противооспенной вакцинации, у подавляющего большинства населения Земли иммунитет к вирусу натуральной оспы в настоящее время отсутствует. Геморрагические лихорадки Группа острых вирусных лихорадочных природно-очаговых заболеваний, характеризующаяся системным поражением мелких кровеносных сосудов с развитием геморрагического синдрома Этиология Nairovirus (Крым-Конго ГЛ), Togaviridae - Flavivirus (желтая лихорадку), Filoviridae - лихорадки Эбола, Марбург, Arenaviridae (Ласса). Инактивируются при температуре 50 °С в течение 30 мин, при 0-4 °С сохраняются до 12 час. Эпидемиология Источник возбудителя - при лихорадке Ласса - многососковая крыса, Эбола и Марбург - приматы, желтой - обезьяны, ежи (джунглей), человек (городская). Механизм передачи - аэрогенный, контактный, трансмиссивный. Aedes aegypti - переносчик желтой лихорадки Клиника Повышение температуры тела, миалгии, конъюнктивит, язвенно-некротический фарингит. Кровотечения разной локализации, петехиальная сыпь, реже - розеолы, папулы, пятна. Сильная головная боль, головокружение, сонливость, нарушение сознания, менингеальные знаки (при нормальном составе ликвора). Тошнота, рвота, понос, обезвоживание, боль в животе и фуди, кашель, дизурия, лимфаденопатия. Относительная брадикардия, дикротия пульса. Увеличена печень. Отек лица и шеи, экссудаты (плевральный, перикардиальный, перитонеальный). При желтой лихорадке - желтуха, олигоанурия. Лейкопения, сдвиг формулы влево, тромбоцитопения, СОЭ до 40-80 мм/час. Осложнения - пневмония, отек легких, уремия, ИТШ, орхит, панкреатит, увеит. Летальность до 30-67-90 %. В реконвалесценции астения, ухудшение слуха, облысение. ФИЛОВИРУСЫ. Особенности морфологии и ультраструктуры вириона Филовирусы (сем. Filoviridae, род Filovirus). К ним относятся вирусы Марбург и Эбола. Название семейства произошло от латинского слова filus — нить. Семейство Filoviridae относится к порядку Mononegavirales. В состав семейства входит 3 рода, 2 из которых содержат патогенных для человека представителей. Род Marburgvirus включает единственный одноименный вид – вирус Марбург. Род Ebolavirus объединяет 5 видов: эболавирусы Судан, Заир, Бундибугио, Рестон, эболавирус леса Тай. Наиболее патогенным для человека является вирус Заир; вирус Рестон заболеваний у людей не вызывает. Морфология и ультраструктура вирионов Вирион филовирусов имеет липидную оболочку и форму закрученных нитей длиной 600-800 нм и толщиной 50 нм. Тип симметрии вируса – спиральный. Различия в последовательности геномной РНК вирусов Марбург и Эбола превышают 50%. Вдоль оси вириона располагается нуклеокапсид, состоящий из геномной РНК и 4 структурных белков: NP (нуклеопротеид), VP30 (кофактор вирусной полимеразы), VP35 (фосфопротеин) и L (вирусная РНК-зависимая PHК-полимераза). Вирионы обладают наружной липидной оболочкой суперкапсидом (сложные вирусы). На поверхности суперкапсида имеются гликопротеиновые рецепторы (белки GP). Белок GP состоит из субъединиц GP1 и GP2. В ходе репродукции вирусов основная часть белка GP (до 80%) синтезируется в растворимой форме (секретируемый белок sGP). Матриксные белки VP24 и VP40 располагаются под липидной оболочкой и покрывают нуклеокапсид вируса; Два белка матрикса - VP40 и VP24 - участвуют в отпочковывании и раздевании вируса. Геном представлен линейной несегментированной однонитевой отрицательной (–) РHK. Геном содержит 7 открытых рамок считывания — по одной на каждый ген. В составе регуляторных последовательностей, фланкирующих гены, содержится высококонсервативный пентамер 3'-UAAUU-5', по которому последовательности генов могут перекрываться: у представителей рода Ebolavirus такое перекрытие имеет место в трех местах: между VP35 и VP40 , GP и VP30 , VP24 и L ; у представителей рода Marburgvirus имеется лишь одно перекрытие генов - между VP30 и VP24 . Матричная РНК GP имеет особенность: полноразмерный GP транслируется с мРНК, получаемой в результате транскрипционного редактирования соответствующего гена - вирусная полимераза вносит "лишний" остаток аденина при синтезе последовательности, комплементарной полиуридиновому фрагменту, в результате сдвига рамки считывания. В 80% случаев редактирования не происходит, а получаемые мРНК служат матрицей для синтеза секретируемого sGP. Первичный продукт трансляции гена GP (preGP) подвергается многоступенчатой посттрансляционной модификации: отщепление сигнального пептида, N-гликозилирование (включая их созревание в цистернах аппарата Гольджи ), ацилирование, О-гликозилирование, протеолитическое расщепление до GP1 и GP2 фуриновой протеазой; VP30 подвергаются О-гликозилированию, NP - фосфорилированию и О-гликозилированию. Репродукция. Клетками-мишенями филовирусов являются клетки миелоидного ряда (моноциты/макрофаги, гепатоциты, дендритные клетки) и клетки эндотелия, содержащие на своей поверхности специфические лектины (DC-SIGN , L-SIGN , hMGL , FR-альфа), с которыми связывается субъединица GP1, активирует трансмембранную субъединицу GP2 , и вирион проникает в клетку в эндосомах с низким значением рН. Происходит слияния мембран вириона и эндосомы, в цитоплазму клетки высвобождается нуклеокапсид. Репликация вирусного генома происходит в цитоплазме. Белки GP и NP синтезируются на рибосомах шероховатого ретикулума, остальные вирусные белки - на свободных рибосомах. Сборка вирионов происходит на цитоплазматической мембране. Культивирование.Филовирусы культивируют на культурах клеток Vero, MA104 и SW13. Быстро вызывают цитопатологию с образованием больших цитоплазматических телец-включений. Для изучения репликации филовирусов также с успехом использовали человеческие микроваскулярные эндотелиальные клетки и периферические клетки крови (моноциты и макрофаги). Геморрагическая ЛИХОРАДКА МАРБУРГ Лихорадка Марбург - острая вирусная болезнь, характеризующаяся тяжелым течением, высокой летальностью, геморрагическим синдромом, поражением печени, желудочно-кишечного тракта и центральной нервной системы. В 1967 г. Лихорадка Марбург впервые была зарегистрирована в Германии и Югославии среди работников, контактировавших с мартышками из Уганды. Болезнь эндемична для стран Восточной и Южной Африки (ЮАР, Кения, Зимбабве). Путь передачи — прямой контакт, от больных к здоровым. Наиболее доказан парентеральный путь заражения, но возможны и другие пути — аэрозольный, контактный, пищевой, не исключена трансмиссивная передача. Вирус размножается в комарах Aedes aegypti, термостабилен, чувствителен к этиловому спирту, хлороформу. Патогенез После проникновения вируса в организм и первичной репродукции в клетках развивается вирусемия с лихорадочной реакцией. На ранних этапах заболевания выявляют нарушения реологических свойств крови и микроциркуляции, что приводит к развитию геморрагических проявлений. Гибель инфицированных клеток и очаговые некротические изменения в тканях внутренних органов -это усиливает развитие интоксикации. Отсутствие адекватных защитных реакций со стороны клеточной и гуморальной систем иммунитета приводит к размножению и диссеминированию возбудителя. Клиника. Инкубационный период колеблется от 3 до 9 дней. Начало болезни острое, развивается выраженная лихорадка с геморрагической сыпью, печеночной и почечной недостаточностью. Отмечаются, психические и неврологические нарушения. Летальность достигает 3050%. Лабораторная диагностика Вирус находят в носоглоточной слизи, рвотных массах, фекалиях, крови и во всех выделениях, содержащих кровь, слёзной жидкости, сперме. В гемограмме уже в первые дни болезни отмечают выраженную лейкопению и тромбоцитопению. Специфические методы исследования: Прямая электронная микроскопия крови больных, РНИФ, ИФА, постановку РСК, РИА. В качестве экспресс-метода применяют ПЦР на выявление РНК вируса. БОЛЕЗНЬ, ВЫЗВАННАЯ ВИРУСОМ ЭБОЛА – острая природно-очаговая зоонозная вирусная инфекция, характеризующаяся лихорадочно-интоксикационным синдромом, явлениями универсального капилляротоксикоза с выраженным геморрагическим синдромом, полиорганными поражениями и высоким уровнем летальности. Возбудителем заболевания являются вирусы из рода Ebolavirus семейства Filoviridae. По антигенным свойствам гликопротеинов (GP) выделяют пять видов – Bundibugyo ebolavirus (BDBV), Reston ebolavirus (RESTV), Sudan ebolavirus (SUDV), Tai Forest ebolavirus (TAFV), Zaire ebolavirus (EBOV). Четыре из них вызывают различные по тяжести заболевания у людей в Африке (TAFV – летальность 0%, BDBV – летальность до 30%, SUDV – летальность до 50%, EBOV – летальность до 90%). Лихорадка Эбола впервые зарегистрирована в 1976 г. в Заире (в устье реки Эбола). Последняя вспышка – 2014. Антитела к вирусу обнаружены у жителей разных стран Центральной Африки. Эпидемиология. Предполагают, что резервуаром вируса являются дикие грызуны или летучие мыши (крыланы). Путь передачи — контактный (через кровь, мокроту и сперму), а также при косвенном контакте со средами, загрязненными такими жидкостями. Среди контактных лиц, включая медицинских работников — аэрозольный. + артифициальный. Погребальные обряды, при которых присутствующие на похоронах люди имеют прямой контакт с телом умершего,также могут играть значительную роль в передаче вируса Эбола. Б. заразен в течение 3 нед. от начала болезни. Патогенез. В течение инкубационного периода вирус реплицируется в регионарных лимфатических узлах, селезёнке и, возможно, других органах. Вирус обладает уникальной способностью дезактивировать работу интерферонов. Белок вируса Эбола VP24 практически полностью блокирует реакцию иммунитета на вторжение блокируя транспорт транскрипционного фактора STAT1 в ядро клетки. В норме этот процесс проводится с помощью транспортного белка кариоферина альфа (KPNA), который связывается с фосфорилированной (то есть активной) формой STAT1 и переносит его сквозь ядерную пору. В ядре транскрипционный фактор STAT1 запускает синтез сотен стрессовых факторов, известных как интерферон-индуцированные гены. Именно они и обеспечивают антивирусный иммунный ответ клеток. Вирус Эбола блокирует этот процесс за счет того, что ее белок eVP24 связывается с той частью транспортного белка кариоферина KPNA, которая является сигнальной последовательностью ядерной локализации. Эта сигнальная последовательность является своего роде «паролем» для прохода в ядро. Не имеющие ее белки попасть в ядро не могут, и, следовательно, не могут повлиять на работу генов, которые там находятся. Так вирус получает возможность свободно размножаться в клетках организма. Последующая цитокиновая реакция со стороны иммунных клеток организма на многократно увеличившиеся количества вируса может быть настолько мощной, что жизненно важные органы оказываются необратимо повреждены. Острое начало заболевания с лихорадки совпадает с развитием интенсивной вирусемии с полиорганной диссеминацией возбудителя. Поражение клеток и тканей различных органов предположительно обусловлено как прямым цитопатическим действием вируса, так и аутоиммунными реакциями. Вирус гематогенным путём достигает паренхиматозных органов - печени, селезёнки, почек, а также вероятно лёгких, яичников, надпочечников и костного мозга, где он размножается, после чего переходит в кровь (вторичная вирусемия\ Клинические проявления. Инкубационный период — 316 дней (или 1-21, в среднем 7 сут). Лихорадка Эбола начинается остро, с высокой температуры, сильных головных болей, артралгий, миалгий. Разгар характеризуется появлением геморрагической сыпи, поноса с кровью, кровотечениями. Летальность достигает 90%. Период реконвалесценции затягивается до 2-3 мес., сопровождается выраженной астенизацией, анорексией, кахексией, выпадением волос, иногда развитием психических расстройств. Внешние признаки болезни – глубоко запавшие глаза, спотыкающаяся походка, выраженная кахексия остаются долго после исчезновения лихорадки. Лабораторная диагностика. Вирусологические, иммунологические и молекулярно-генетическе методы в специальных лабораториях с IV уровнем биологической безопасности. Материал: различные органы, ткани и выделения: в крови (7-10 дней), слюне, носоглоточной слизи, моче, сперме. Средства специфической профилактики и терапии заболеваний, вызванных филовирусами, не разработаны. Лечение симптоматическое — борьба с геморрагическим синдромом, переливание плазмы реконвалесцентов с интерфероном. Протективным эффектом обладает вирусспецифический гаммаглобулин. Во всех случаях подозрения на заражение вирусом Эбола для экстренной профилактики вводят специфический иммуноглобулин из сыворотки гипериммунизированных лошадей или плазму реконвалесцентов. Профилактика Регулярная чистка и дезинфекция свиноводческих и обезьяньих ферм Все продукты животного происхождения (кровь, мясо и молоко) перед употреблением в пищу необходимо подвергать тщательной тепловой обработке. Больные жив., их забой - надевать перчатки и другую надлежащую защитную одежду. При подозрении на вспышку болезни территория должна быть немедленно закрыта на карантин. Общие принципы противоэпидемических мероприятий, проводимых в отношении особо опасных инфекций Противоэпидемические мероприятия при выявлении больного с карантинной инфекцией 1. Активное выявление новых случаев заболевания 2. Немедленная изоляция больного и его лечение (госпиталь ООИ) 3. Ежедневные подворные обходы всех жителей населенного пункта, неблагополучного по ООИ (при чуме с измерением температуры тела, дважды в день) 4. Выявление и госпитализация лиц, подозрительных на ООИ, в провизорный госпиталь 5. Выявление и изоляция на максимальный инкубационный период (6 суток при чуме, 5 – при холере, 17 – при геморрагических лихорадках) в изолятор всех контактных (при отсутствии клинической симптоматики) 6. Установление территориального карантина 7. Выписка переболевших после клинического выздоровления и при негативных результатах 3 бактериологических исследований после окончания лечения 8. Лабораторное обследование населения на соответствующую ООИ 9. Дезинфекционные мероприятия (в том числе при чуме – дератизация) Международные медико-санитарные правила биологической безопасности (MMCП). - документ, содержащий требования, направленные на обеспечение максимальной защиты государств от завоза и распространения тех инфекционных болезней, на которые распространяются Правила, при минимальном вмешательстве в международные сообщения и перевозки. Международные медико-санитарные правила приняты XXII сессией Всемирной ассамблеи здравоохранения 25 июля 1969 г. Цель = обеспечение максимальной защиты от распространения карантинных болезней без нарушения международных перевозок и сообщения.   | ||||||||||||||||||||
