Иммун т8. Занятие 8. Часть 1 Надо сделать Пройти лекцию до конца к настоящему времени Вы заработали баллов 0 из 0 возможных
 Скачать 1.38 Mb. Скачать 1.38 Mb.
|
|
Иммун т8 Интерактивное занятие №8. Часть 1 Надо сделать: Пройти лекцию до конца К настоящему времени Вы заработали баллов: 0 из 0 возможных. Вторичные (приобретенные) иммунодефициты Вторичные иммунодефициты (ВИД) - это нарушения иммунной системы, которые развиваются в позднем постнатальном периоде или у взрослых и которые, как принято считать, не являются результатом какого-то генетического дефекта, клинически проявляются часто рецидивирующими бактериальными, грибковыми, вирусными инфекциями, плохо поддающимися традиционным методам лечения. В числе основных факторов возникновения ВИД следует назвать: инфекционные (типичная ВИЧ-инфекция, туберкулез и др.); алиментарные (белково-энергетическая недостаточность питания, дефицит витаминов, микроэлементов: цинка, селена и др.); лекарственные (иммунодепрессанты, цитостатики, антибиотики); химические (иммунотропные токсичные вещества, яды, производственные факторы); физические (радиационное воздействие и др); метаболические (например, на фоне тяжелых системных заболеваний, при злокачественных новообразованиях); стресс, травмы и др. Выделяют три формы вторичных иммунодефицитов: 1. индуцированная; 2. спонтанная; 3. приобретенная (СПИД) Приобретенная форма. Наиболее ярким примером приобретённой формы ВИД является СПИД, развивающийся в результате инфицирования ВИЧ, поражающего в первую очередь клетки иммунной системы. Индуцированная форма ВИД возникает в результате воздействия конкретных причинных факторов, а именно: рентгеновского излучения, цитостатической терапии, применения глюкокортикоидов, травмы, хирургических вмешательств и др. К этой же группе ВИД относят нарушения иммунитета, развивающиеся вторично по отношению к основному заболеванию (при сахарном диабете, заболеваниях печени, почек, злокачественных новообразованиях). Спонтанная форма ВИД характеризуется отсутствием явной причины, вызвавшей нарушение в иммунной системе. Клинически проявляется в виде хронических, часто рецидивирующих инфекционно-воспалительных процессов органов дыхания, придаточных пазух носа, урогенитального тракта, глаз, кожи, мягких тканей, вызванных оппортунистическими и условно-патогенными микроорганизмами. Наиболее трудными для диагностики и часто остающимися нераспознанными считаются проявления спонтанной формы ВИД, особенно в случае затяжных, часто рецидивирующих, тяжелых форм без явных изменений показателей иммунного статуса. В группу риска по возникновению ВИД с ведущим инфекционным синдромом следует включать обследуемых больных с хроническими, рецидивирующими или непрерывно текущими, плохо поддающимися традиционной терапии очагами инфекции различной этиологии и локализации. Обратимые и необратимые нарушения ВИДВИД могут развиваться как с обратимыми, так и с необратимыми нарушениями иммунной системы. ВИД с необратимыми нарушениями иммунной системы развивается при ВИЧ-инфекции, воздействии запредельных доз ионизирующей радиации, токсическом воздействии на систему кроветворения (лекарственные агранулоцитозы, препараты с лимфотоксическим эффектом и т. п.), при лимфопролиферативных и других злокачественных заболеваниях, необратимых поражениях иммунной системы, обусловленных тяжелыми бактериальными, вирусными, грибковыми и другими заболеваниями (туберкулез, системные микозы и т. п.) и др. ВИД с обратимыми нарушениями иммунной системы может формироваться у лиц при несбалансированном питании (голодание, дефицит отдельных пищевых ингредиентов), воздействии острого и хронического стресса, эндокринной патологии (сахарный диабет, заболевания щитовидной железы и др.), длительной терапии антибиотиками, цитостатиками, глюкокортикостероидами, иммунодепрессантами и другими препаратами, после трансплантации органов и тканей, воздействии неблагоприятных факторов внешней среды, в т. ч. Антропогенного характера (радиационное воздействие, химические факторы, воздействие ксенобиотиков и др.). ВИД представляет чисто клиническое понятие, важнейшим признаком которого является повышенная инфекционная заболеваемость различной этиологии и локализации и отсутствие достаточного клинического эффекта после назначения стандартной терапии по поводу имеющегося у пациента заболевания. В связи с этим клиническими признаками, позволяющими предполагать наличие ВИН, являются: генерализованные инфекции (сепсис, гнойные менингиты) и т.п. хронические бронхиты с частыми рецидивами, сочетающиеся с заболеваниями ЛОР- органов (гнойными синуситами, отитами); часто повторяющиеся пневмонии, плевропневмонии; бронхоэктатическая болезнь; хронические бактериальные поражения кожи и подкожной клетчатки (пиодермия, фурункулёз, абсцессы, флегмоны, септические гранулёмы, рецидивирующий парапроктит у взрослых); хронические грибковые поражения кожи и слизистых оболочек, генерализованный кандидоз; паразитарные заболевания; рецидивирующий афтозный стоматит в сочетании с повышенной заболеваемостью острыми респираторными вирусными инфекциями; рецидивирующая герпесвирусная инфекция различной локализации; гастроэнтеропатия с хронической диареей неясной этиологии; лимфаденопатия, повторные лимфадениты; длительный субфебрилитет, лихорадка неясной этиологии. У больной М., 62 лет, заподозрено развитие ВИДС вследствие длительного системного приема лекарственных препаратов. Препараты какой группы могут снижать иммунную резистентность?  Витамины Витамины Снотворные препараты Снотворные препараты Иммуностимуляторы Иммуностимуляторы Глюкокортикоиды+ Глюкокортикоиды+Вирус иммунодефицита человека (ВИЧ)Вирус иммунодефицита человека (ВИЧ, HIV - Human Immunodeficiency Virus) вызывает у человека ВИЧ-инфекцию, которая заканчивается развитием синдрома приобретенного иммунодефицита (СПИД, AIDS - Acquired Immunodeficiency Syndrome). ВИЧ-инфекция относится к группе антропонозных вирусных болезней. В 1981 г. впервые было описано прогрессирующее поражение иммунной системы на фоне саркомы Капоши или пневмоцистной пневмонии у мужчин- гомосексуалистов. Со временем было отмечено широкое распространение этого заболевания. В 1982 году оно получило название Acguired Immunodeficiency Syndrome (AIDS) - синдромом приобретенного иммунодефицита (СПИД). В 1983 г. из организма больных людей был выделен ранее неизвестный вирус. Возбудитель был выделен одновременно французским вирусологом Л. Монтанье из Института Пастера в Париже и американским ученым Р. Галло из Национального Института рака в США В 1986 году решением Международного Комитета экспертов по таксономии вирусов этот агент получил название Human Immunodeficiency Virus (HIV) – вирус иммунодефицита человека (ВИЧ). В бывшем Советском Союзе первый случай ВИЧ-инфекции был зарегистрирован в 1985 г. у иностранного гражданина. В последующие годы это заболевание охватило все страны практически на всех континентах. Причинами быстрого и широкого распространения ВИЧ- инфекции являются высокая восприимчивость людей к вирусу иммунодефицита, разнообразие путей передачи инфекции, отсутствие эффективных средств специфической профилактики и лечения заболевания. В 1988 г. ООН объявила 1 декабря Всемирным днем борьбы со СПИДом Таксономическое положение Вирус иммунодефицита человека относится к порядку Ortervirales семейству Retroviridae подсемейству Orthoretrovirinae роду Lentivirus. Название Retroviridae связано с наличием в структуре вириона фермента обратной транскриптазы (англ. retro - обратно), которая обеспечивает образование двуцепочечной ДНК на основе информации, закодированной в одноцепочечной РНК. Название же рода Lentivirus (лат. lente – медленный) обусловлено длительным инкубационным периодом и медленным развитием инфекционного процесса. Род Lentivirus объединяет 10 видов, в том числе вирусы иммунодефицита человека 1 и 2 (Human immunodeficiency virus 1, HIV-1 и Human immunodeficiency virus 2, HIV-2). К роду Lentivirus относятся также возбудители вирусных заболеваний животных: Bovine immunodeficiency virus (вирус иммунодефицита крупного рогатого скота), Caprine arthritis encephalitis virus (вирус артритаэнцефалита коз и овец), Equine infectious anemia virus (вирус инфекционной анемии лошадей), Feline immunodeficiency virus (вирус иммунодефицита кошек), Jembrana disease virus (вирус болезни Джембрана крупного рогатого скота), Puma lentivirus (лентивирус пум), Simian immunodeficiency virus (вирус иммунодефицита обезьян), Visna-maedi virus (вирус болезни Висна-меди овец). ВИЧ-1 подразделяются на несколько групп: М, N, O и Р. Причиной более 90% случае в заболевания у человека являются представители группы М. Внутри группы М (англ. main – основная) выделяют 11 подтипов (A, B, C, D, E, F, G, H, I, J, K). Вирус подтипа А, например, широко распространен в России и Западной Африке. Предполагают, что ВИЧ-1 возник в результате передачи человеку вируса иммунодефицита шимпанзе, а ВИЧ-2 – вируса красноголовых мангобеев ВИЧ относится к семейству:  Rhabdoviridae Rhabdoviridae Picornaviridae Picornaviridae Togaviridae Togaviridae Retroviridae+ Retroviridae+Структура ВИЧВирус иммунодефицита человека является РНК-содержащим вирусом. Характерной 2особенностью ВИЧ является наличие фермента обратной транскриптазы или ревертазы (РНК зависимой ДНК-полимеразы), обеспечивающей синтез двуцепочечной ДНК на матрице одноцепочечной РНК с последующей интеграцией ДНК в геном хозяйской клетки. Вирусная частица имеет сферическую форму диаметром 100-120 нм (рисунок 1). 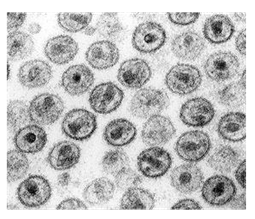 Рис. 1 – Изображение ВИЧ Снаружи ВИЧ имеет суперкапсидную двухслойную липидную оболочку, пронизанную гликопротеиновыми комплексами (шипами). Всего в суперкапсиде вириона 72 шипа, напоминающих по форме гриб. Каждый грибоподобный гликопротеиновый комплекс состоит из трех молекул гликопротеина gр 120 (молекулярная масса 120 кДа) и трех молекул трансмембранного гликопротеина gр 41 (молекулярная масса 41 кДа). Гликопротеин gр 120 (белок “шляпки”) расположен на поверхности вириона и связан с гликопротеином gр 41 (белком “ножки”), который пронизывает липидную оболочку. Гликопротеин gр 120 служит для прикрепления вириона к рецептору CD4 и корецепторам или помощникам на поверхности инфицируемой клетки (например, CCR5 и CXCR-4). Вирусы, имеющие сродство к рецепторам макрофагов, называются М-тропными. Вирусы, имеющие сродство к рецепторам Т-клеток, называются Т-тропными. Гликопротеин gр 41 способствует слиянию суперкапсида с клеточной мембраной. В липидной мембране ВИЧ также находятся мембранные белки клеток-хозяев (в частности, ICAM-1, HLA- DR1, CD55 и др.), захваченные при формировании суперкапсидной оболочки вируса при выходе вирионов из инфицированной клетки. Под суперкапсидной оболочкой располагается слой матриксного белка р17 толщиной 5-7 нм. Матриксный белок окружает нуклеокапсид. Капсид имеет форму усеченного конуса и состоит из белка р24 молекулярной массы 24 кДа. Внутри капсида находится белково-нуклеиновый комплекс, состоящий из вирусного генома, ферментов (обратной транскриптазы, протеазы и интегразы) и белка р7. Геном ВИЧ представлен двумя молекулами однонитевой плюс-РНК. Ферменты участвуют в процессах репродукции ВИЧ внутри инфицированной клетки. В частности, обратная транскриптаза (РНК- зависимая ДНК-полимераза) участвует в синтезе ДНК на матрице РНК; интеграза катализирует встраивание образованной вирусной ДНК в хромосому клетки- хозяина; протеаза расщепляет синтезируемые полипротеины на структурные белки. Справа и слева РНК-геном имеет длинные концевые повторы (LTR - long terminal repeat), которые управляют продукцией дочерних вирионов и активируются как белками вируса, так и белками инфицированной клетки. Нуклеокапсидный белок р7 служит для связи капсида с геномом. В капсиде находится также молекула затравочной РНК (тРНК lys). Матриксный белок р17 окружает внутреннюю структуру вириона – нуклеокапсид или сердцевину (англ. – core), которая объединяет капсидный белок р24, две молекулы геномной РНК и ферменты (обратная транскриптаза, интеграза и протеаза). Внутри нуклеокапсида находится геном вируса в виде двух цепочек РНК, связанных белками р7 и р9, а также ферменты и затравочная тРНК. С капсидом ВИЧ-1 (белком р24) связано 200 копий циклофилина А (CypA), заимствованного вирусом у зараженной клетки. Циклофилин А является белком (пептидолпролилизомеразой), участвующим в прикреплении белка р17 и проведении сигналов в Т-лимфоцитах. Внутри капсида вириона находится также белок Vhr, участвующий в процессах размножения и сборки вирионов и препятствующий действию противовирусных систем. 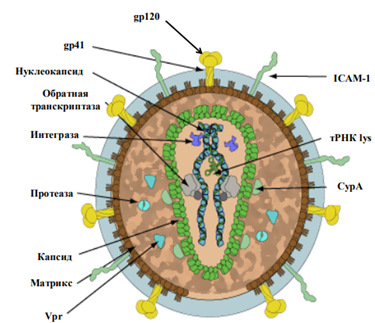 Рис. 2 – Строение вируса иммунодефицита человека Антигенная структура ВИЧ.У ВИЧ главными антигенами являются группоспецифические и видоспецифические антигены (сердцевинный или ядерный антиген р24), а также типоспецифические антигены (оболочечные антигены gр41 и gр120). Для ВИЧ характерна высокая антигенная изменчивость. В результате сбоев обратной транскриптазы из организма больного можно выделить серологически различные клоны вируса. Жизненный цикл ВИЧ. Жизненный цикл вируса иммунодефицита человека состоит из следующих стадий: - адсорбция и проникновение вируса в клетку путем эндоцитоза; - высвобождение вирусной РНК; - синтез ДНК-провируса и его интеграция в геном клетки хозяина; - синтез РНК дочерних вирионов; - синтез белков дочерних вирионов; - сборка и высвобождение вновь образованных дочерних вирионов из клетки путем почкования. Полный жизненный цикл вируса протекает в течение 1-2 суток. Проникший в организм вирус вначале связывается гликопротеином gp120 с помощью специального кармана с рецептором СD4 Т-лимфоцитов и клеток макрофагального происхождения (макрофаги, дендритные и микроглиальные клетки). Затем происходит дополнительное связывание вируса с еще одним вспомогательным трансмембранным белком (корецептором), в качестве которого выступает рецептор CCR5 на макрофагах (М-тропные вирусы) или CXCR4 на Т- клетках (Т-тропные вирусы). На рис. 3 представлены рецепторы и корецепторы М-тропного и Т-тропного ВИЧ. 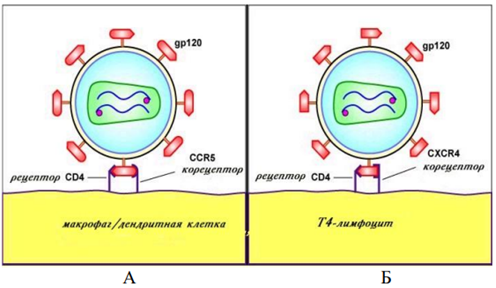 Рис. 3 – А – М- тропный ВИЧ; Б – Т-тропный ВИЧ. После этого сердцевина вируса входит в клетку путем слияния суперкапсидной оболочки вируса с плазматической мембраной клетки (рисунок 4). 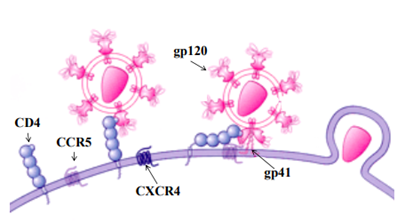 Рис. 4 – Процесс проникновения сердцевины ВИЧ в клетку. Ферментами ВИЧ являются: Ваш ответ :
Жизненный цикл ВИЧ. ПродолжениеПроникшая в цитоплазму клетки сердцевина вириона на пути к ядру подвергается депротеинизации, в результате чего высвобождается геномная РНК и связанные с ней компоненты сердцевины. После этого с помощью вирусной обратной транскриптазы на матрице одноцепочечной вирусной РНК происходит синтез комплементарной двухцепочечной ДНК. Этот процесс происходит в цитоплазме лимфоцита и требует наличия следующих компонентов: вирусной РНК, транспортной РНК – праймера, обратной транскриптазы и нуклеозидов цитоплазмы клетки. Нуклеозиды в избытке содержатся в лимфоцитах. В результате обратной транскрипции образуется провирус (вирусная ДНК), который транспортируется в ядро клетки и встраивается в ядерную ДНК с помощью вирусного фермента интегразы. В дальнейшем провирус является матрицей для синтеза геномной РНК дочерних вирионов и иРНК, обеспечивающей синтез белков дочерних вирионов. Синтезированные в ядре иРНК транспортируются в цитоплазму клетки, где на рибосомах синтезируются вирусные структурные и регуляторные белки. После этого молекулы геномной РНК и вирусные белки транспортируются к местам сборки дочерних вирионов. Вначале формируется сердцевина вирионов, которая транспортируется к предварительно модифицированной клеточной плазматической мембране, в которую встроены гликопротеиновые шипы. Вирионы выходят из клетки путем почкования, при этом сердцевина вируса “одевается” в измененную плазматическую мембрану клетки (рис.5). 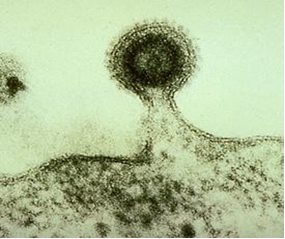 Рис. 5 – Выход вириона путем почкования. После выхода дочерних вирионов клетка погибает. Полный жизненный цикл вируса иммунодефи цита человека представлен на рис. 6 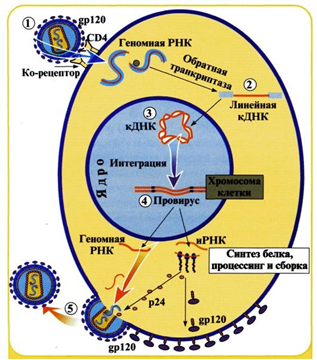 Рис. 6 – Схема жизненного цикла ВИЧ: 1 – связывание гликопротеина gp120 с рецептором СD4 и корецептором; 2 – синтез комплементарной ДНК с помощью обратной транскриптазы; 3 – проникновение ДНК в ядро; 4 – встраивание ДНК в ядерную ДНК (образование провируса); 5 – выход вирионов из клетки путем почкования ДНК-провирус может длительно находиться в ядре клетки в неактивном состоянии (персистентное инфицирование). В этот период вирус можно выявить только с помощью ПЦР. Активация провируса приводит к развитию продуктивной фазы, при которой происходит активное размножение ВИЧ. Для ВИЧ характерно: Ваш ответ :
Резистентность ВИЧВИЧ чувствителен к физическим и химическим факторам, гибнет в течение 30 минут при нагревании до 56°С, в течение 10 минут – при нагревании до 70-80ОС, через 5-10 минут гибнет под действием таких дезинфектантов как спирт и эфир. В течение 1-10 минут ВИЧ инактивируется при действии 0,2% формальдегида, 0,3% перекиси водорода, 0,5% лизола. Вирус чувствителен к солнечной радиации, УФ- излучению, ионизирующей радиации. Однако вирус длительно (до 2 недель) сохраняется в высушенном состоянии, в высохшей крови, а в крови доноров может сохраняться годами. В биологических материалах при комнатной температуре вирус сохраняет жизнеспособность в течение нескольких суток. ВИЧ вне организма быстро погибает, поэтому бытовым путём заражения не происходит. Эпидемиология ВИЧ-инфекция относится к антропонозным инфекциям, у животных это заболевание не воспроизводится. Источник инфекции - больной человек. Механизм передачи – парентеральный. Основные пути передачи вируса – половой (гомосексуальный и гетеросексуальный контакт), гемотрансфузионный, инъекционный (использование загрязненных шприцев, игл), инструментальный (применение загрязненных катетеров). Возможна передача ВИЧ трансплацентарным путем от матери плоду, трансплантационным путем при пересадке инфицированных органов, заражение ребенка инфицированным молоком матери. Половой путь передачи является основным, он возможен при анальном, вагинальном и оральном сексе, независимо от сексуальной ориентации. При инъекционном пути вирус передается при использовании одних и тех же игл и шприцев, особенно потребителями наркотиков. ВИЧ может содержаться практически во всех биологических жидкостях больного человека. Однако достаточное для заражения количество вируса содержится в крови, сперме, влагалищном секрете, предсемeнной жидкости, лимфе и грудном молоке. Грудное молоко представляет опасность особенно для младенцев, у которых ещё не выработался желудочный сок, губительно действующий на ВИЧ. В связи с этим ВИЧ-положительным матерям не рекомендуется кормить детей грудью. Основными группами риска являются гомосексуалисты, наркоманы, проститутки, реципиенты крови, медицинские работники. Группу повышенного риска составляют лица, практикующие незащищенный анальный секс; наркоманы, употребляющие инъекционные наркотики, а также их половые партнёры. ВИЧ не передается через укусы насекомых, через воду и пищу, через воздух при кашле и чихании, с потом и слезной жидкостью, при рукопожатии, при поцелуях, через посуду, одежду, при пользовании ванной, туалетом, плавательным бассейном. В настоящее время в мире зарегистрировано более 40 млн. ВИЧ- инфицированных. Большинство ВИЧ-инфицированных зарегистрировано в странах Африки. В 2006-2007 гг. больше всего носителей ВИЧ было зарегистрировано в Индии (6,5 млн.), ЮАР (5,5 млн.), Эфиопии ((4,1 млн.), Нигерии (3,6 млн.), Мозамбике (1,8 млн.), Кении (1,7 млн.), Зимбабве (1,7 млн.), США (1,3 млн.), России (1 млн.), Китае (1 млн.). Эпидемия ВИЧ-инфекции началась в конце 1970-х – начале 1980-х гг. За это время ВИЧ заразилось почти 60 млн. человек, 25 млн. человек умерло от заболеваний, связанных с ВИЧ-инфекцией. В России первый случай ВИЧ-инфекции был зарегистрирован в 1985 г., а в 2000 г. количество инфицированных уже превысило 10000 человек. В декабре 2016 г. в России с диагнозом ВИЧ-инфекции проживало 870952 человека. На 1 июля 2017 г. число ВИЧ-инфицированных в России составило 1167581 человек, на 1.11.2017 г. почти 1924600 человек. Интерактивное занятие №8. Часть 2Надо сделать: Пройти лекцию до конца К настоящему времени Вы заработали баллов: 0 из 0 возможных. ПатогенезВирус иммунодефицита человека с помощью гликопротеина gр120 присоединяется к СD4-рецептору и одному из корецепторов (CXCR4 или CCR5) на поверхности клеток (Т-лимфоциты, тканевые макрофаги, моноциты, дендритные клетки, клетки нейроглии, клетки Лангерганса, эпителиальные клетки кишечника и шейки матки). Затем вирус проникает внутрь клеток и размножается в них. В результате этого клетки разрушаются или теряют свои функциональные свойства, происходит накопление вируса в органах и тканях. При ВИЧ-инфекции снижается число СD4-лимфоцитов, нарушается функция В-лимфоцитов, подавляется функция естественных киллеров, нарушается синтез комплемента, лимфокинов и других факторов, регулирующих иммунные реакции организма. В результате этого снижаются функции иммунной системы, развивается иммунодефицит и присоединяются вторичные заболевания инфекционной и неинфекционной природы, в том числе злокачественные опухоли. Прогрессирующее уменьшение количества СD4-клеток обусловлено различными механизмами (апоптоз, образование синцития, аутоиммунные реакции, инфицирование клеток-предшественников). Апоптоз. Инфицированные Т-клетки экспрессируют на своей мембране вирусный гликопротеин gр120. Экспрессированный гликопротеин взаимодействует с молекулами СD4 на других инфицированных или неинфицированных Т-клетках. В результате этого стимулируется “запрограммированная” гибель клеток. Образование синцития. Экспрессия гликопротеина gр120 на мембранах инфицированных Т-клеток вызывает слияние мембран нескольких клеток, несущих на своей поверхности молекулы СD4. В результате этого образуется синцитий. Образование синцития характерно для поздней стадии развития ВИЧ-инфекции. Аутоиммунные реакции. Экспрессия гликопротеина gр120 на мембране инфицированных Т-клеток обусловливает активацию цитотоксических лимфоцитов (ЦТЛ) и реакцию антителозависимой цитотоксичности. В результате этого инфицированные СD4-клетки погибают. Инфицирование клеток-предшественников. ВИЧ инфицирует не только зрелые Т-клетки, но и клетки-предшественники Т-лимфоцитов в вилочковой железе и костном мозге. В результате этого нарушаются процессы пролиферации и дифференцировки СD4-клеток. После того как число CD4+ Т-лимфоцитов становится ниже 200 в 1 мкл крови, система клеточного иммунитета перестает защищать организм. Опасная концентрация вируса ВИЧ содержится:  в слюне, поте в слюне, поте в моче в моче во всех биологических жидкостях во всех биологических жидкостях в крови, семенной жидкости, грудном молоке+ в крови, семенной жидкости, грудном молоке+Вопросы взаимодействия ВИЧ и клеток хозяинаКлючевым вопросом патогенеза ВИЧ-инфекции является активация провируса. При этом активирующими факторами могут выступать различные антигены, цитокины, клеточные транскрипционные факторы, собственные и гетерологические трансактиваторы и др. Процессы активации транскрипции и синтез белков-предшественников иногда принимают взрывообразный характер. Завершающим этапом морфогенеза ВИЧ является сборка вирусных частиц и выход их из клетки. Инфицированная клетка, в которой прошел цикл активной репликации вируса, подвергается прямой деструкции и цитолизу. Этот процесс, называемый еще цитонекрозом, есть один из основных феноменов цитопатогенного действия ВИЧ. Другими его компонентами являются образование синцитиев (в синцитий вовлекаются, с одной стороны, клетки, инфицированные ВИЧ и экспрессирующие на наружной мембране вирусные белки gp120 и gp 41, и, с другой, — клетки, необязательно инфицированные ВИЧ, но имеющие на наружной мембране молекулы CD4, патогенные эффекты отдельных белков вируса (gpl20, секретируемый во внеклеточную среду в виде растворимых отдельных молекул), хроническая инфекция клеток без скоропостижного цитолиза (моноциты/макрофаги, клетки ЦНС и эпителиоциты кишечника). Причиной уменьшения СD4-клеток могут быть цитокины, секретируемые инфицированными ВИЧ макрофагами: фактор некроза опухолей и интерлейкин-1. Их повышенная секреция запускает механизм запрограммированной гибели клетки — апоптоз. Активированные CD8- лимфоциты способны затормозить этот процесс посредством секреции других цитокинов. Полагают, что данный механизм определяет длительность бессимптомной фазы. Установлено также, что прогрессия ВИЧ-инфекции и цитолиз лимфоцитов обусловлены дисгармонией взаимодействия цитокинов, вырабатываемых субпопуляциями Тh, за счет повышения продукции цитокинов Тh 2-го типа (IL-4, IL -10) и уменьшения - Тh 1-го типа (IL-2, γ-IFN). В процессе нарастания физического разрушения Т-хелперов (главная клетка-мишень для ВИЧ), соответственно возрастает количество СD8-лимфоцитов, причем уже в ранние периоды от начала инфекционного процесса, нарушается функциональное состояние Т- лимфоцитов, проявляющееся существенным снижением их способности реагировать на различные митогены и антигены еще задолго до очевидного паления Т-хелперов, достоверно уменьшается активность нормальных киллеров, отмечается не только нарушение морфологии макрофагально- моноцитарных клеток, а также выраженные изменения их функций. К настоящему времени установлено, что в основе иммуносупрессии существенную роль играет не только прямое цитопатическое действие вируса, но и ряд опосредованных процессов. В начальные сроки течения инфекции идет выработка противовирусных антител. Часть вирусного пула такие антитела инактивируют, но остановить прогрессию инфекционного процесса не способны. Поликлональная активация В- лимфоцитов приводит к повышению общего содержания иммуноглобулинов, циркулирующих иммунных комплексов. Однако при общем повышении уровня иммуноглобулинов продукция их различных классов разбалансирована. Циркулирующие иммунные комплексы, состоящие из вирусных антигенов и антител к ним, также способствуют распространению инфекции. В их составе вирусы могут беспрепятственно транспортироваться в кровь и ткани, сохраняя способность инфицировать чувствительные клетки. По совокупности последствий иммунопатогенез при ВИЧ-инфекции преобладает над возможностями естественной защиты организма от этого вируса, неотвратимо наступает декомпенсация и в результате обеспеченного ВИЧ-иммунодефицита развиваются вторичные патологические процессы в виде оппортунистических (преимущественно условно-патогенных) инфекций и злокачественных опухолей. Взаимодействие ВИЧ и клеток ЦНСВИЧ проникает в ЦНС с макрофагами. Клетки макрофагальных линий составляют большинство из ВИЧ-1-инфицированных клеток мозга, которые формируют многоядерные гигантские клетки, гистопатологический признак продуктивной ВИЧ-1 инфекции в мозге. Инфицированные макрофаги (MF)/микроглия высвобождают различные нейротоксические субстанции. MMPs (matrix metalloproteinases) - матриксметаллопротеазы. (Рис 1) 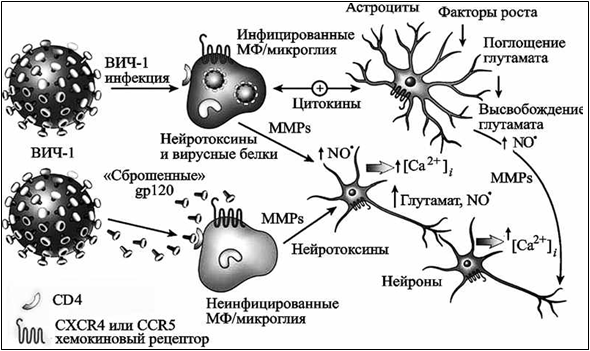 Рис. 1 Современная модель повреждения и смерти нейронов под воздействием ВИЧ-1- инфекции Существуют следующие компоненты патогенеза повреждения мозга при данном заболевании: нейротоксичность растворимого вирусного белка gp120; прямое цитопатогенное действие вируса на инфицированные им клетки нервной системы; повреждающее действие противовирусных антител и сенсибилизированных лимфоцитов против собственных мозговых антигенов; поражение мозга оппортунистическими инфекциями и опухолями. Необходимо отметить, что существенной причиной нарушения функций нервной системы, особенно на ранних стадиях болезни, является реакция личности на заражение и заболевание, поскольку сам факт наличия ВИЧ-инфекции у больного следует рассматривать как выраженный патологический стресс. Слизистые оболочки и кожа, содержащие клетки Лангерганса, эпителиальные клетки желудочно-кишечного тракта также вовлекаются в патологический инфекционный процесс. Можно предполагать, что прямое повреждающее действие ВИЧ существует в отношении тех типов клеток (и, соответственно, тканей и органов), про которые известно, что вирус способен их инфицировать, интегрироваться в геном и выходить в репликацию при подходящих условиях. Активация провируса ВИЧПри внедрении провируса в геном CD4Тh переходит в латентную (покоящуюся) фазу. Активизация провируса стимулирует размножение вирусных частиц, выход которых из клетки носит взрывообразный характер. Мгновенно из клеток выбрасывается огромное количество вирусных частиц. Одна клетка способна за 5 минут синтезировать до 5 тысяч вирусных частиц. В данном же периоде в состоянии провируса находятся тысячи вирус-пораженных клеток. Синтезированные вирусные частицы внедряются в иммунокомпетентные клетки и наносят летальный удар по иммунной системе, вызывая развитие СПИДа. Фактором, вызывающим активацию провируса является белок NFkB. При попадании бактериального агента в организм происходит распознавание его как «чужого» антиген - представляющей клеткой, котораязахватывает антиген, переваривает его, переводя в суперантигенную форму. Суперантиген экспрессируется на поверхность клеточной мембраны. Переварив антиген, макрофаг подает неспецифический сигнал IL-1, который воспринимается CD4 рецептором Тh. Тh, получив сигнал IL-1, активирует свой метаболизм и готовится к размножению (пролиферации). В результате активации в цитоплазме Тh появляются новые белки, структура которых сегодня изучена крайне недостаточно. Один из этих белков назван NFkB. Белок, действуя непосредственно на 5'LTRучасток генома, обусловливает активизацию tat-гена, которыйпровоцирует резкое повышение репликации вирусов. Когда Тh получит от макрофага сигнал в виде суперантигена, он переходит в фазу пролиферации и размножения и передает своим дочерним клеткам вместе со своим генетическим аппаратом активированный провирус. Поражённые вирусом клетки начинают реплицировать вирионы в большом количестве. Синтез и сборка вирусных частиц В результате активации провируса происходит активация неструктурных и структурных генов. Рибосомы клетки начинают нарабатывать вирусные белки. Образовавшиеся структуры по эндоплазматическому ретикулюму направляются к месту сборки вирусных частиц, на внутренней поверхности плазматической мембраны. Сначала собирается сердцевина вируса, которая давит на клеточную мембрану изнутри, образуется «почка». Через липидную мембрану прорезываются поверхностные вирусные белки. Vpu-ген даёт команду и вирус отпочковывается от клетки, забрав с собой часть клеточной мембраны.В результате отпочковывания от клетки вирус может с собой захватить HLA-белки лимфоцита-хозяина. Белки оболочки лимфоцита в составе суперкапсида ВИЧ могут стать причиной ложноположительных реакций при проведении иммуноферментного анализа. Минимальное количество крови, достаточное для лабораторного исследования на наличие антител к ВИЧ:  3-5 мл 3-5 мл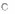 7-10 мл 7-10 мл 1-2 мл 1-2 мл 100 мкл 100 мклКлассификация и клинические проявления ВИЧ инфекцииВ Российской Федерации используется классификация ВИЧ- инфекции, предложенная В. И. Покровским, которая была принята в 1989 году [1-3,12]. В 2001 году Покровским была составлена новая версия классификации. Согласно новой классификации, ВИЧ-инфекция в организме проходит 5 стадий: Стадия инкубации (стадия 1): С момента заражения до клинических проявлений острой инфекции и/или выработки антител (в среднем от 3 недель до 3 месяцев). Стадия первичных проявлений (стадия 2): 2«А» - бессимптомная, когда клинические проявления ВИЧ- инфекции или оппортунистических заболеваний отсутствуют, а ответом на внедрение ВИЧ является выработка антител. 2«Б» - острая ВИЧ-инфекция без вторичных заболеваний (разнообразные клинические проявления, в большинстве своем похожие на симптомы других инфекций). 2«В» - острая ВИЧ-инфекция с вторичными заболеваниями (на фоне временного снижения Т-4 лимфоцитов развиваются вторичные заболевания – ангина, бактериальная пневмония, кандидоз, герпес – как правило, хорошо поддающиеся лечению). Продолжительность клинических проявлений острой ВИЧ- инфекции обычно составляет 2 - 3 недели. Стадия латентная (стадия 3): Медленное прогрессирование иммунодефицита. Единственным клиническим проявлением является увеличение лимфоузлов, которое может и отсутствовать. Длительность латентной стадии от 2 - 3-х до 20 и более лет, в среднем 6 - 7 лет. Отмечается постепенное снижение уровня Т-4 лимфоцитов. Стадия вторичных заболеваний (стадия 4): Продолжается репликация ВИЧ, приводящая к гибели Т-4 лимфоцитов и к развитию на фоне иммунодефицита вторичных (оппортунистических) заболеваний, инфекционных и/или онкологических. Симптомы на этой стадии имеют обратимый характер, то есть могут проходить сами по себе или в результате лечения. В зависимости от тяжести вторичных заболеваний выделяют следующие стадии. 4«А» - для нее характерны бактериальные, грибковые и вирусные поражения слизистых и кожных покровов, воспалительные заболевания верхних дыхательных путей. 4«Б» - более тяжелые и длительные кожные поражения, саркома Капоши, потеря веса, поражения периферической нервной системы и внутренних органов. 4«В» - тяжелые, угрожающие жизни оппортунистические заболевания. В настоящее время к СПИД-индикаторным заболеваниям относятся: 1. Кандидоз трахеи, бронхов, легких. 2. Кандидоз пищевода. 3. Рак шейки матки (инвазавный) 4. Кокцидиомиокоз (диссеминированный или внелегочный). 5. Криптококкоз внелегочный. 6. Криптоспоридиоз кишечника хронический (длительностью более 1 месяца). 7. ЦМВИ (поражение других органов, кроме печени, селезенки, лимфоузлов). 8. Цитомегаловирусный ретинит (с потерей зрения). 9. Энцефалопатия, обусловленная действием ВИЧ. 10. Простой герпес: хронические язвы, сохраняющиеся более 1 месяца, или бронхит, или пневмония, эзофагит. 11. Гистоплазмоз диссеминированный или внелегочный. 12. Изоспороз кишечника хронический (длительностью более 1 месяца). 13. Саркома Капоши. 14. Иммунобластическая саркома. 15. Лимфома Беркитта. 16. Лимфома мозга первичная. 17. Микобактериозы, вызванные M.avium, m.kanzassi, дис- семинированные и внелегочные. 18. Туберкулез легких. 19. Туберкулез внелегочный. 20. Другие микобактериозы или недифференцированные микобактериозы, диссеминированные и внелегочные. 21. Пневмоцистная пневмония. 22. Пневмонии возвратные (2 и более раз в течение 12 месяцев). 23. Прогрессирующая многоочаговая лейкоэнцефалопатия. 24. Сальмонеллезные септицемии. 25. Токсоплазмоз мозга. 26. Slim-синдром (синдром истощения, обусловленный воздействием ВИЧ). Терминальная стадия (стадия 5): Поражение органов и систем носят необратимое течение. Даже адекватно проводимые противовирусная терапия и лечение оппортунистических заболеваний не эффективны, и больной погибает в течение нескольких месяцев. При всей полиморфности клинической картины ВИЧ-инфекции характерна определенная часто встречающаяся патология или нозология: Лимфоаденопатия - 100 % Поражение кожи - до 90 %: (бактериальные поражения: стафилококк, синегнойная инфекция, бациллярный ангиоматоз, микобактериоз; вирусные: herpessimplex, v. Zoster, паппилома человека, контагиозный моллюск; поражения грибами: кандидоз, дерматофития; паразиты кожи: чесотка, простейшие; неинфекционные поражения: ксероз, себорейный дерматит, саркома Капоши) Пневмоцистная пневмония - 50 % Поражение центральной нервной системы - 30 % 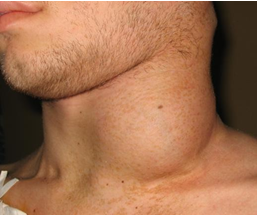 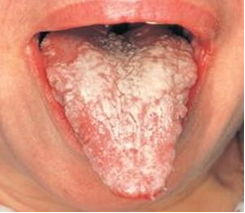 Рис.2 – Лимфаденопатия Рис. 3 – Кандидоз полости рта 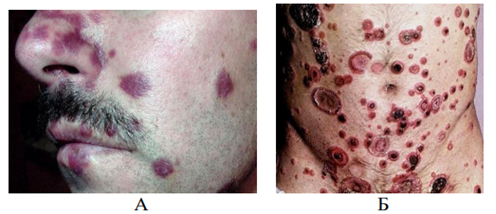 Рис.4 – А – саркома Капоши; Б - Т-клеточная лимфома. Ранний срок обнаружения антител к ВИЧ после инфицирования  4 недели 4 недели 3 недели+ 3 недели+ 6 месяцев 6 месяцев 3 месяца 3 месяцаСимптомы СПИДаВОЗ было предложено выделить 3 больших и 6 малых симптомов СПИДа: Большие симптомы: 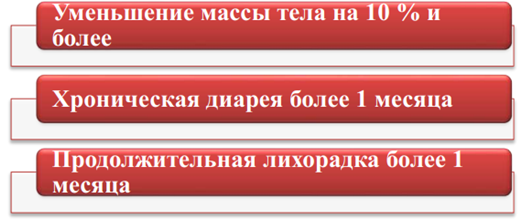 Малые симптомы: Диагноз СПИДа выставляется при обнаружении не менее двух больших и по крайней мере одного малого симптома. Кроме того, обнаружениегенерализованной саркомы Капоши или криптококкового менингита достаточно для постановки диагноза СПИДа.  |
