химия. Завдання і методи кільк. ан-зу(1). Завдання і методи ількісного аналізу
 Скачать 67.5 Kb. Скачать 67.5 Kb.
|
|
Завдання і методи ількісного аналізу Предметом кількісного аналізу є сукупність хімічних, фізичних та фізико-хімічних методів, що дозволяють з необхідною точністю визначити кількісне співвідношення складових частин досліджуваної речовини. Коло об’єктів кількісного аналізу досить широке і торкається сільського господарства, промисловості, науки, здоров’я людини, охорони навколишнього середовища тощо. Значення кількісного аналізу для практики сільського господарства зумовлено аналізом рослинного та тваринного матеріалу, мінеральних і органічних добрив, ґрунтів, отрутохімікатів, контролем якості продукції тваринництва та рослинництва. Кількісне визначення вологості ґрунтів, pH водної та сольової витяжки, суми ввібраних основ, ступеня солонцюватості, вмісту гумусу потрібне для оцінки фізико-хімічних властивостей ґрунтів. Виходячи з результатів аналізу, визначають потребу ґрунтів у вапнуванні та гіпсуванні. Ґрунти також аналізують на ступінь забезпечення рослин рухомими формами Нітрогену, Фосфору та Калію. Аналіз добрив дає можливість установити відсотковий вміст у добриві тієї чи іншої поживної речовини, причому найчастіше визначають не загальний вміст цієї речовини, а лише ту її частину, що перебуває в доступній для рослин формі. Результати такого аналізу потрібні для оцінки якості добрив і встановлення норм їх внесення. На основі рослинної діагностики визначають вміст окремих макро- та мікроелементів в рослинах. Не менше значення мають показники якості продукції рослинництва і тваринництва – вміст білкового азоту в рослинах, загальна кислотність плодів і овочів, кислотність меду, вміст цукридів і вітамінів у плодах та овочах, визначення кислотного, йодного числа жирів, кислотності й жирності молока тощо. У промисловості кількісний аналіз є основним методом контролю хімічних процесів, сировини, готової продукції виробництва. Жодна науково-дослідна робота в хімії не проходить без використання методів аналітичної хімії. Для створення нових речовин із заздалегідь заданими властивостями та встановлення їх складу необхідні кількісні дослідження. Уявлення про механізм більшості хімічних реакцій отримують на основі кінетичних даних, контроль за швидкістю витрачання початкових речовин або появою продуктів реакції здійснюють за допомогою кількісного визначення компонентів хімічного процесу. В медицині велике значення має кількісне визначення окремих елементів, що є складовими тканин живих організмів. Моніторинг об’єктів навколишнього середовища також здійснюється методами кількісного аналізу. Методи кількісного аналізу Класифікація методів кількісного аналізу ґрунтується на природі та способах вимірювання аналітичного сигналу. Аналітичний сигнал − цє прояв хімічних або фізичних властивостей речовини, що функціонально залежить від вмісту досліджуваного компонента в аналізованій речовині. За природою аналітичного сигналу методи аналізу поділяють на хімічні, фізико-хімічні та фізичні. В основі хімічних (класичних) методів аналізу лежить певне хімічне перетворення. В аналітичній хімії використовують кислотно-основні, окисно-відновні реакції, а також процеси осадження-розчинення та комплексоутворення. Наприклад, для визначення вмісту хлору в камۥяній солі (натрій хлориді) точну масу солі розчиняють у воді, додають розчин арґентум (I) нітрату, утворений осад арґентум хлориду відфільтровують, висушують і зважують. За масою осаду визначають вміст хлору в аналізованій пробі. Важливим моментом хімічного аналізу є вибір реагенту та умов реакції. До хімічних методів аналізу належать титриметрія, гравіметрія та газометрія. В основі титриметричного або об’ємного методу аналізу лежить вимірювання об’єму розчину реагенту з точно відомою концентрацією, що витрачається на взаємодію з досліджуваною речовиною. Результати аналізу визначають на основі закону еквівалентів. Головною операцією цього методу аналізу є титрування, тобто поступове додавання розчину реагенту до розчину досліджуваної речовини. Гравіметрія ґрунтується на точному визначенні маси досліджуваної речовини. Обов’язковою операцією в гравіметрії є зважування на аналітичних терезах. У газометрії вимірюють об’єм газу, що виділяється або поглинається внаслідок хімічної взаємодії. Аналітичний сигнал у цих методах (утворення осаду, змінення забарвлення індикатору, виділення газу) встановлюють візуально. Перевагою хімічних методів є точність і простота виконання. Водночас вони відрізняються невеликою межею чутливості, складністю виділення досліджуваного компонента, тривалістю виконання аналітичних операцій. У фізико-хімічних методах аналізу кількість досліджуваного компонента визначають за зміною фізичних параметрів речовини. У них використовують спеціальні прилади, тому ці методи часто називають інструментальними. Виникнення аналітичного сигналу в цих методах зумовлене взаємодією речовини з різними видами енергії – електричною, тепловою, енергією електромагнітного випромінювання. Наприклад, у потенціометрії аналітичним сигналом є зміна величини електродного потенціалу; в кондуктометрії − зміна електропровідності розчину; кулонометричний метод ґрунтується на вимірюванні кількості електрики, витраченої на електроліз аналізованого об’єкта; в спектрофотометрії слідкують за зміною оптичної густини та кольору досліджуваного розчину. У фізичних методах аналізу хімічні реакції не проводять або вони мають другорядне значення. Так, радіометричний аналіз ґрунтується на вимірюванні випромінювання радіоактивних ізотопів, що додаються в мізерній кількості до стабільної нерадіоактивної речовини і дають можливість спостерігати утворення, рух і розподіл мічених атомів. Радіометричний метод є одним з кращих методів вивчення механізму хімічних реакцій і в практиці сільського господарства дозволяє дослідити шляхи проникнення мікроелементів у рослині, вивчити ефективність різних прийомів внесення мінеральних добрив, передбачити зміну фізико-хімічних властивостей ґрунтів. Спектральний атомний емісійний аналіз ґрунтується на вивченні спектрів пари досліджуваної речовини. Наявність у спектрі характерних ліній, притаманних атомам певного елемента, свідчить про присутність цього елемента в аналізованій пробі, інтенсивність ліній спектра є мірою його кількості. Цим методом часто аналізують склад ґрунтів. 9.2. Відбір середньої проби Перед виконанням кількісного аналізу необхідно правильно відібрати пробу. Проба − це невелика частина аналізованого матеріалу, середній склад якої максимально наближається до середнього складу всієї речовини. Методи відбору газоподібних, рідких та твердих проб залежать від властивостей аналізованого матеріалу і регламентуються спеціальними документами. Незалежно від методу аналізу відбір проби передбачає три операції: а) приготування генеральної первинної проби (маса такої проби – від одного до декількох кілограмів); б) скорочення первинної проби до розміру лабораторної або паспортної ( 300 г); в) отримання аналітичної проби – її відбирають від лабораторної, маса цієї проби відповідає масі наважки. Важливою характеристикою проби є її представництво, тобто відповідність проби середньому складу матеріалу, що аналізують. Представництво проби дозволяє поширити результати аналізу, отримані в лабораторії для невеликої частини матеріалу, на всю партію. Для твердих матеріалів відбирають проби з великою масою, далі її подрібнюють, просіюють і квартуванням готують лабораторну пробу. Для цього генеральну пробу насипають у вигляді конуса, конус перетворюють на плоский квадрат, який ділять по діагоналі на чотири частини. Два протилежних сектори відкидають, а два інших знову перемішують і квартують до отримання лабораторної проби необхідної маси. Для рідин і газів генеральна проба може бути невеликою через однорідність матеріалу. Перед відбором проби рідину або газ обов’язково перемішують. Якщо рідина містить осад, то її ретельно перемішують і лише після цього швидко відбирають пробу – розчин разом з осадом. Аналізуючи води річок та озер на різній глибині, користуються спеціальними пробовідбірниками, які можна відкрити і заповнити рідиною в будь-якому місці. Слід уникати забруднення проби з боку приладів для пробовідбору та ємностей для зберігання проб. Під час відбору проб обов’язково зазначають дату, час, джерело відбору, компоненти, що визначаються. Отриману пробу готують до аналізу. Основною метою підготовки проби є переведення її в фізичний стан, відповідний для обраної методики. В переважній більшості випадків аналізу користуються висушеною або повітряно-сухою пробою. Тому попередньо визначають вміст води в пробі, вологу видаляють, повітряно-суху пробу зважують і переводять у розчинний стан. Для розкладання твердої проби підбирають відповідні розчинники або плавні залежно від властивостей аналізованої проби та визначуваного компонента. Обираючи методику визначення досліджуваного компонента дотримуються того, щоб вміст аналізованої речовини відповідав діапазону визначуваних концентрацій методики. При аналізі рідких проб це досягається розведенням або концентруванням слідових кількостей досліджуваної речовини. У підготовленій пробі кількісно визначають компоненти за допомогою відповідних методів аналізу. Експериментальні дані щодо складу аналізованої проби обробляють математично. 9.3. Основні метрологічні поняття хімічного аналізу Метрологією називають науку про вимірювання величин та методи розрахунку результатів цих вимірювань. У кількісному аналізі при визначенні вмісту речовин в об’єкті завжди виникають похибки (помилки, погрішності), тобто є відхилення результату вимірювання від дійсного значення вимірюваної величини. За причинами виникнення, можливостями усунення та характером їх прояву похибки поділяють на систематичні, випадкові та промахи. Систематичні похибки можуть бути зумовлені вибраним методом аналізу, недосконалістю вимірювальних приладів (недостатня точність аналітичних терезів, користування невідкаліброваним хімічним посудом) тощо. Часто помилки виникають внаслідок відхилення стану реагентів або реакцій від ідеального (неповнота перебігу реакцій, нестійкість окремих речовин, сторонні процеси). Наприклад, в гравіметрії для визначення досліджуваного компонента добувають якомога чистий осад. Недостатнє промивання осаду веде до його забруднення сторонніми йонами, тому маса його буде завищена. З іншого боку, надмірне промивання осаду може привести до втрати досліджуваного компонента внаслідок його розчинності, виникає негативна систематична помилка. Систематичні похибки можна передбачити й усунути або ввести відповідні поправки. Випадкові помилки виникають під дією багатьох факторів, змінюються випадковим чином, тому їх не можна передбачити. Наслідком таких помилок є деяке розсіювання результатів при повторних вимірюваннях навколо якогось певного значення. Як правило, випадкові погрішності компенсують одна одну і сумарна дія їх мінімальна. Іноді такі погрішності посилюють одна одну і сприяють досить значній позитивній або негативній похибці. Вони можуть виникати при зміні температури, вологості повітря, непередбачуваній втраті речовини. Кількість таких помилок можна значно зменшити, збільшуючи число паралельних визначень, але повністю усунути їх неможливо. Грубі помилки або промахи відрізняються різким відхиленням одержаного результату від загального ряду вимірювань. Вони зумовлені низькою кваліфікацією аналітика, раптовим порушенням умов вимірювання, наприклад, різкою зміною сили струму в мережі електропостачання, неправильно підібраним індикатором, проливанням або просипанням аналізованої проби. Похибки можуть бути позитивними або негативними, залежно від того, завищують чи занижують вони результат аналізу. За способом обчислення погрішності поділяють на абсолютні та відносні. Абсолютна погрішність − це різниця між отриманим результатом аналізу й істинним (дійсним) значенням цієї величини: Δx = x − , де Δ − абсолютна погрішність вимірювання; x − результат аналізу; m − істинне значення величини. Відносна погрішність представляє собою відношення абсолютної погрішності до дійсного значення величини ( її виражають у відсотках ): Δ = 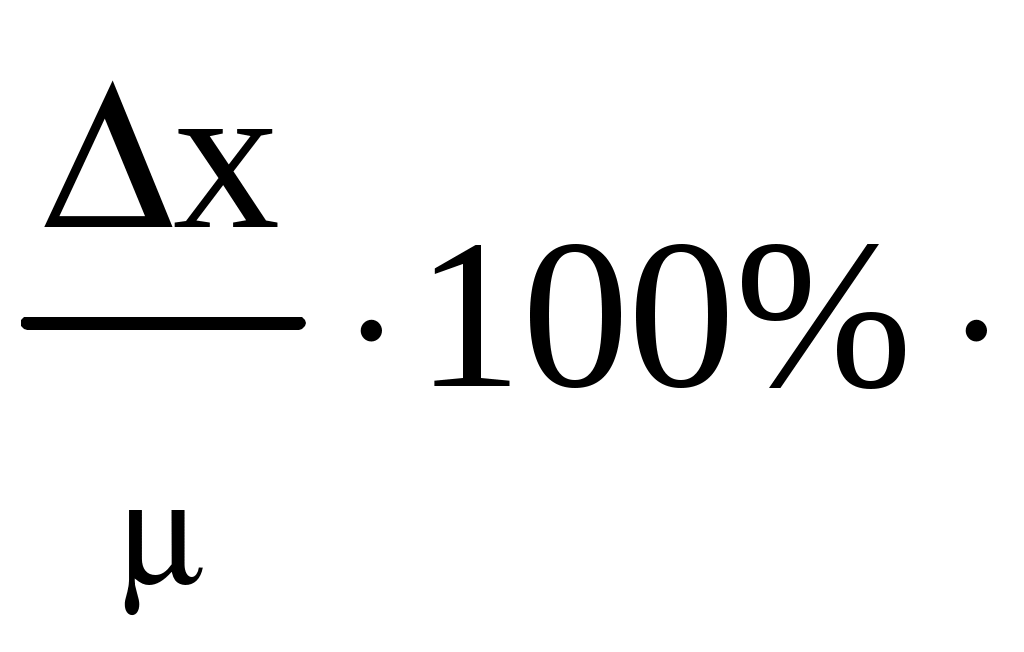 Основними метрологічними характеристиками методів аналізу є точність, правильність, відтворюваність, а також розмір похибки, що допускається. Ці характеристики визначають якість вимірювань, що проводяться. Абсолютно точно виміряти істинне значення вмісту досліджуваної речовини неможливо, тому вимірюють межі, в яких перебуває це значення і зазначають ступінь точності такого вимірювання. Знаходження таких меж є предметом статистичного опрацювання результатів аналізу, що ґрунтується на математичних законах. Під точністюаналізу розуміють ступінь наближення його результатів до дійсного значення вимірюваної речовини. Висока точність вимірювань відповідає малим похибкам. Точність аналізу характеризується правильністю та відтворюваністю результатів аналізу. Правильністьаналізу означає наближення до нуля систематичних помилок. Відтворюваністю аналізу називають якість вимірювань, що відображає близькість результатів вимірювань, проведених у різних умовах (в різний час, різними методами, виконавцями тощо). Для перевірки правильності результатів визначення користуються такими прийомами: аналіз незалежними методами, аналіз стандартних зразків, варіювання розміру аналізованої проби (метод додатків) тощо. Порівняння результатів аналізу з результатом, отриманим іншим незалежним методом, здійснюють за умови, що обраний для порівняння метод дає вірний результат і в основі своїй має інший принцип визначення досліджуваного компонента. Наприклад, якщо вміст катіонів кальцію визначають за комплексонометрією, то для перевірки правильності результатів аналізу користуються гравіметрією й іони кальцію осаджують у вигляді кальцій оксалату. Використання стандартних зразків є найнадійнішим способом перевірки правильності аналізу. Стандартні зразки готують з матеріалу, склад і властивості якого точно встановлені й підтверджені офіційним свідоцтвом або паспортом. Атестацію стандартних зразків здійснюють декількома методами в найбільш відповідальних лабораторіях. Для перевірки правильності аналізу вибирають стандартний зразок, який найбільшою мірою наближається за складом до аналізованої проби, виконують аналіз проби і стандартного зразка, встановлюють вміст окремих компонентів у них. Вважають, що досліджуваний метод аналізу є вірним, якщо визначений вміст окремих елементів у стандартному зразку відповідає паспортним даним, зазначеним при атестації цього зразка. Експериментальні дані після усунення систематичних погрішностей і промахів являють собою випадкові величини, розподіл яких підлягає законам математичної статистики, що дозволяють оцінити точність виконаних вимірювань. У математичній статистиці обирають генеральну сукупність результатів – гіпотетичну сукупність, що відображає досить велику кількість спостережень і визначають її параметри. Стосовно результатів хімічного аналізу генеральна сукупність – це результати, що можуть бути отримані при аналізі одного й того ж об’єкта різними методами, за допомогою різних приладів, різними аналітиками. Виконати нескінченну кількість вимірювань (генеральну сукупність) практично нереально, тому для визначення вмісту тієї чи іншої речовини на практиці обмежуються 3-7 паралельними вимірюваннями аналізованої проби, а результати аналізу називають вибірковою сукупністю або вибіркою. Середнє вибірки 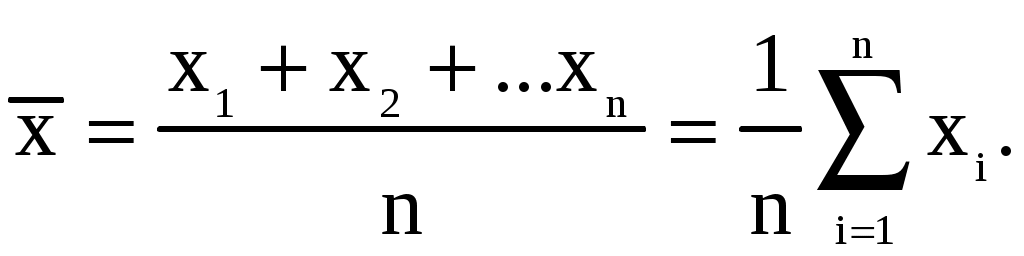 Виходячи із закону розподілу Гауса, в теорії похибок доводять, що середнє арифметичне є найбільш близьким до реального значення істинної величини. Розкид результатів навколо середнього арифметичного характеризують дисперсією S2 , стандартним відхиленням середнього арифметичного S та відносним стандартним відхиленням Sr: 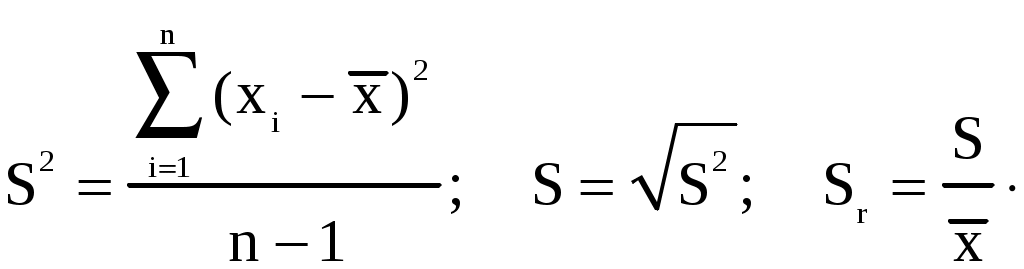 Усі три величини характеризують відтворюваність результатів аналізу. Дисперсія є однією з найбільш важливих характеристик випадкових помилок. Чим менше значення дисперсії, тим менше розкид значень і точніший аналіз. Стандартне відхилення S є статистичною оцінкою випадкової помилки і визначає міру розсіювання випадкової помилки відносно середнього значення. Воно орієнтовно вказує, яких відхилень слід чекати при повторних вимірюваннях. Такої ідеальної відтворюваності досягти ніколи не можна. На основі стандартного відхилення встановлюють наявність грубих помилок. Визначене на основі експериментальних даних середнє арифметичне лише наближається до дійсного значення шуканої величини , тому за допомогою методів математичної статистики встановлюють межі, в яких з певним ступенем ймовірності можна визначити дійсне значення вимірюваної величини. Такі межі називають довірчим інтервалом. Встановлюючи довірчий інтервал, слід обов’язково зазначити довірчу ймовірність або ступінь надійності отриманих результатів. Довірча ймовірність аналізу означає, що нове значення вимірюваної величини обов’язково потрапить у межі довірчого інтервалу. Найчастіше в аналітичній хімії довірчу ймовірність приймають рівною 90 %; 95 % або 99,7 %. До метрологічних характеристик аналізу відносяться також межа виявлення та діапазон визначуваних концентрацій, що характеризують чутливість методів. Межа виявлення – це найменша концентрація компонента, яку можна відкрити з певною довірчою ймовірністю. Межу виявлення задають мінімальним аналітичним сигналом, який можна впевнено відрізнити від фонового сигналу. Вважають, що вона відповідає сигналу, що перевищує середнє фонове значення у 3 рази. Діапазон визначуваних концентрацій − це область концентрацій, що передбачена для визначення даною методикою. Верхня границя цього діапазону характеризується найбільш високим значенням концентрації, що може бути визначена за допомогою даної методики, обмежена можливістю вимірювання аналітичного сигналу з достатньою точністю, нижня границя характеризує можливості кількісного методу і за абсолютним значенням завжди вище межі виявлення. Межа виявлення встановлює факт наявності речовини і належить до понять якісного аналізу, а діапазон визначуваних концентрацій характеризує кількісний аналіз. Контрольні питання Що є предметом кількісного аналізу? Класифікація методів кількісного аналізу. Що розуміють під поняттям “представництво проби”? Дати визначення основним метрологічним характеристикам аналізу. Якими причинами зумовлені систематичні та випадкові помилки аналізу? Які величини використовують для оцінки точності результату аналізу? Якими методами перевіряють правильність аналізу? Які величини використовують для оцінки відтворюваності вибіркової сукупності даних хімічного аналізу? Що визначає точність вимірювання? Що характеризує довірчий інтервал? |
