Ответы на вопосы. 1. Дефлаграционное горение
 Скачать 62.51 Kb. Скачать 62.51 Kb.
|
|
Ответы на вопосы. 1. Дефлаграционное горение Нормальное горение неустойчиво и в закрытом пространстве склонно к самоускорению. Причиной этому является искривление фронта пламени вследствие трения газа о стенки сосуда и изменения давления в смеси. Рассмотрим процесс распространения пламени в трубе (рис. 1). Р 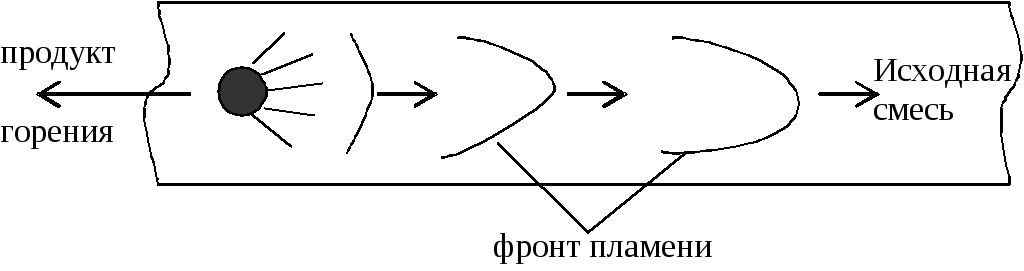 ис. 1. Схема возникновения взрывного горения. ис. 1. Схема возникновения взрывного горения.Сначала у открытого конца трубы пламя распространяется с нормальной скоростью, т.к. продукты горения свободно расширяются и выходят наружу. Давление смеси не изменяется. Длительность равномерного распространения пламени зависит от диаметра трубы, рода горючего и его концентрации. По мере продвижения фронта пламени внутрь трубы продукты реакции, имея больший объем по сравнению с исходной смесью, не успевают выходить наружу и их давление возрастает. Это давление начинает давить во все стороны, и поэтому впереди фронта пламени исходная смесь начинает двигаться в сторону распространения пламени. Прилегающие к стенкам слои тормозятся. Наибольшую скорость имеет пламя в центре трубы, меньшую – у стенок (из-за теплоотвода в них). Поэтому фронт пламени вытягивается в сторону распространения пламени, а поверхность его увеличивается. Пропорционально этому увеличивается количество сгораемой смеси в единицу времени, которое влечет за собой возрастание давления, а то в свою очередь – увеличивает скорость движения газа и т.д. Таким образом, происходит лавинообразное повышение скорости распространения пламени до сотен метров в секунду. Процесс распространения пламени по горючей газовой смеси, при котором самоускоряющаяся реакция горения распространяется вследствие разогрева путем теплопроводности от соседнего слоя продуктов реакции, называется дефлаграцией. Обычно скорости дефлаграционного горения дозвуковые, т.е. менее 333 м/с. 11.Определение концентрационных пределов газовоздушных смесей. Из теории горения следует, что по мере понижения содержания недос-тающего компонента горючей смеси, а с ним и температуры горения, умень-шается нормальная скорость пламени. Нормальная скорость пламени инможет, казалось бы, уменьшаться до нуля, а температура горения – до температуры исходных газов. Скорость неадиабатического пламени уменьшается при охлаждении зо-ны горения. Однако эта зона отдает непосредственно в окружающее про-странство небольшое количество тепла. Более интенсивны тепловые потери, связанные с охлаждением слоев газа, прилегающих к пламени (рис. 2). При этом температура остывающих продуктов сгорания оказывается меньше тем-пературы зоны реакции и возникает температурный градиент, направленный в сторону сгоревшего газа. В результате зона реакции охлаждается путем те-плопроводности. В тепловых потерях участвует также инагретая, но несго-ревшая смесь, передающая в конечном счете тепло зоны реакции в окру-жающее пространство. Р 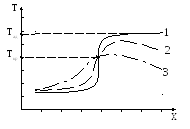 ис. 2. Изменение распределения температуры во фронте пламени под влиянием тепловых потерь: 1 – адиабатическое горение; 2, 3 – горение с тепловым потерями (q2 ис. 2. Изменение распределения температуры во фронте пламени под влиянием тепловых потерь: 1 – адиабатическое горение; 2, 3 – горение с тепловым потерями (q2Относительная роль теплопотерь за счет теплопроводности к стенкам сосуда и излучения возрастает с уменьшением скорости горения, так как при этом продолжительность процесса теплоотдачи от нагретого газа больше. При определенном критическом значении тепловых потерь зона реакции про-грессивно охлаждается, реакция тормозится, и пламя затухает. Этот режим соответствует пределу распространения пламени. При изучении механизма теплового самовоспламенения (рис. 2) было показано, что превышение теплоприхода над теплоотводом, приводящее к саморазогреву и воспламенению горючей смеси, начинается при температуре стенок сосуда То=Ткр. При этом мы рассматривали определенный состав сме-си, то есть соотношение горючего и окислителя, изменяя температуру стенок реакционного сосуда. Теперь рассмотрим случай, когда температура стенок То=const, а изме-няется концентрация компонентов смеси. Скорость выделения тепла, как и скорость пламени изменяется по урав-нению (1): в котором существенную роль играет тепловой эффект реакции (Q) и кон-центрация веществ (с). Схема соотношения между теплоотводом q2 и теплоприходом q1 при трех разных составах q1max, q1кр и q1и показана на рис. 3. Р 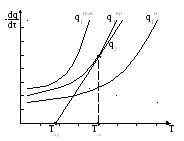 ис. 3. Соотношение между теплоприходом и теплоотводом в горючих смесях при q1max > q1кр > q1и. ис. 3. Соотношение между теплоприходом и теплоотводом в горючих смесях при q1max > q1кр > q1и.Величина тепловыделения, скорость пламени и температура горения достигают максимального значения для стехиометрических смесей (q1max). При удалении состава смеси от стехиометрического возрастают потери тепла из зоны пламени на нагрев избытка компонента. Это приводит к сни-жению теплового эффекта реакции, прогрессивному охлаждению зоны горе-ния и уменьшению скорости распространения пламени до Uпр (кривая q1кр). При снижении количества горючего (бедные смеси) или окислителя (богатые смеси) больше критического пламя гаснет либо, с другой стороны, невоз-можно поджечь такую смесь внешним импульсом тепла (q1). Таким образом, скорость пламени не может быть меньше определенно-го критического значения. Распространение пламени в смесях горючего и окислителя возможно лишь в определенном интервале концентраций. При поджигании смесей, состав которых выходит за эти пределы, стационарное пламя не образуется, и реакция, вызванная поджигающим импульсом, затуха-ет на некотором расстоянии от места ее инициирования. При выходе составов за эти пределы стационарное пламя затухает. Для смесей горючего и окислителя принято различать верхнюю πmax и нижнюю πmin предельные концентрации горючего, которыми ограничена об-ласть взрывоопасных составов. Эти пределы являются важнейшей характе-ристикой взрывоопасное горючих газов и паров. Они зависят в основном от содержания инертных компонентов в смеси и в меньшей степени – от давле-ния и температуры. С повышением начальной температуры смеси πmin снижа-ется, а πmax повышается, поскольку в смесь вносится внешнее физическое те-пло. Изменение начального давления смеси влияет на пределы по-разному. Так, для смеси водорода с воздухом они почти не изменяются, в то время как для окиси углерода резко сужаются и при 20 атм смеси становятся невзрыво-опасными. Значения πmin и πmax определяют границы составов смесей, содержащих горючее и окислитель, образование которых не связано с опасностью взрыва. Исходя из этих величин, определяют возможности выбора безопасных соста-вов в технологических процессах. Значения концентрационных пределов несколько зависят от формы и направления распространения пламени в сосуде, в котором изучается горе-ние. При поджигании у верхнего конца вертикальной трубы распространение пламени возможно в более узком интервале концентраций, чем при поджига-нии у нижнего конца. Эта особенность обусловлена возникновением конвек-тивных потоков, поднимающих вверх нагретые продукты сгорания и тем са-мым облегчающих распространение пламени вверх у предельных составов. Ниже приведены значения концентрационных пределов распростране-ния пламени вверх для воздушных и кислородных смесей различных горю-чих при атмосферном давлении и комнатной температуре. 21.Определение количества воздуха, необходимого для горения индивидуальных горючих веществ. Расчет объема воздуха, необходимого для горения, предполагает вычисление а) теоретического объема воздуха Vвтеор и б) практического объема воздуха Vвпр, затраченного на горение (с учетом коэффициента избытка воздуха). Стехиометрическое количество воздуха в уравнении реакции горения предполагает, что при данном соотношении компонентов, участвующих в реакции горения, воздух расходуется полностью. Объем воздуха в данном случае называется теоретическим (Vвтеор). Горение может происходить не только при стехиометрическом соотношении компонентов, но и при значительном отклонении от него. Как правило, в условиях пожара на сгорание вещества воздуха затрачивается больше, чем определяется теоретическим расчетом. Избыточный воздух в в реакции горения не расходуется и удаляется из зоны реакции вместе с продуктами горения. Таким образом, практический объем воздуха равен Vвпр = Vвтеор + Vв и, следовательно, избыток воздуха будет равен Vв= Vвпр - Vвтеор Обычно в расчетах избыток воздуха при горении учитывается с помощью коэффициента избытка воздуха (). Коэффициент избытка воздуха показывает, во сколько раз в зону горения поступило воздуха больше, чем это теоретически необходимо для полного сгорания вещества: 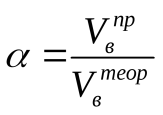 (2) (2) = 1, при этом реальный расход воздуха равен теоретическому. В этом случае обеспечивается оптимальный режим горения.Для горючих смесей стехиометрического состава (т.е. состава, соответствующего уравнению реакции горения) коэффициент избытка воздуха При > 1 горючую смесь называют бедной по горючему компоненту, а при < 1 – богатой по горючему компоненту. Избыток воздуха имеется только в смеси, бедной по горючему компоненту. Vв= Vвтеор(1) В закрытом объеме диффузионное горение большинства горючих материалов возможно только до определенной пороговой концентрации кислорода, так называемой остаточной концентрации кислорода в продуктах горения (О2)ПГ. Для большинства органических веществ она составляет 12 – 16 % О2. Для некоторых веществ, например, ацетилена С2Н2, ряда металлов, горение возможно и при значительно меньшем содержании кислорода (до 5 % объемных О2). Зная содержание кислорода в продуктах горения, можно определить коэффициент избытка воздуха (коэффициент участия воздуха в горении) на реальном пожаре: 31.Определение стехиометрической концентрации паров горючего. Стехиометрическую концентрацию горючего вещества в воздухе определяют 2 способами: (для горения метана в воздухе, уравнение горения: CH4 + 2O2 + 2*3,76N2 = CO2 + 2H2O + 2*3,76N2 ) по уравнению химической реакции Сст = 1*100 / 1+ 2 +2*3,76 = 9,5%. Т.е. для полного сгорания метана в определенном объеме необходимо 80,5 % воздуха и 9,5 % метана. Сст = 100 / (1 + 4,84 β) β – стехиометрический коэффициент β = Nc + (Nh-Nx)/4 - No/2 Nс – число атомов углерода Nн – число атомов водорода Nх – число атомов галогенов Nо – число атомов кислорода Для метана β: 1+ ((4-0)/4) – 0/2=2 Сст = 100/(1+4,84*2)=9,4% |
