итоговая работа по химии. 1. Хлорамин б получение
 Скачать 6 Mb. Скачать 6 Mb.
|
|
1. Хлорамин Б  Получение. Для синтеза хлорамина Б используют общий принцип, основанный на получении амида бензолсульфокислоты, который затем хлорируют с помощью гипохлорита натрия. Исходным продуктом для получения хлорамина Б служит бензол: 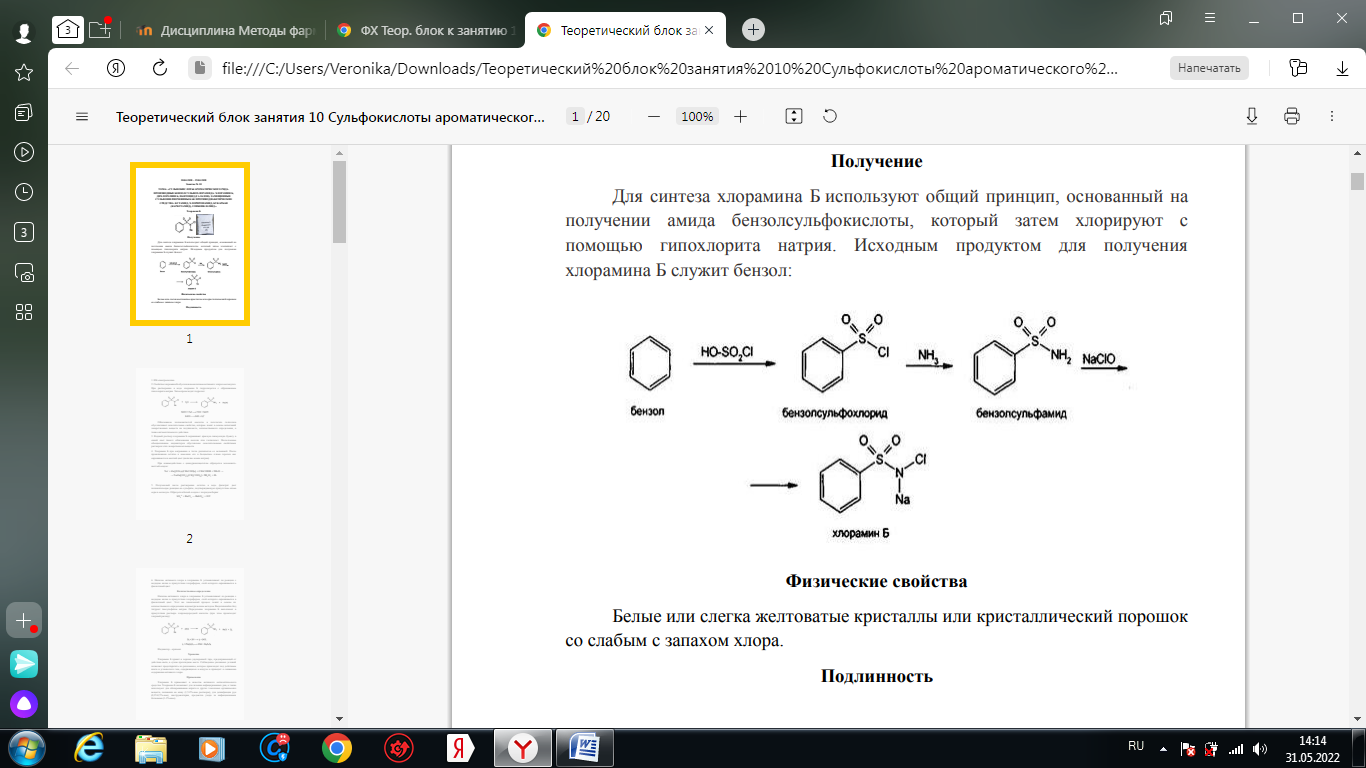 Физические свойства. Белые или слегка желтоватые кристаллы или кристаллический порошок со слабым с запахом хлора. Подлинность. 1. ИК-спектроскопия. 2. Свойства хлорамина Б обусловлены наличием активного хлора в молекулах. При растворении в воде хлорамин Б гидролизуется с образованием гипохлорита натрия. Затем происходит гидролиз:  Образование хлорноватистой кислоты в результате гидролиза обусловливает окислительные свойства, которые лежат в основе испытаний лекарственных веществ на подлинность, количественного определения, а также антисептического действия. 3. Водный раствор хлорамина Б окрашивает красную лакмусовую бумагу в синий цвет (ввиду образования щелочи при гидролизе). Последующее обесцвечивание индикаторов обусловлено окислительными свойствами растворов этих лекарственных веществ. 4. Хлорамин Б при нагревании в тигле разлагается со вспышкой. После прокаливания остатка и внесения его в бесцветное пламя горелки оно окрашивается в желтый цвет (наличие ионов натрия). При взаимодействии с цинкуранилацетатом образуется зеленоватожелтый осадок: Na+ + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O → → NaZn[(UO2)3(CH3COO)9] • 9H2O↓ + H 5. Полученный после растворения остатка в воде фильтрат дает положительную реакцию на сульфаты, подтверждающую присутствие атома серы в молекуле. Образуется белый осадок с хлоридом бария: SO4 2- + BaCl2 → BaSO4↓ + 2Cl- Количественное определение. Наличие активного хлора в хлорамине Б устанавливают по реакции с иодидом калия в присутствии хлороформа, слой которого окрашивается в фиолетовый цвет. Этот же химический процесс лежит в основе их количественного определения иодометрическим методом. Выделившийся йод титруют тиосульфатом натрия. Определение хлорамина Б выполняют в присутствии раствора хлороводородной кислоты (при этом происходит хлорный распад): Индикатор – крахмал.  Хранение. Хлорамин Б хранят в хорошо укупоренной таре, предохраняющей от действия света, в сухом прохладном месте. Соблюдение указанных условий позволяет предотвратить их разложение, которое происходит под действием влаги и углекислого газа, содержащихся в воздухе и приводит к снижению содержания активного хлора. Применение. Хлорамин Б применяют в качестве активного антисептического средства. Хлорамин Б назначают для лечения инфицированных ран, а также используют для обезвреживания иприта и других токсичных органических веществ, попавших на кожу (1,5-2%-ные растворы), для дезинфекции рук (0,25-0,5%-ные), инструментария, предметов ухода за инфекционными больными (1-3%-ные). 2. Пантоцид 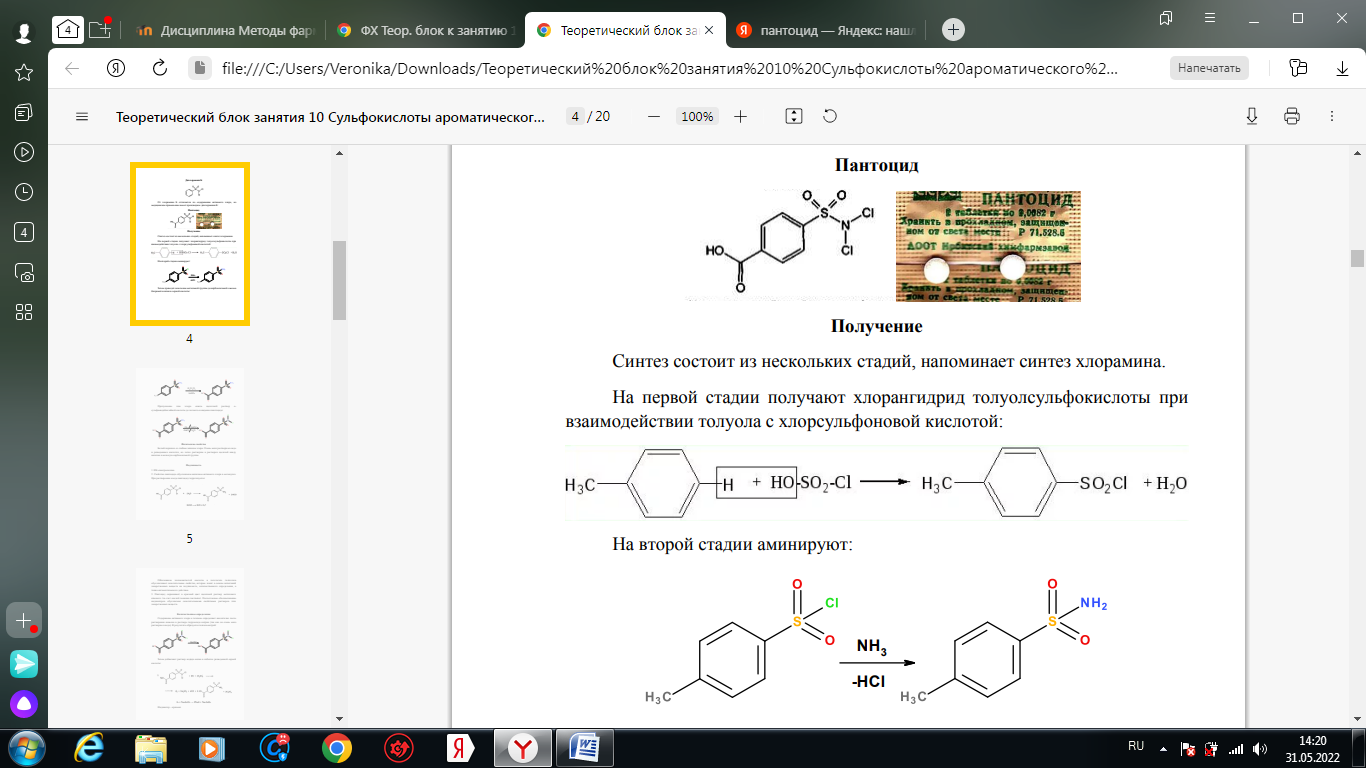 Получение .Синтез состоит из нескольких стадий, напоминает синтез хлорамина. На первой стадии получают хлорангидрид толуолсульфокислоты при взаимодействии толуола с хлорсульфоновой кислотой: На второй стадии аминируют:  Затем проводят окисление метильной группы до карбоксильной смесью бихромата калия и серной кислоты:  Пропускание газа хлора сквозь щелочной раствор псульфамидобензойной кислоты до полного осаждения пантоцида:  Физические свойства .Белый порошок со слабым запахом хлора. Очень мало растворим в воде и разведенных кислотах, но легко растворим в растворах щелочей ввиду наличия в молекуле карбоксильной группы. Подлинность 1. ИК-спектроскопия. 2. Свойства пантоцида обусловлены наличием активного хлора в молекулах. При растворении в воде пантоцид гидролизуется: 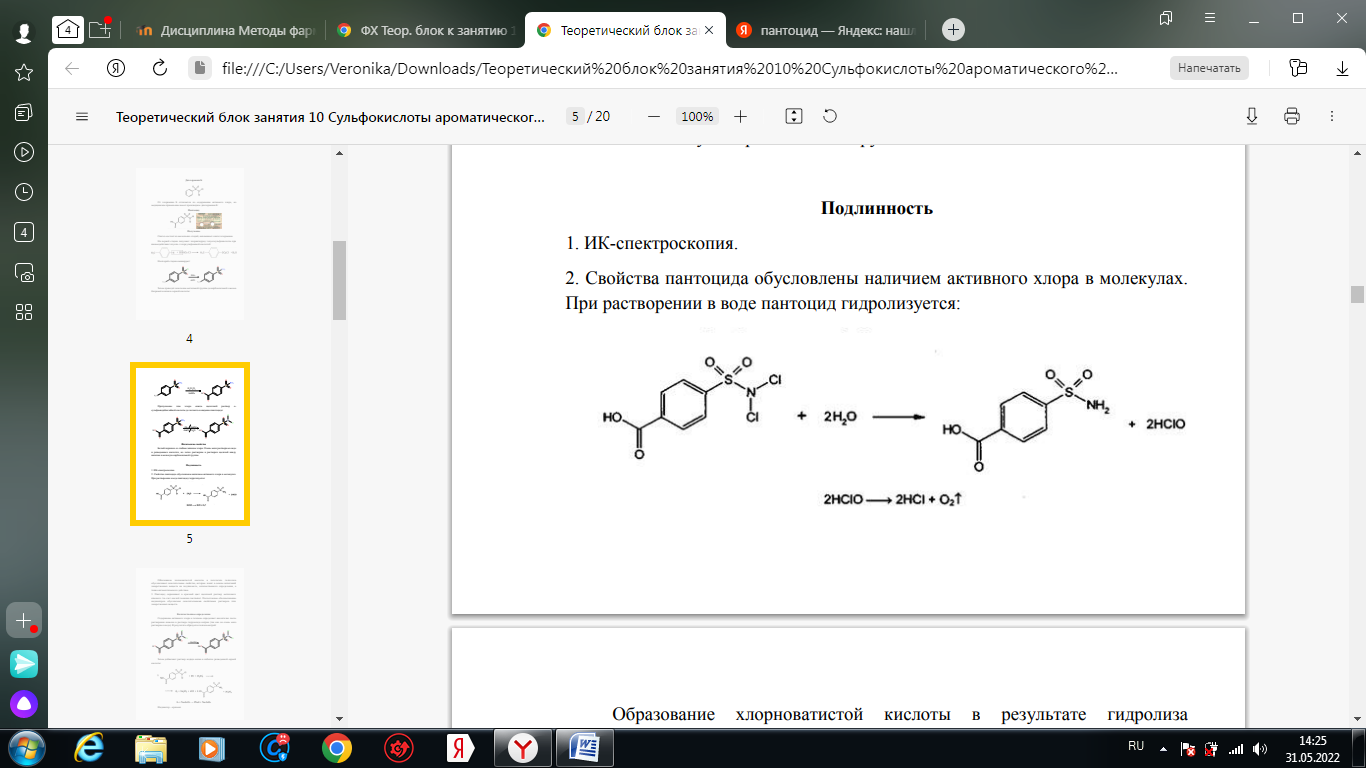 Образование хлорноватистой кислоты в результате гидролиза обусловливает окислительные свойства, которые лежат в основе испытаний лекарственных веществ на подлинность, количественного определения, а также антисептического действия. 3. Пантоцид окрашивает в красный цвет щелочной раствор метилового красного (за счет кислой реакции раствора). Последующее обесцвечивание индикаторов обусловлено окислительными свойствами растворов этих лекарственных веществ Количественное определение .Содержание активного хлора в галазоне определяют аналогично после растворения навески в растворе гидроксида натрия (так как он очень мало растворим в воде). В результате образуется галазон-натрий:  Затем добавляют раствор иодида калия и избыток разведенной серной кислоты: Индикатор – крахмал  Хранение .Пантоцид хранят в хорошо укупоренной таре, предохраняющей от действия света, в сухом прохладном месте. Соблюдение указанных условий позволяет предотвратить их разложение, которое происходит под действием влаги и углекислого газа, содержащихся в воздухе и приводит к снижению содержания активного хлора. Применение .Пантоцид применяют в качестве активного антисептического средства. Пантоцид применяют в основном для обеззараживания воды, используя для этого таблетки, содержащие, кроме пантоцида, карбонат натрия и хлорид натрия. Одна таблетка выделяет 3 мг активного хлора. 3.Хлорпропамид 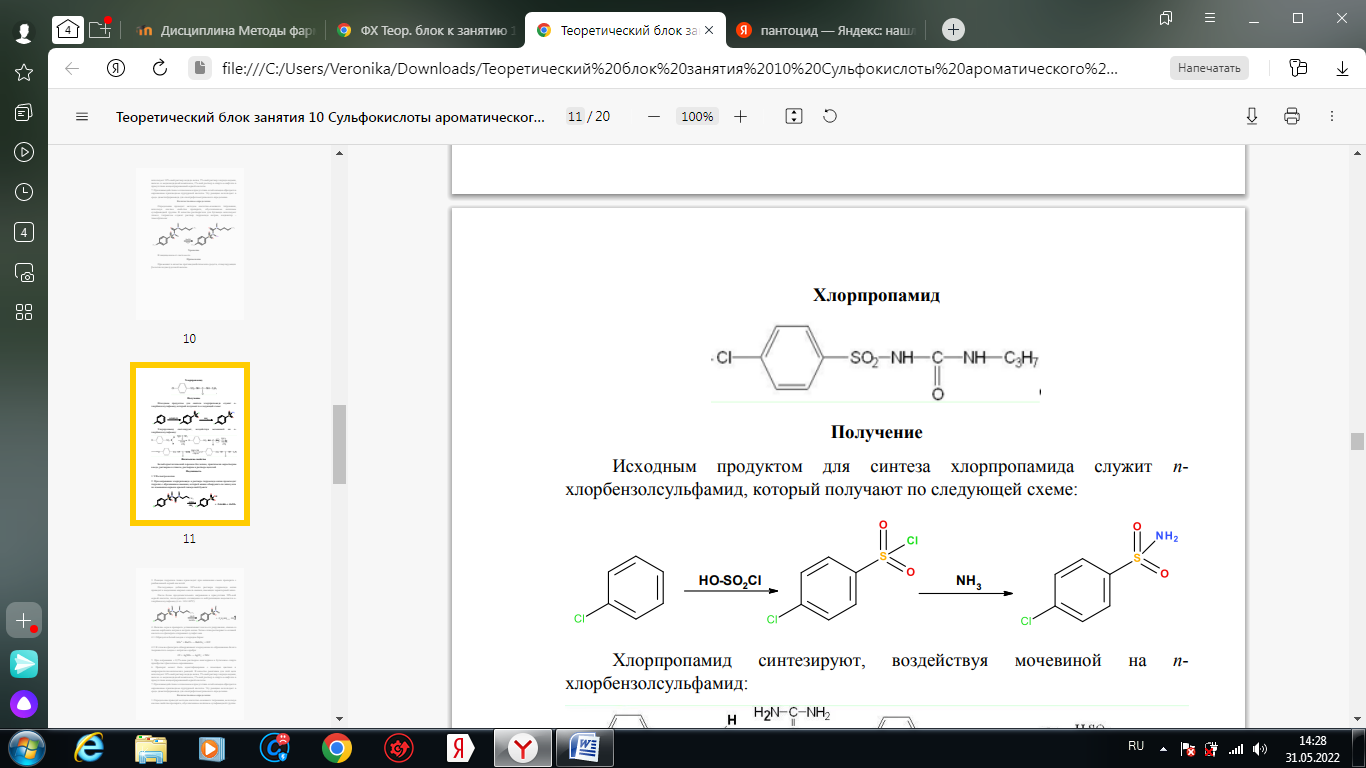 Получение Исходным продуктом для синтеза хлорпропамида служит пхлорбензолсульфамид, который получают по следующей схеме:  Хлорпропамид синтезируют, воздействуя мочевиной на пхлорбензолсульфамид: 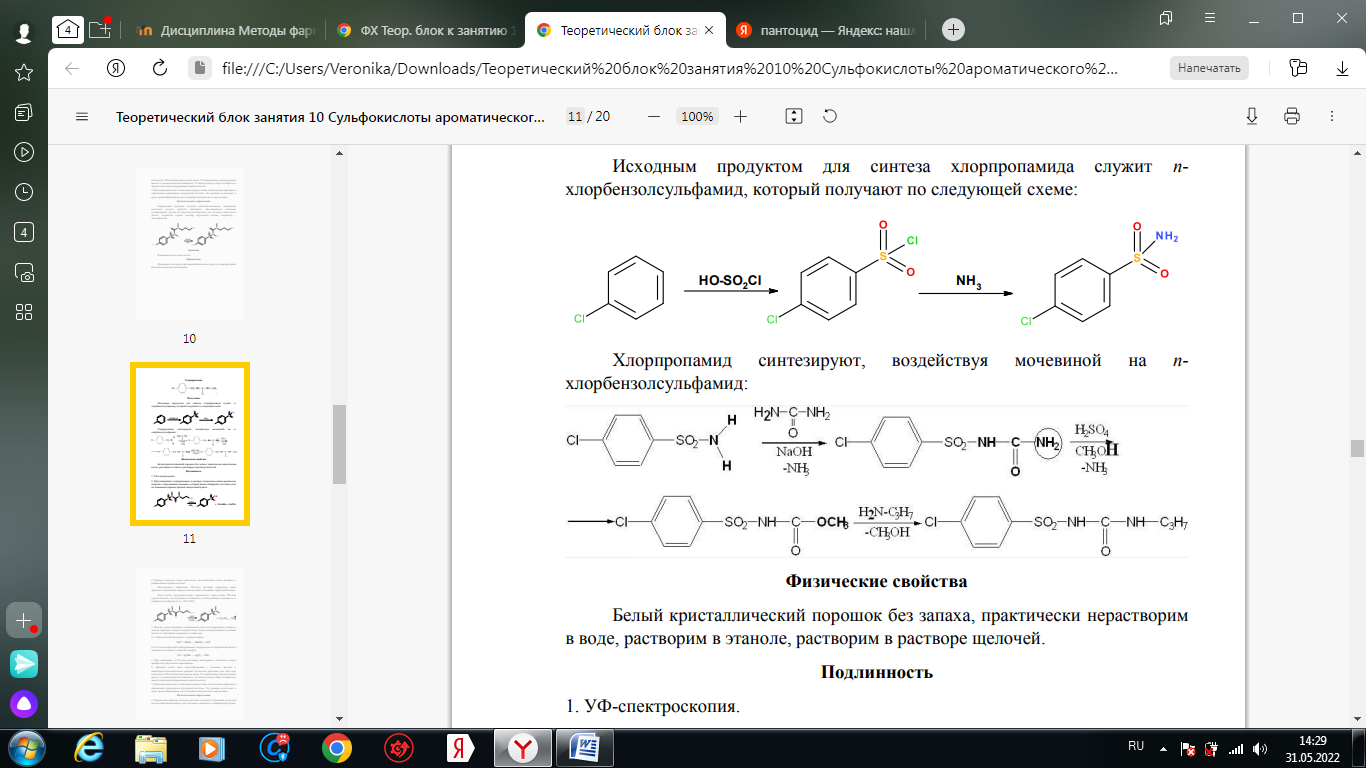 Физические свойства Белый кристаллический порошок без запаха, практически нерастворим в воде, растворим в этаноле, растворим в растворе щелочей. Подлинность 1. УФ-спектроскопия. 2. При нагревании хлорпропамида в растворе гидроксида калия происходит гидролиз с образованием аммиака, который можно обнаружить по запаху или по изменению окраски красной лакмусовой бумаги: 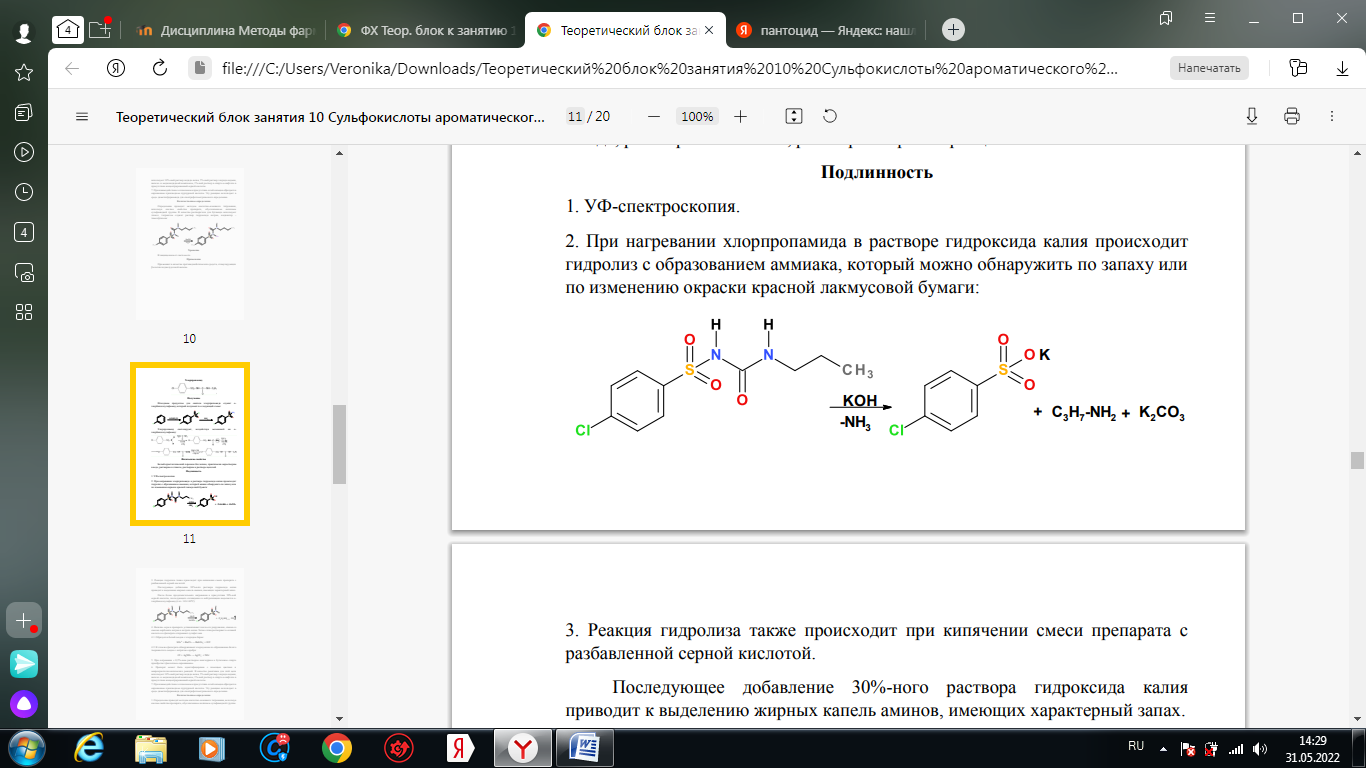 3. Реакция гидролиза также происходит при кипячении смеси препарата с разбавленной серной кислотой. Последующее добавление 30%-ного раствора гидроксида калия приводит к выделению жирных капель аминов, имеющих характерный запах. 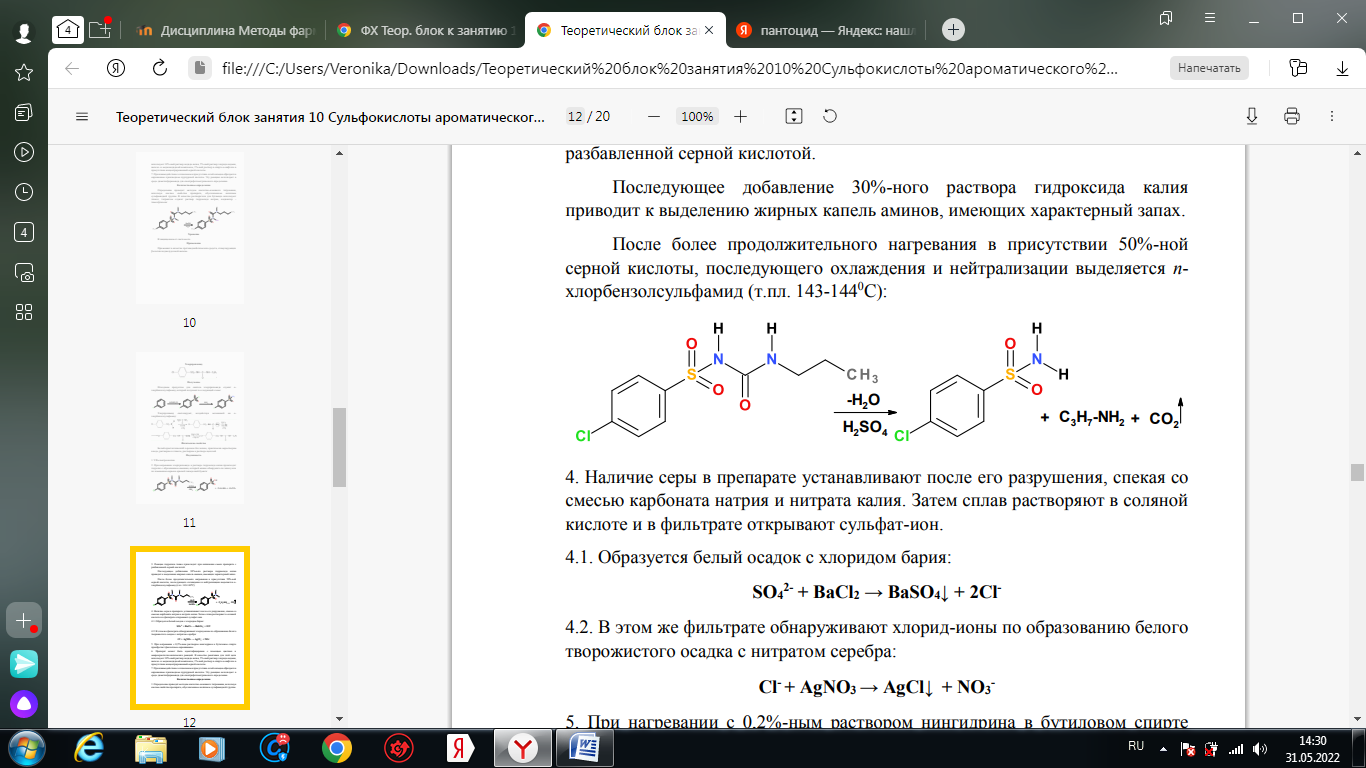 4. Наличие серы в препарате устанавливают после его разрушения, спекая со смесью карбоната натрия и нитрата калия. Затем сплав растворяют в соляной кислоте и в фильтрате открывают сульфат-ион. 4.1. Образуется белый осадок с хлоридом бария: SO4 2- + BaCl2 → BaSO4↓ + 2Cl4.2. В этом же фильтрате обнаруживают хлорид-ионы по образованию белого творожистого осадка с нитратом серебра: Cl- + AgNO3 → AgCl↓ + NO3 – 5. При нагревании с 0,2%-ным раствором нингидрина в бутиловом спирте приобретает фиолетовое окрашивание. 6. Препарат может быть идентифицирован с помощью цветных и микрокристаллоскопических реакций. В качестве реактивов для этой цели используют 10%-ный раствор иодида калия, 5%-ный раствор хлорида кадмия, железо- и медноиодидный комплексы, 1%-ный раствор в спирте α-нафтола в присутствии концентрированный серной кислоты. 7. При взаимодействии с аллоксаном в присутствии солей кальция образуются окрашенные производные пурпуровой кислоты. Эту реакцию используют в среде диметилформамида для спектрофотометрического определения. Количественное определение 1. Определение проводят методом кислотно-основного титрования, используя кислые свойства препарата, обусловленные наличием сульфамидной группы. -H2O H2SO4 + C3H7 -NH2 + CO2 В качестве растворителя для хлорпропамида используют этанол, титрантом служит раствор гидроксида натрия, индикатор – тимолфталеин:  2. Реакцию озоления хлорпропамида до образования сульфат-иона используют для количественного определения. Озоление проводят в колбе с кислородом в присутствии 0,1 М раствора хлорида бария и пероксида водорода. Избыток титранта устанавливают титрованием 0,1 М раствором серной кислоты (индикатор родизонат натрия) в водно-спиртовой среде в присутствии буферного раствора. 3. Обратное меркуриметрическое титрование после озоления хлорпропамида по хлорид-иону. Избыток титранта – раствора нитрата ртути (II) после отфильтровывания осадка титруют в фильтрате тиоцианатом аммония (индикатор железоаммониевые квасцы). Хранение В защищенном от света месте. Применение Применяют в качестве противодиабетических средств, стимулирующих β-клетки поджелудочной железы. 4. Стрептоцид растворимый 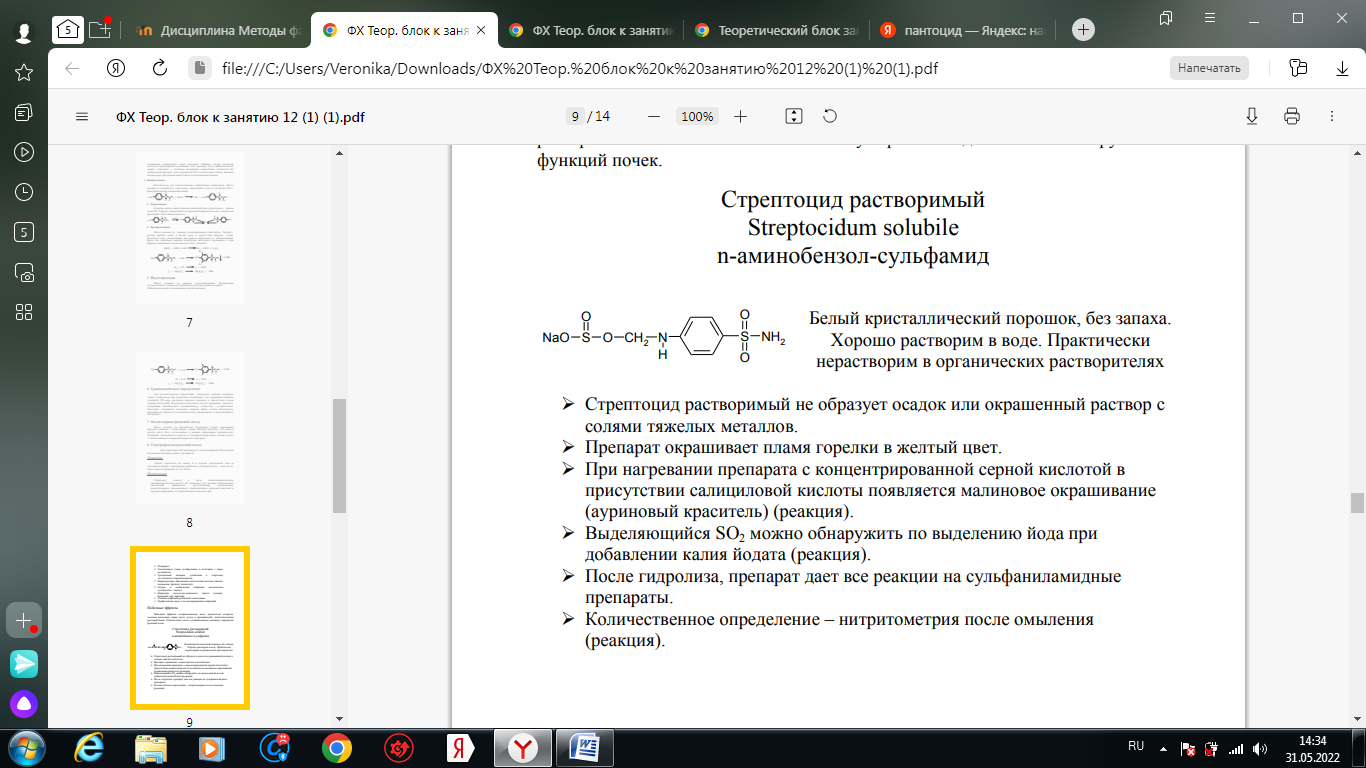 Получение. Способ получения стрептоцида растворимого, по которому растворяют пиросульфит натрия в воде, добавляют формалин, при рН 8,0-10,0 реакционной массы добавляют уголь активный и массу выдерживают при перемешивании и температуре 55±10°C в течение 1-1,5 часов, добавляют воду и стрептоцид, реакционную массу перемешивают в течение 10-20 минут, постепенно добавляют серную кислоту до рН реакционной массы 3,0-4,0 с последующим нагревом и выдержкой, загружают уголь активный, рН реакционной массы серной кислотой доводят до 3,0-4,5, загружают подогретый до температуры 50±10°C изопропиловый спирт в количестве 110,0-130,0 л, реакционную массу перемешивают и выдерживают при периодическом перемешивании, по окончании выдержки реакционная масса охлаждается, промывается изопропиловым спиртом, сушится и измельчается. Физические свойства : Белый кристаллический порошок, без запаха. Хорошо растворим в воде. Практически нерастворим в органических растворителях Подлинность : 1.Стрептоцид растворимый не образует осадок или окрашенный раствор с солями тяжелых металлов. 2. Препарат даёт характерную реакцию на Na+ в отличие от стрептоцида (окрашивает пламя горелки в жёлтый цвет). 3. При нагревании препарата с концентрированной серной кислотой в присутствии салициловой кислоты появляется малиновое окрашивание (ауриновый краситель) . Выделяющийся SO2 можно обнаружить по выделению йода при добавлении калия йодата 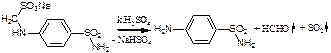 Далее прибавляем салициловую кислоту и к.H2SO4 и наблюдаем розовое окрашивание: 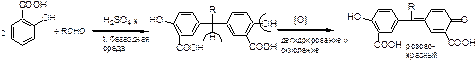 Количественное определение. Для количественного определения стрептоцида растворимого, в молекулах которых нет свободной ароматической аминогруппы, метод нитритометрии можно применить только после предварительного гидролиза .Сущность методики. К раствору субстанции прибавляют 10 мл разбавленной HCl, 1 г KBr и при постоянном перемешивании титруют 0, 1 М раствором Na. NO 2 , прибавляя его вначале со скоростью 2 мл/мин, а в конце титрования (за 0, 5 мл до точки эквивалентности) по 0, 05 мл через минуту. Сущность методики. К раствору субстанции прибавляют 10 мл разбавленной HCl, 1 г KBr и при постоянном перемешивании титруют 0, 1 М раствором Na. NO 2, прибавляя его вначале со скоростью 2 мл/мин, а в конце титрования (за 0, 5 мл до точки эквивалентности) по 0, 05 мл через минуту. Титрование проводят при температуре не выше 18– 20 С, а в некоторых случаях требуется охлаждение до 0– 10 С. 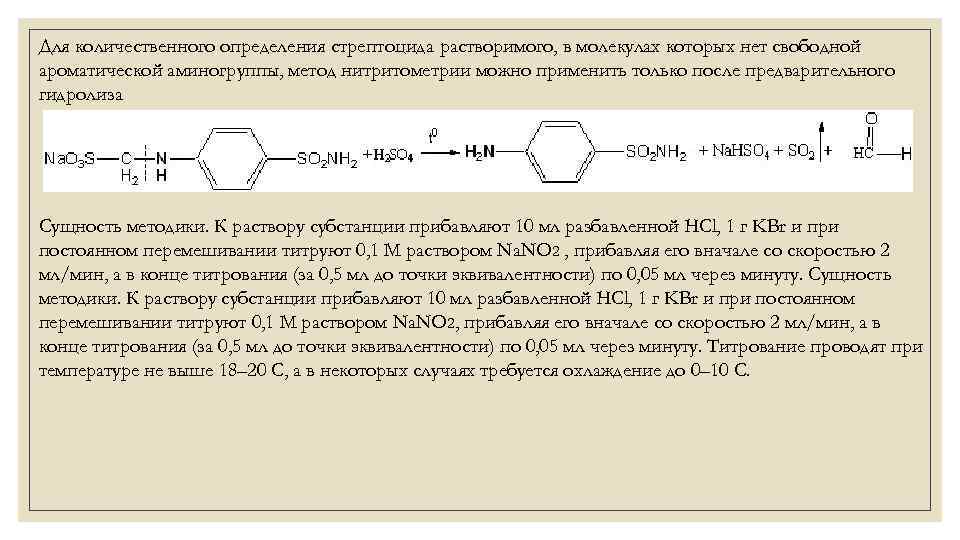 Титрант – нитрит натрия (0,1 М раствор). Титруют в присутствии KBr при 18-20 ºС или при 0-10 ºС. KBr катализирует процесс диазотирования, а охлаждение реакционной смеси позволяет избежать потерь азотистой кислоты и предотвратить разложение соли диазония. Точку эквивалентности можно установить: с помощью внутренних индикаторов (тропеолин 00, нейтральный красный, смесь тропеолина 00 с метиленовым синим); внешних индикаторов (йодкрахмальная бумага) или потенциометрически.  Хранение: В хорошо укупоренных банках. Применение: показания к применению такие же, как для стрептоцида. Хорошая растворимость в воде позволяет пользоваться препаратом для парентерального применения. Растворы можно вводить подкожно, внутримышечно и внутривенно. 5. Сульфацил-натрий 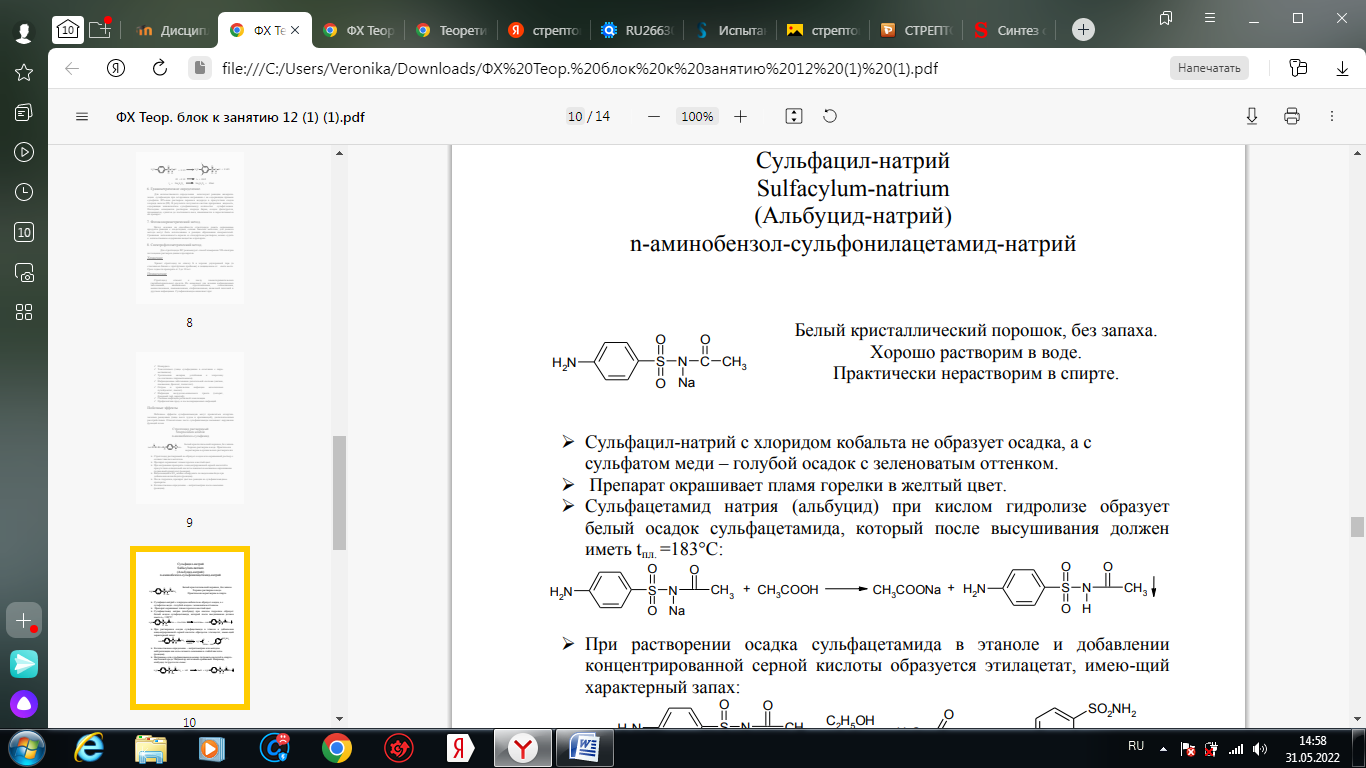 Физические свойства : Белый кристаллический порошок, без запаха. Хорошо растворим в воде. Практически нерастворим в спирте. Получение: 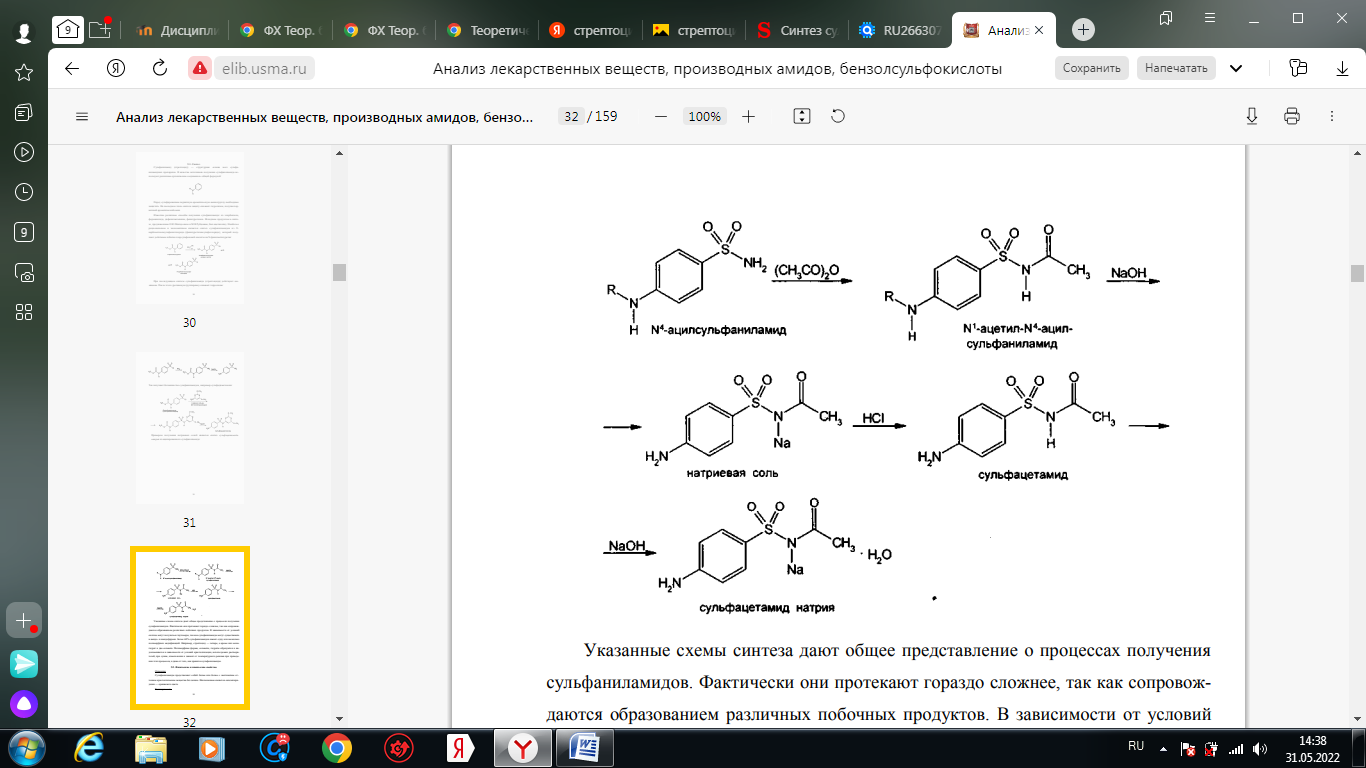 Подлинность : 1.Сульфацетамид натрия при действии уксусной кислотой выделяет белый осадок сульфацетамида, который после высушивания должен иметь температуру плавления около 183°С: 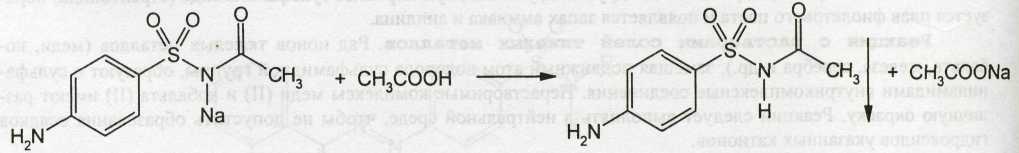 При растворении осадка в этаноле и добавлении концентрированной серной кислоты образуется этилацетат, имеющий характерный запах: 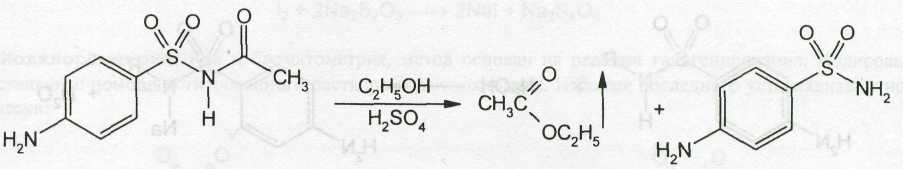 2.Препарат окрашивает пламя горелки в желтый цвет. Р-ции с растворами солей тяжёлых металлов: К препарату добавляют р-р сульфата меди. Происходит р-ция комплексообразования. Образуется голубовато-зеленоватое, не изменяющееся при стоянии окрашивание (внутрикомплексное соединение меди 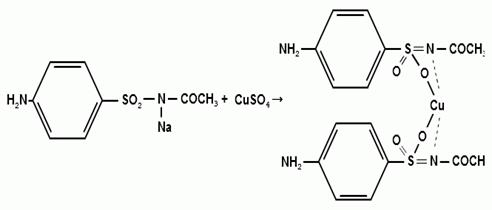 Количественное определение 1. нитритометрия или методом нейтрализации как соль сильного основания и слабой кислоты. 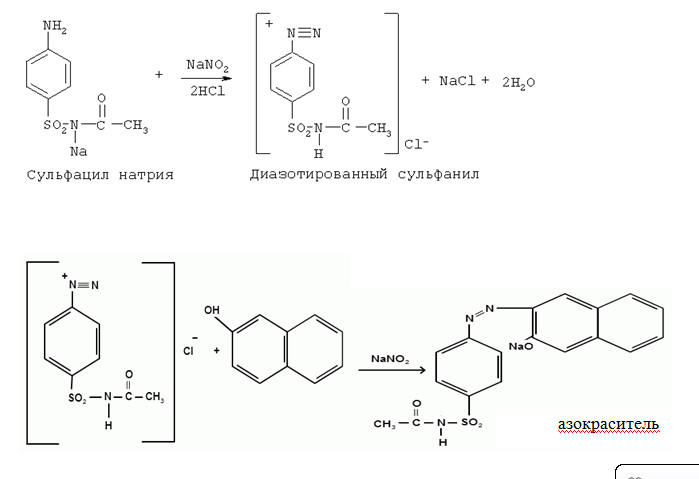 2.Натриевые соли сульфаниламидов можно титровать кислотой в спиртоацетоновой среде. Индикатор метиловый-оранжевый. Например, альбуцид титруется по схеме: S O O H N N 2 O CH3 Na 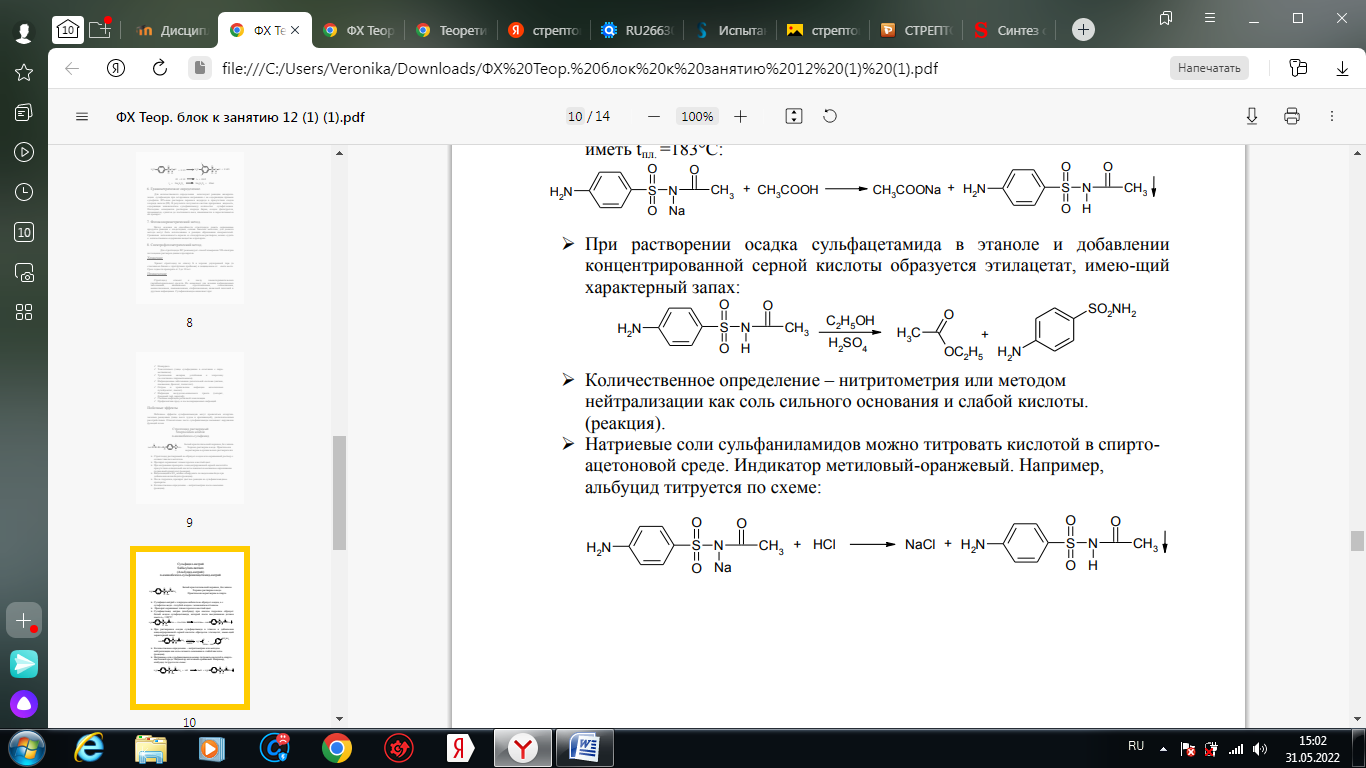 Хранение: В хорошо укупоренных банках. Применение: В комплексной терапии заболеваний век, конъюнктивы, роговицы, переднего отрезка сосудистой оболочки и слезных протоков, вызванных чувствительными к сульфацетамиду микроорганизмами. Профилактика инфекционных осложнений в комплексной терапии ожогов и травм органов зрения. Профилактика бленнореи у новорожденных. 6.ОБЩИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СУЛЬФАНИЛАМИДНЫХ ПРЕПАРАТОВ 1. Нитритометрия Этот метод рекомендуется НД для количественного определения сульфаниламидов, являющихся первичными ароматическими аминами. Определение основано на способности первичных аминов образовывать в кислой среде диазосоединения:  Титрант – нитрит натрия (0,1 М раствор). Титруют в присутствии KBr при 18-20 ºС или при 0-10 ºС. KBr катализирует процесс диазотирования, а охлаждение реакционной смеси позволяет избежать потерь азотистой кислоты и предотвратить разложение соли диазония. Точку эквивалентности можно установить: с помощью внутренних индикаторов (тропеолин 00, нейтральный красный, смесь тропеолина 00 с метиленовым синим); внешних индикаторов (йодкрахмальная бумага) или потенциометрически. 2. Нейтрализация Используется для количественного определения сульфаниламинов и их солей. Метод основан на способности сульфаниламидов образовывать соли со щелочами (Jnd – фенолфталеин или тимоловый синий): 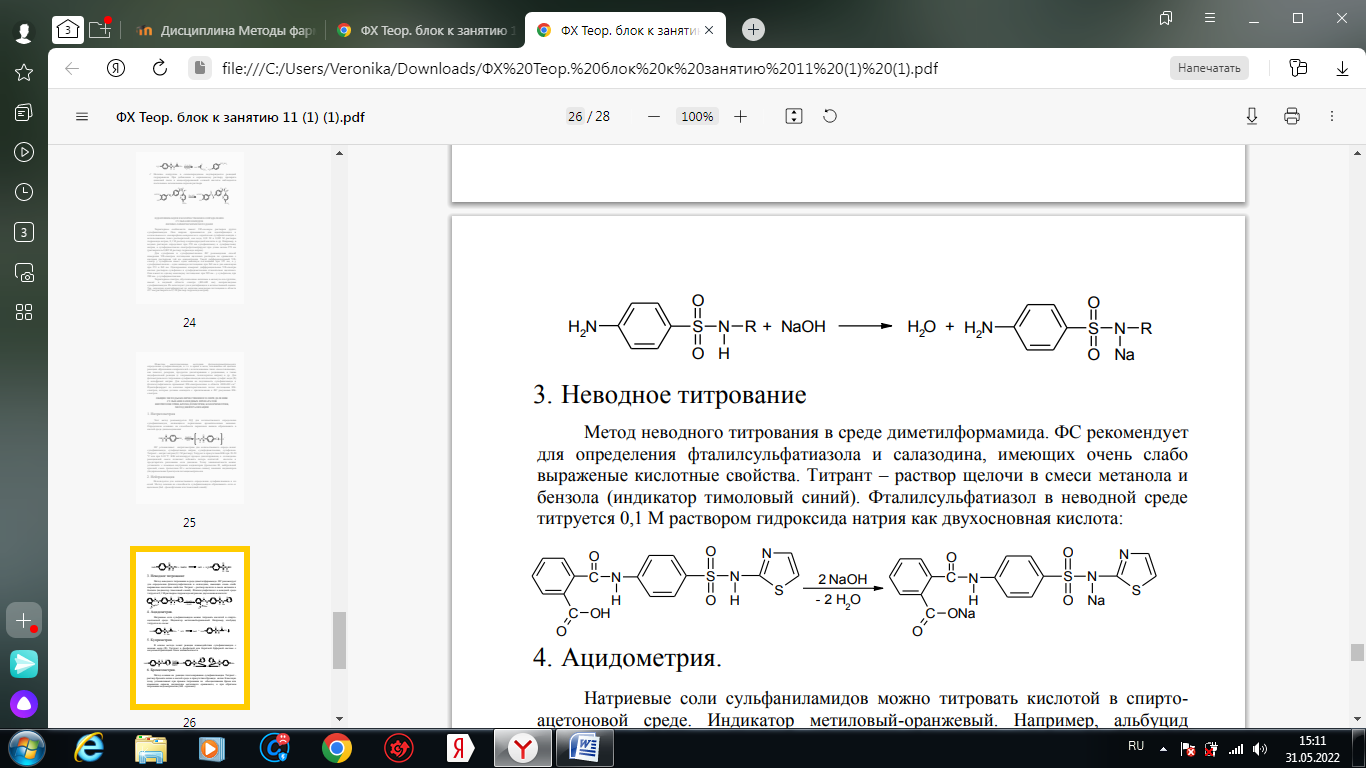 3. Неводное титрование Метод неводного титрования в среде диметилформамида. ФС рекомендует для определения фталилсульфатиазола и салазодина, имеющих очень слабо выраженые кислотные свойства. Титрант – раствор щелочи в смеси метанола и бензола (индикатор тимоловый синий). Фталилсульфатиазол в неводной среде титруется 0,1 М раствором гидроксида натрия как двухосновная кислота: 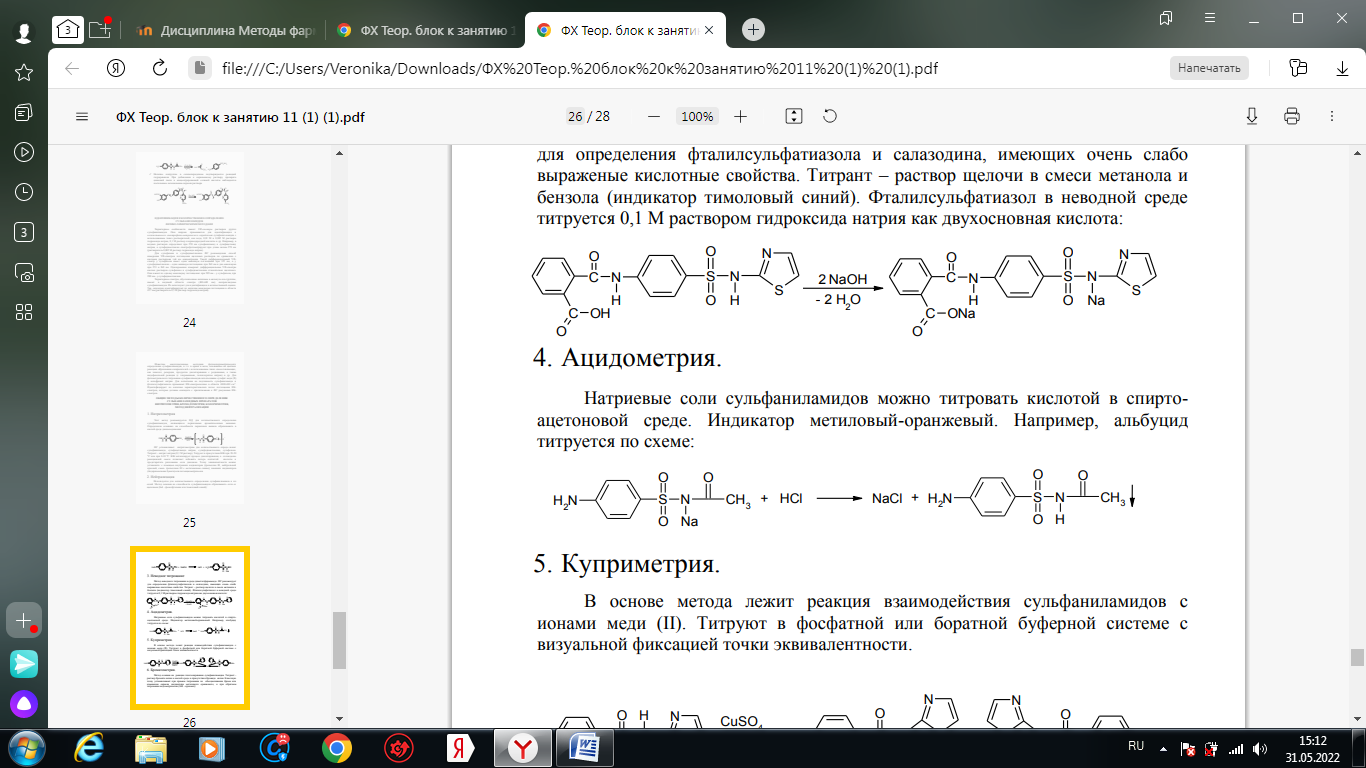 4. Ацидометрия. Натриевые соли сульфаниламидов можно титровать кислотой в спиртоацетоновой среде. Индикатор метиловый-оранжевый. Например, альбуцид титруется по схеме: 5. Куприметрия. В основе метода лежит реакция взаимодействия сульфаниламидов с ионами меди (II). Титруют в фосфатной или боратной буферной системе с визуальной фиксацией точки эквивалентности. 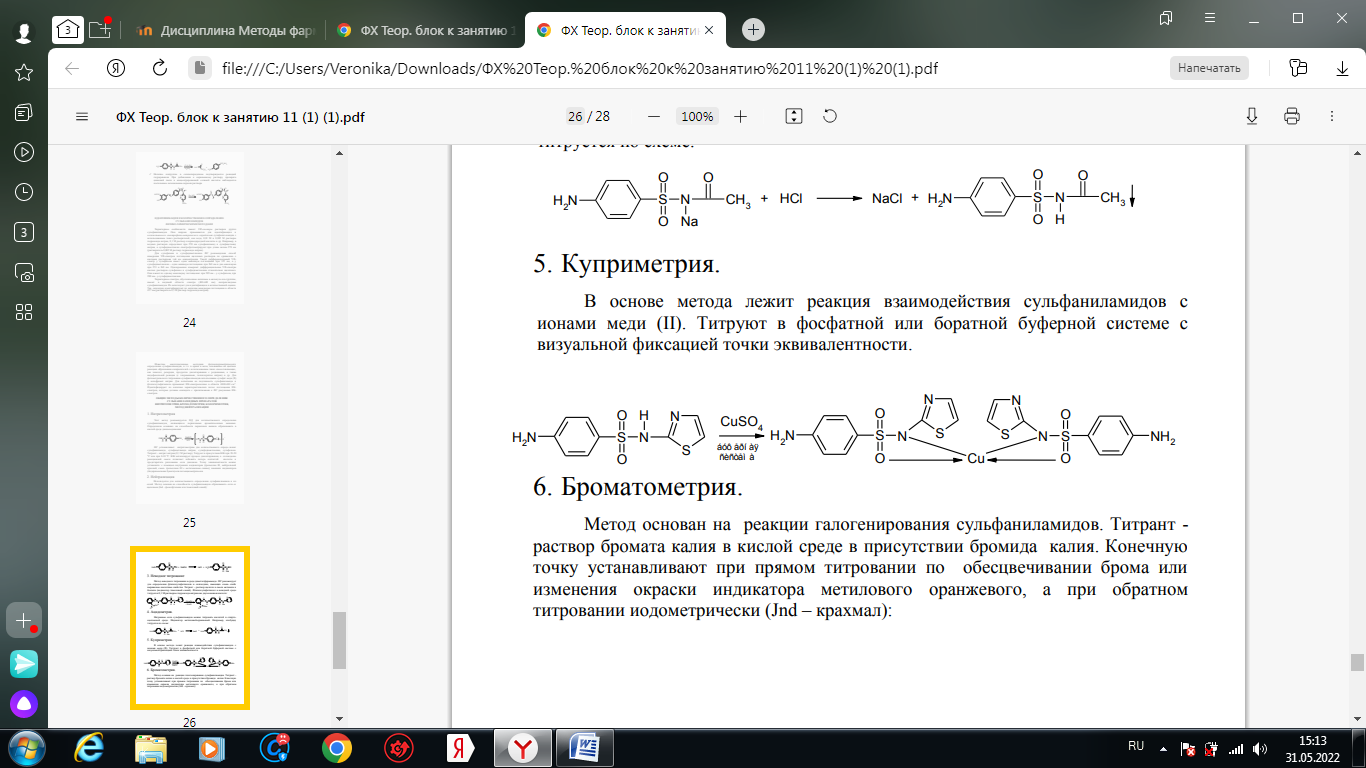 6. Броматометрия. Метод основан на реакции галогенирования сульфаниламидов. Титрант - раствор бромата калия в кислой среде в присутствии бромида калия. Конечную точку устанавливают при прямом титровании по обесцвечивании брома или изменения окраски индикатора метилового оранжевого, а при обратном титровании иодометрически (Jnd – крахмал): 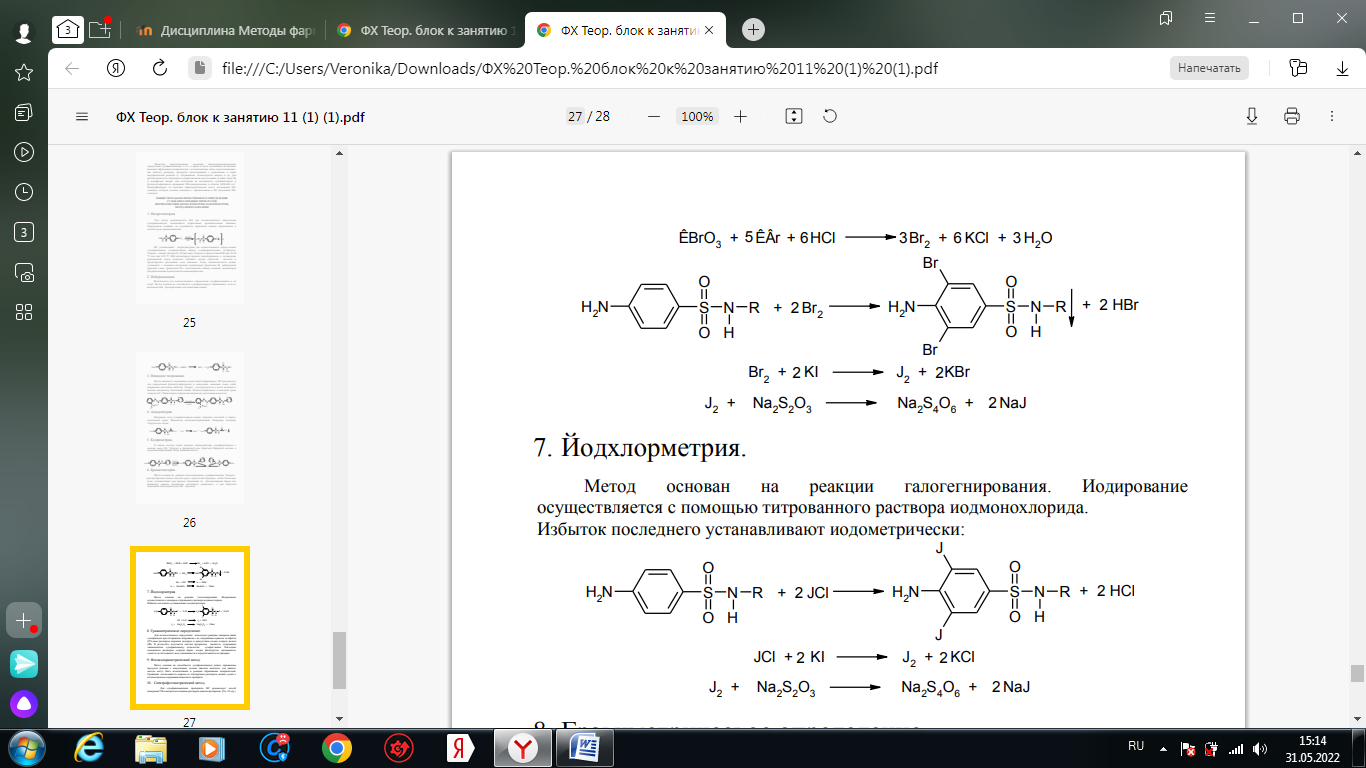 7. Йодхлорметрия. Метод основан на реакции галогегнирования. Иодирование осуществляется с помощью титрованного раствора иодмонохлорида. Избыток последнего устанавливают иодометрически:  8. Гравиметрическое определение. Для количественного определения используют реакцию минерали-зации сульфамидов при осторожном нагревании с не содержащим примеси сульфатов 30%-ным раствором перекиси водорода в присутствии следов хлорида железа (III). В результате получается светлая прозрачная жидкость, содержащая эквивалентное сульфаниламиду количество сульфат-ионов. Последние осаждаются раствором хлорида бария, осадок фильтруется, промывается, сушится до постоянного веса, взвешивается и пересчитывается на препарат. 9. Фотоколориметрический метод. Метод основан на способности сульфаниламидов давать окрашенные продукты реакции с альдегидами, солями тяжелых металлов; для данного метода могут быть использованы и реакции образования азокрасителей. Сравнивая интенсивность окраски со стандартным раствором, можно судить о количественном содержании вещества в препарате. 10. Спектрофотометрический метод. Для сульфаниламидных препаратов ФС рекомендует способ измерения УФ-спектров поглощения растворов данных препаратов. |
