Контрольная работа по токсикологии. 1. Методы химикотоксикологического анализа, их классификация, общая характеристика
 Скачать 442.54 Kb. Скачать 442.54 Kb.
|
    1.Методы химико-токсикологического анализа, их классификация, общая характеристика. Наиболее сложными объектами химико-токсикологического анализа являются различного рода биологический материал и главным образом материал животного происхождения: внутренние органы и ткани трупа человека, моча, кровь, пищевые продукты и т. п. Именно при исследовании этих объектов особенно наглядно проявляется специфика химико-токсикологического анализа. Методы, применяемые в токсикологической химии, поэтому и рассматриваются на примерах анализа этих наиболее сложных объектов. Методы ХТА включают: 1) изолирование ядовитых и сильнодействующих веществ из биологического материала; 2) очистку выделенных из биологического материала веществ; 3) качественное обнаружение ; 4) количественное определение выделенных соединений. Способы изолирования имеют очень большое значение в токсикологической химии. В зависимости от природы и свойств химических веществ, относимых токсикологией к числу ядовитых, в токсикологической химии для выделения веществ органической природы применяют: · изолирование дистилляцией с водяным паром; · изолирование подкисленным 96° или 70° этиловым спиртом (алкалоиды, ряд синтетических веществ, гликозиды); · изолирование подкисленной водой (алкалоиды, синтетические лекарственные вещества и др.); · изолирование подщелоченной водой (некоторые органические кислоты, вещества феиольного характера); · изолирование различными органическими растворителями · (остаточные количества пестицидов и др.). Для изолирования веществ неорганической природы используются: · минерализация (соединения металлов и мышьяка); · диализ (кислоты, щелочи, соли некоторых ядовитых кислот) ; · озоление (фториды, кремнефтористые соединения). Методы очистки. Изолированное из биологических объектов. химическое вещество в подавляющем большинстве случаев представляет собой неоднородную смесь и непригодно для дальнейшего качественного и количественного анализа, особенно с применением таких физико-химических методов, как микрокристаллоскопия и оптические методы анализа. В то же время физико-химические методы анализа находят все более широкое применение в токсикологической химии и являются чрезвычайно перспективными, хотя и требуют сравнительно высокой степени чистоты анализируемого вещества. Для очистки выделенных из биологического материала химических соединений в токсикологической химии применяются: · возгонка и перекристаллизация; · экстракция и реэкстракция; · различные виды хроматографии и особенно хроматография: в тонком закрепленном слое сорбента. Наряду с другими достоинствами преимущество хроматографии в тонком слое заключается и в том, что она позволяет не только отделить (и разделить) искомые соединения от сопровождающих веществ (очистить вещество), но и способствует более полноценному обнаружению искомых веществ. Хроматография в тонком слое находит широкое применение в токсикологическом анализе барбитуратов, алкалоидов, различных лекарственных веществ, гликозидов, элементоорганических соединений и т. д. Газожидкостная хроматография нашла применение в анализе так называемых летучих ядов (спирты - этиловый, метиловый и др., ацетальдегид, некоторые галогенопроизводные). Методы качественного обнаружения. От качественных реакций, применяемых в токсикологической химии, требуется достаточно высокая чувствительность, характеризуемая открываемым минимумом и предельной концентрацией (или границей обнаружения), специфичность и доказательность. Для обнаружения ядовитых и сильнодействующих веществ не потеряли еще значения классические реакции качественного макроанализа, хотя они далеко не всегда удовлетворяют из-за недостаточной чувствительности (известно, что в классическом макрохимическом анализе работают с количествами вещества от 0,1 до 1 г) и необходимости работать с большими объемами растворов (1 -100 мл). Гораздо больше для целей токсикологической химии применимы микрохимические методы, например капельный анализ - более чувствительный и более быстрый, микрокристалл о-скопическиий анализ с элементами кристаллооптики, нашедший широкое применение в анализе органических, а также неорганических соединений и представляющий собой одну из разновидностей микрохимического анализа (как известно, при этом работают с количествами вещества от 0,001 - 0,01 г и даже меньше и с объемом 0,01-0,1 мл), а также хроматограф и ческ и й метод. Для идентификации некоторых органических веществ используется, кроме того, их спектральная характеристика. Почти во всех разделах специальной части учебника приводятся наглядные примеры использования микрокристаллоскопии в токсикологической химии. На перспективы применения этого метода к судебно-химиче-скому анализу указывал еще Г, Драгендорф. Более 100 лет назад он писал: «Вполне понимая, что микроскопические исследования находятся еще в младенчестве, мы... предполагаем... что этой отрасли токсикологии предстоит блестящее будущее». И. В. Шиндельмейзер в 1902 г. указывал: «Немало плодотворных результатов ожидается в будущем от применения в судебной химии микрохимии, микрокристаллоскопии, микрофотографии и электрохимии, т. е. методов, теперь применяющихся не в достаточно широком объеме». Надежность и доказательность реакций, возможность представления к заключению микрофотографий или постоянных препаратов кристаллов в качестве доказательства достоверности этого заключения - преимущества, позволяющие говорить о большой ценности микрокристаллических реакций для целей химико-токсикологического анализа. Основанием для идентификации вещества в микрокристаллоскопии обычно являются форма, окраска и размеры кристаллов. Однако воспроизводимость микрокристаллической картины не всегда постоянна и нередко зависит от условий опыта. Поэтому в химико-токсикологическом анализе следует применять только те микрокристаллические реакции, которые проверены на химико-токсикологическом материале и в условиях, близких к условиям производства химико-токсикологического анализа. Большую помощь в применении микрокристаллоскопии оказывает оптическая характеристика микрокристаллов. Успешную работу в этом направлении провела в СССР В. Т. Позднякова (фармацевтический факультет Львовского медицинского института). Она изучила микрокристаллические реакции целого ряда фармацевтических препаратов и ядов и подтвердила, что оптические свойства кристаллов более постоянны, чем их форма, и что эти оптические свойства кристаллов нужно считать важным дополнительным признаком при химико-токсикологических анализах. Для обнаружения отдельных ядовитых веществ в токсикологической химии находит применение полярография и люминесцентный анализ (хинин, алкалоиды тропаыа, спорыньи, секуринин). Отдельные ядовитые вещества в условиях химико-токсикологического анализа не удается надежно обнаружить химическими и физико-химическими методами. Для обнаружения этих веществ (стрихнин, атропин и гиосциамин, никотин) в дополнение к химическим методам анализа применяются и биологические методы (исследование на животных). Совпадение результатов химического и биологического исследований позволяет с надежностью делать заключение об обнаружении или необнаружении того или иного ядовитого вещества. Методы количественного определения. Количественному определению найденных химико-токсикологическим анализом веществ придается очень большое значение. В отдельных случаях только количественное определение в сочетании с результатами качественного анализа позволяет врачу или (при судебно-хими-ческих исследованиях) судебно-следственным органам делать заключение о том, что найденное химическим анализом вещество являлось ядом. Количественное определение найденных при химико-токсикологических исследованиях веществ является поэтому совершенно обязательным. Наряду с классическими аналитическими методами (весовыми, объемными) в настоящее время в токсикологической химии начали применяться методы комплексонометрического титрования. Особенно перспективными методами определения являются оптические методы анализа: колориметрия, фотоэлектроколориметрия и спектрофотометрия. Оптические методы определения довольно быстры, чувствительны и объективны, в этом их преимущество перед многими химическими методами. К оптическим методам анализа относится и нефелометрия, не получившая широкого применения в токсикологической химии. 2.Характеристика группы веществ, изолируемых полярными растворителями. К этой группе относятся многие органические вещества различной химической природы:
Состояние алкалоидов в растворе: 1)кислые растворы(растворимы в воде и спирте, нерастворимы в органических растворителях) 2)щелочные растворы(нераствориы в воде и спирте, растворимы в органических растворителях) рН органов и тканей = 7-8 подкисление алкалоиды в виде солей соли растворимы в воде и этаноле изолирование можно проводить подкисленной водой и подкисленным спиртом Методы изолирования алкалоидов подкисленным спиртом 1851г. Бельгийский ученый Стас провел исследования биологического материала, применив экстракцию спиртом из кислого раствора (щавелевая, винная кислоты), и доказал наличие никотина. Очистка вытяжки не проводилась. 1856 г. братья Отто предложили обработку полученной вытяжки эфиром (примеси растворяются в эфире). Метод Стаса – Отто 1) измельчение биологического материала 2)настаивание с этанолом, подкисленным щавелевой кислотой 3)Фильтрование 4)фильтрат + диэтиловый эфир 5)эфирный слой(примеси) и водный слой(алкалоиды) 6) водный слой(алкалоиды) +Na2CO3 (NH4ОН) 7)взбалтывают с эфиром; алкалоиды переходят в эфир 8)упаривание эфирных вытяжек Современный модифицированный метод Стаса – Отто:
Из кислых растворов экстрагируются:
Достоинства метода: способность спирта свертывать, переводить в нерастворимое состояние белки – главную составную часть большинства объектов СХИ. Недостатки метода:
Метод извлечения подкисленной водой 1823г.- Лассаль впервые выделил морфин из органов трупа: кипячение с водой, фильтрование, выпаривание. Сухой остаток растворял в спирте. 1856г.- Макадам изолировал алкалоиды водой, подкисленной щавелевой кислотой. 1861г. – Эрдман изолировал алкалоиды водой, подкисленной хлороводородной кислотой. Лучшим из перечисленных является метод извлечения алкалоидов подкисленной водой метод, предложенный Драгендорфом в1865г. Метод Драгендорфа
Недостатки метода:
В 1943г. М.Д.Швайкова и А.В.Степанов для изолирования алкалоидов из объектов растительного происхождения предложили, так называемый «скоростной метод извлечения алкалоидов». Он основан на том, что алкалоиды изолируют водой, подкисленной щавелевой кислотой. Такое изолирование является более точным, чем подкисленным спиртом. В 1949г. этот метод был предложен А.А.Васильевой для экстрагирования алкалоидов из свежих внутренних органов трупа, после чего он вошел в практику СХА в лабораториях. Суть метода Васильевой А.А.: 1)100г трупного материала измельчают 2)заливают 200 мл дист. воды 3)подкисление 10% р-ром щавелевой кислоты до рН <7 на лакмус 4)2 часа настаивают при частом взбалтывании 5)процеживают через марлю 6)остаток на марле несколько раз промывают водой 7)промывные воды объединяют и 3-4 раза извлекают токсические вещества эфиром вначале из кислого, а затем из щелочного хлороформом 8)анализируют вытяжки из кислого, а затем из щелочного р-ра Достоинства метода:
Недостатки метода: образование стойкой эмульсии при извлечении хлороформом. Во избежание образования стойкой эмульсии к водному извлечению добавляют растертый хлорид натрия до насыщения, этиловый и амиловый спирт (до 2 мл) и другие приемы. Для разрушения эмульсий применяют центрифугирование. 5.Общий метод В.Ф.Крамаренко 1)Извлечение(вода, серная кислота, рН =2,5; 3 раза по 2 часа) процеживают, центрифугируют. 2)Очистка(гнилостный материал) добавляют сульфат аммония до насыщения, центрифугируют 3)+20% NH4OH до рН 4,5 4)Экстракция хлороформом (вещества слабоосновного характера) 5)+20% NaOH до рН 9 6)Экстракция хлороформом(вещества основного характера) 6.Методы очистки извлечений
3.Схема химико-токсикологического исследования на атропин ( изолирование, обнаружение, количественное обнаружение).
Для изолирования атропина из объекта исследования применяют извлечение либо спиртом, подкисленным винной или щавелевой кислотой, либо подкисленной водой при рН = 2,5—3,0, а затем экстрагирование органическим растворителем (хлороформ, дихлорэтан) при рН = 9,5—11,5. Остатки, полученные после испарения органического растворителя, исследуют: 1) в присутствии 1% HCl так называемыми общеалкалоидными реактивами (растворы J2 в KJ, HgJ2 в КJ и др.); образуются аморфные осадки; 2) Реакции с реактивами группового осаждения алкалоидов Реакция переведения атропина в полинитропроизводное и доказательство последнего (реакция Витали – Морена) В фарфоровую чашку вносят несколько капель хлороформного раствора исследуемого вещества и при комнатной температуре выпаривают досуха. К сухому остатку прибавляют 1 мл концентрированной азотной кислоты, жидкость на кипящей водяной бане выпаривают досуха. При этом сухой остаток приобретает жёлтую окраску. К сухому остатку с одной стороны прибавляют 3 – 5 капель ацетона, а с другой 1 – 2 капли 10% спиртового раствора калия гидроксида. При соприкосновении указанных растворов с сухим остатком появляется быстроисчезающая фиолетовая окраска. Реакция неспецифична. Открываемый минимум 1 мкг. 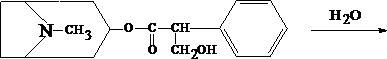 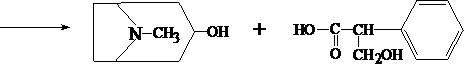 тропин троповая кислота 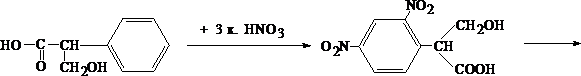 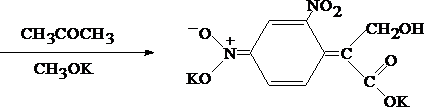 1.2. Гидроксамовая проба К сухому остатку (после испарения хлороформа) добавляют едкий натр до рН = 11, затем добавляют гидроксиламин и доводят рН до 1, с помощью концентрированной хлороводородной кислоты, и прибавляют 2 – 3 капли раствора железа (III) хлорида. Наблюдают красное окрашивание. Реакция неспецифична. 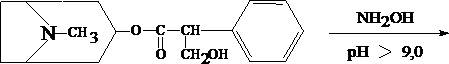 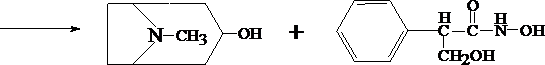 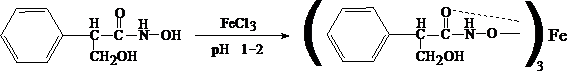 1.3. Реакция с п–диметиламинобензальдегидом и кислотой серной К 2 –3 каплям исследуемого раствора прибавляют 3 – 5 капель 0,5% раствора п–диметиламинобензальдегида в концентрированной серной кислоте. Жидкость взбалтывают, а затем нагревают на кипящей водяной бане 5 – 10 мин. При наличии атропина появляется красная окраска, переходящая в вишнёво–красную, а затем и фиолетовую. Реакция неспецифична. При положительных результатах этой чувствительной [1 мкг, по Гадамеру (J. Gadamer)], но неспецифической реакции проводят физиологическое испытание на животном (кошка).Для этого часть остатка растворяют в 2—3 каплях 1% HCl, испаряют без нагревания, обрабатывают несколькими каплями воды и при помощи глазной пипетки наносят на слизистую оболочку глаза кошки; через некоторое время наблюдается расширение зрачка. Другой глаз животного служит контролем. Микрокристаллические реакции на атропин 1. Реакция с солью Рейнеке Сухой остаток исследуемого вещества растворяют в капле 0,1 моль/л раствора хлороводородной кислоты и соединяют на предметном стекле с каплей свежеприготовленного 1% раствора соли Рейнеке, выделяется аморфный сиреневого цвета осадок, быстро кристаллизующийся при стоянии. Образование сростков кристаллов с ромбовидными концами указывает на наличие атропина в пробе. Открываемый минимум 0,1 мкг. 2. Реакция с пикриновой кислотой Сухой остаток исследуемого вещества на предметном стекле растворяют в капле 0,1 моль/л раствора хлороводородной кислоты и соединяют с каплей 0,5% раствора пикриновой кислоты. При наличии атропина через 15 – 20 мин образуются тонкие пластинки пикрата атропина светло–жёлтого цвета, отдельные и собранные в сростки. Открываемый минимум 5 мкг. 3. Реакция с бромной водой Остаток исследуемого вещества обрабатывают каплей 0,1 моль/л раствора хлороводородной кислоты и каплей насыщенного раствора брома. В ту же минуту выделяется осадок, состоящий из жёлтых и красно–бурых кристаллов рисообразной и игольчатой формы. При стоянии препаратов кристаллы растворяются. Открываемый минимум 0,016 мкг. При отравлениях частями растений помощь судебно-химическому анализу на атропин оказывает судебно-фармакогностическое исследование. реакции идентификации атропина
Скополамин и атропин можно отличить друг от друга при, помощи реакции образования бромаурата скополамина, а также при помощи метода хроматографии и на основании спектров в ИК-области. Количественное определение 1. Ацидиметрия в неводной среде. Точку эквивалентности определяют потенциометрически: 2. Алкалиметрия в спирто-хлороформной среде. 3. Фотоколориметрия (по реакции с пикриновой кислотой) в растворе для инъекций. Обнаружение атропина методом хроматографии Для обнаружения атропина методом хроматографии в тонком слое силикагеля используется та же методика, которая применяется для обнаружения кодеина. Пятна атропина на хроматографической пластинке имеют розовато-бурую окраску (Rf = 0,26 ± 0,01). Обнаружение атропина по УФ- и ИК-спектрам. Атропин в 0,1 н. растворе серной кислоты имеет максимумы поглощения при 252, 258 и 264 нм; в ИК-области спектра основание атропина (диск с бромидом калия) имеет основные пики при 1720, 1035 и 1153 см -1. Токсикология Применяется как средство, расширяющее зрачок, спазмолитическое при бронхиальной астме, спастических колитах. При отравлении − сильное возбуждение, галлюцинации, беготня, смех. Смертельная доза 0,1 г. Выводится с мочой (около 50% в неизмененном виде). Разлагается на тропин и троповую кислоту. 4.Количественное определение барбамила. Барбамил (амитал-натрий, амобарбитал-натрий, амилобарбитал-натрий) — 5-изоамил-5-этилбарбитурат натрия — белый аморфный гигроскопический порошок без запаха. Хорошо растворяется в воде и этиловом спирте, практически нерастворим в диэтиловом эфире, экстрагируется органическими растворителями из кислых водных растворов. Для количественного определения барбитуратов, выделенных из биологического материала, применяют фотоколориметрические и спектрофотометрические методы. Один из фотоколориметрических методов количественного определения барбитуратов, разработанный В. И. Поповой, приводится ниже. Сухие остатки барбитуратов, выделенных из биологического материала методом изолирования этих веществ водой, подкисленной серной кислотой, в зависимости от исследуемого барбитурата растворяют в хлороформе или в метиловом спирте. Сухие остатки барбитала, гексенала, фенобарбитала и циклобарбитала растворяют в 6 мл хлороформа, а сухие остатки барбамила и этаминала — в 2 мл метилового спирта. Объемы растворов барбамила и этаминала в метиловом спирте доводят хлороформом до 6 мл. К полученным растворам барбитуратов прибавляют по 5 мл 0,125 %-го раствора ацетата кобальта в метиловом спирте и по 1 мл 50 %-го раствора изопропиламина в метиловом спирте. Оптическую плотность окрашенных в фиолетовый цвет растворов измеряют при помощи фотоэлектроколориметра ФЭК-М (светофильтр зеленый, кювета 20 мм) или с помощью другой марки фотоэлектроколориметра. В качестве раствора сравнения применяют смесь перечисленных выше реактивов. 1)Обнаружение барбамила по УФ-и ИК-спектрам. Способ обнаружения барбамила по светопоглощению в УФ-области спектра описан выше В ИК-области спектра барбамил (диск с бромидом калия) имеет основные пики при 1716, 1689 и 1745 см -1. 2) Обнаружение барбамила методом хроматографии. На хроматографической пластинке (9X12 см), покрытой тонким слоем силикагеля, закрепленным гипсом, отмечают линию старта, на которую наносят каплю хлороформной вытяжки из кислого раствора, а правее на расстоянии 2 см от нее наносят каплю раствора «свидетеля» (0,01 %-й раствор препарата в метиловом спирте). Пятна на пластинке подсушивают на воздухе, а затем пластинку помещают в камеру для хроматографирования, насыщенную парами растворителей (хлороформ- н -бутанол-25 %-й раствор аммиака в соотношении 70 : 40 : 5). Когда фронт растворителей поднимется на 10 см выше линии старта, пластинку вынимают из камеры, подсушивают и опрыскивают 0,02 %-м хлороформным раствором дифенилкарбазида, затем раствором сульфата ртути. При наличии барбамила пятна на хроматограмме приобретают сине-фиолетовую или красно-фиолетовую окраску. 3) Ацидиметрия в водной среде. Около 0,5 г препарата (точная навеска) растворяют в 30 мл свежепрокипяченной и охлажденной воды и титруют 0,1 н. раствором соляной кислоты до появления розового окрашивания (индикатор - метиловый оранжевый). мл 0,1 н. раствора соляной кислоты соответствует 0,02483 г C11H17N2Na03. При наличии в препарате свободной щелочи из найденного процентного содержания барбамила вычитают процентное содержание свободной щелочи, умноженное на коэффициент 6,21. Содержание C11H17N2Na03в пересчете на сухое вещество должно быть не менее 99,0 % хранение. Na-соли барбитуратов способны гидролизовать в водных растворах, образуя щелочную среду и поэтому их можно оттитровать кислотами в присутствии метилового оранжевого или метилового красного.Em=М.м 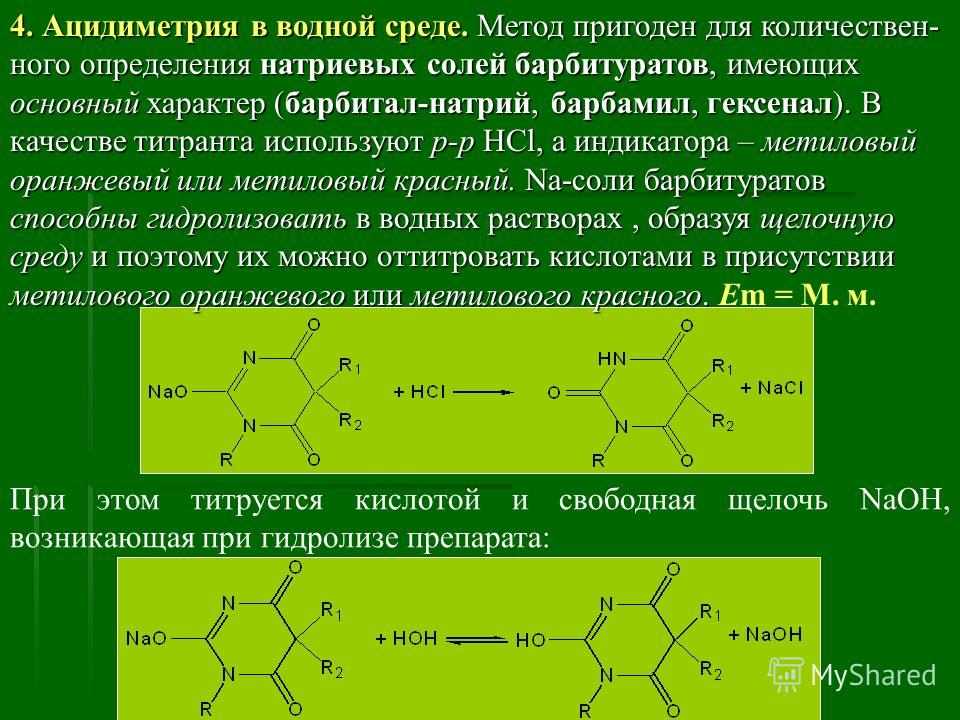 При этом титруется кислотой и свободная щелочь NaOH, возникающая при гидролизе препарата: Поэтому содержание Na-соли барбитурата (X,%) рассчитывают по формуле: 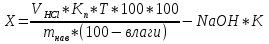 где: % NaOH -содержание свободной щелочи в веществе, в %; K- коэффициент, который рассчитывают как соотношение между молярными массами соли и натрий гидроксида NaOH. 5.Реакции и методы обнаружения скополамина, используемые в химико-токсикологическом анализе. Скополамин- сложный эфир спирта скопина и троповой кислоты. Оптимальные условия экстракции: рН 8 – 10, хлороформ.  Качественное обнаружение: 1. С общеалкалоидными реактивами (раствором пикриновой кислоты, раствором йода, реактивами Марки, Драгендорфа и др.). 2. Реакция Витали-Морена. Реакция основана на гидролизе препаратов и нитровании выделившихся кислот (при выпаривании с концентрированной азотной кислотой). При действии на остаток после выпаривания спиртовым раствором гидроксида калия и ацетона происходит образование окрашенного в фиолетовый цвет соединения хиноидной структуры.  3. С солью Рейнеке (NH4)[Cr(SCN)4(NH3)2]. Сухой остаток исследуемого вещества растворяют в капле 0,1 моль/л раствора хлороводородной кислоты и соединяют на предметном стекле с каплей свежеприготовленного 1% раствора соли Рейнеке, выделяется аморфный сиреневого цвета осадок, быстро кристаллизующийся при стоянии. Образование сростков кристаллов с ромбовидными концами указывает на наличие вещества в пробе. Открываемый минимум 0,1 мкг. 4.Реакция с золотобромистоводородной кислотой. Несколько капель хлороформного раствора исследуемого вещества наносят на предметное стекло и выпаривают досуха. К сухому остатку прибавляют каплю 0,1 н. раствора соляной кислоты и каплю реактива (смесь равных объемов 5 %-го раствора золотохлористо-водородной кислоты, концентрированной соляной кислоты и ацетона). После этого к жидкости прибавляют 3—4 кристаллика бромида калия. При наличии скополамина в исследуемом растворе образуются светло-коричневые, желтые или оранжево-красные кристаллы (зубчатые дендриты). Предел обнаружения: 1 мкг скополамина в пробе. Отличие от атропина. Количественное определение: Обнаружение скополамина методом хроматографии. Для обнаружения скополамина применяют метод хроматографии в тонком слое силикагеля. Обнаружение скополамина этим методом производят так, как и обнаружение кодеина. Пятна скополамина на хроматограмме имеют розовато-бурую окраску (Rf=0,44±0,01). Обнаружение скополамина по УФ- и ИК-спектрам. Основание скополамина в 0,1 н. растворе серной кислоты имеет максимумы поглощения при 251, 257 и 263 нм; в ИК-области спектра основание скополамина (диск с бромидом калия) имеет основные пики при 1725, 1041, 1165 и 1060 см -1. Титриметрический метод.Около 0,2 г высушенного при 100-105° до постоянного веса препарата (точная навеска) растворяют в 10 мл безводной уксусной кислоты, слегка нагревая на водяной бане. Раствор охлаждают, прибавляют 5 мл раствора ацетата окисной ртути и титруют 0.1 н. раствором хлорной кислоты до голубовато-зеленого окрашивания (индикатор - кристаллический фиолетовый). Параллельно проводят контрольный опыт. 1 мл 0,1 н. раствора хлорной кислоты соответствует 0.03843 г C17H21NO4 • HBr , которого в высушенном препарате должно быть не менее 98,5%. 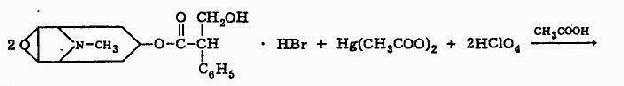  6.Химико-токсикологическое исследование биоматериала на присутствие хинина. Ответ: Хинин (3-винилхинуклидил(5)-6`метоксихинолил(4`)) – производное хинолина. Структурная формула имеет вид  Токсикологическое действие. При попадании в организм хинин вызывает изменение состояние ЦНС и сердечно-сосудистой системы. Токсическое действие хинина проявляется в сильной головной боли, шуме в ушах, поносе, кожных высыпаниях, расстройстве слуха и зрения вплоть до полной слепоты. Вследствие перегрузки печеночных клеток желчным пигментом (непрямой билирубин), хинин вызывает гемолитический криз и желтуху. Хинин обладает кардиотоксическим действие в дозе 2 г и более. Он вызывает экстрасистолию и коллаптоидное состояние. При остром отравлении хинином появляются симптомы расстройства функции желудочно-кишечного тракта, нарушение зрения, поражение сердечно-сосудистой системы. Смерть наступает за счет кардиотоксического действия или угнетения дыханя. Метаболизм. В первой фазе метаболизма проходят реакции окисления и гидроксилирования. Во второй фазе образуются глюкурониды с продуктами окисления хинина за счет карбоксильных групп (хинетин и гемохинная кислота) и гидроксильных групп.  Изолирование. Все методы изолирования обязательно включают следующие стадии: - экстракции яда из биоматериала – получение вытяжки из биоматериала. Для получения вытяжек из биоматериала используют полярные растворители: воду и этиловый спирт. Изолирование хинина из биологического материала производится подкисленным спиртом или подкисленной водой. - очистки вытяжки из биоматериала: процеживание для очистки от частичек биоматериалаи центрифугирование. - экстракции яда из вытяжки из биоматериала в органический растворитель. Для экстракции ядов из вытяжек используют малополярные органические растворители. Как вещество основного характера хинин экстрагируется хлороформом из растворов с рН = 10-12. Качественный анализ. При проведении ТСХ-скрининга хинин обнаруживается на хроматографической пластинке в виде светящихся пятен голубого цвета при обработке раствором серной кислоты и УФ-облучении. Для обнаружения хинина используют: а) Хроматографию в тонком слое сорбента. Сорбент – силикагель СК, система растворителей хлорофрм – диоксан – ацетон – 25% раствор аммиака (45:47,5:5:2,5). Фронт пробега 10 см. После хроматографирования пластинку опрыскивают 10% раствором серной кислоты. При просматриванни обработанной пластинки в УФ-лучах отмечают светящиеся голубым светом пятна. Затем пластинку обрабатывают реактивом Драгендорфа. Места светящихся пятен окрашиваются в оранжевый цвет. Rf хинина равно 0,25±0,01.Цвет пятен и значение Rf должны быть одинаковыми у «стандарта» и извлечения из объекта. б)ИК-спектроскопию. Очищенный остаток после испарения экстракта растирают с кристаллами бромида калия, прессуют и полученный диск помещают в прибор. В спектре обнаруживают характерные для основания хинина пики с волновыми числами 1235, 1510, 1030 и 1619 см-1. в) УФ-спектрофотометрию. При наличии хинина в очищенном извлечении и при растворении его в этиловом спирте обнаруживают максимумы светопоглощения при 236, 278 и 332 нм, в 0,1 М растворе серной кислоты – при 250, 316 и 346 нм. г) Реакцию образования эритрохина. При действии бромной воды хинин окисляется до 5,8-хинолинхинона, который при взаимодействии с неокисленным хинином образует эритрохин через 5 и 7 углеродные атомы. Наблюдается розовое или красно-фиолетовое окрашивание. Эта реакция очень чувствительна, однако окраска быстро исчезает.  д) Реакцию образования талейохина. При добавлении бромной воды происходит окисление и галогенировании хинолинового кольца, при этом образуется 4,4-дибром-6-оксохинолинпроизводное, которое в дальнейшем подвергается гидратации и изомеризации. В результате получается оксоноловый краситель зеленого цвета.   Количественный анализ. Для количественного определения хинина в извлечениях из объекта используют ВЭЖХ (метод добавок, методы внешнего и внутреннего стандартов) и люминесцентный анализ. Люминесцентный анализ. Используют способность хинина флуоресцировать при облучении его сернокислых растворов УФ-лучами при длине волны 254 нм. Часть очищенного хлороформного экстракта выпаривают досуха, очищают с помощью ТСХ и хинин с пластинки элюируют 10% раствором серной кислоты. Интенсивность флуоресценции проводят, используя калибровочный график. Оба метода определения хинина отличаются высокой чувствительностью. 7.Какие виды хроматографии применяются в химико-токсикологическом анализе? Хроматография [гр. сhrömatos − цвет graphö − пишу] — метод разделения, анализа и физико-химических исследований веществ, основанный на перемещении зоны вещества вдоль слоя сорбента в потоке подвижной фазы с многократным повторением сорбционных и десорбционных актов. При этом разделяемые вещества распределяются между двумя несмешивающимися фазами (в зависимости от их относительной растворимости в каждой фазе): подвижной и неподвижной. Сущность метода заключается в различной скорости перемещения веществ некоторой анализируемой смеси вдоль слоя сорбента (неподвижной фазы – НФ) в потоке элюента (подвижной фазы – ПФ). Скорость перемещения веществ связана с различным распределением разделяемых веществ между двумя фазами из-за неодинакового взаимодействия с ними. В результате исходная смесь разделяется на слои, содержащие более или менее чистые вещества, которые могут быть проанализированы. Разнообразие хроматографических методов приводит к необходимости их классифицировать. В зависимости от выполняемых задач хроматография бывает: · аналитической, когда производится исследование физико-химических характеристик веществ при использовании хроматографической аппаратуры и на основании параметров хроматографических зон; · препаративной, используемой для выделения небольших количеств чистых компонентов в лабораторных условиях; · промышленной, применяемой для получения чистых веществ в значительных количествах. По агрегатному состоянию фаз различают жидкостную (подвижной фазой является жидкость, разделение веществ производится в потоке жидкого элюента (н-гексан, диметилформамид, ацетонитрил и т.д.)) и газовую (подвижной фазой является газ. производится разделение и анализ газообразных веществ в потоке элюента-газа (водород, гелий, азот)) хроматографию. По механизму разделения различают методы: сорбционные, которые основаны на законах распределения (адсорбционная, распределительная, ионообменная хроматография и др.), гельфильтрационные (проникающая хроматография), которые основаны на различии в размерах молекул разделяемых веществ. На практике часто реализуются одновременно несколько механизмов разделения. По способу перемещения подвижной фазы и хроматографируемой смеси различают фронтальную и элюентную хроматографию. При непрерывном введении в хроматографическую колонку растворенной смеси в чистом виде выделяется только одно, наиболее слабосорбирующееся вещество. Остальные вещества выходят из колонки в виде смеси. Этот метод называют фронтальной хроматографией. В методе элюентной хроматографии через колонку пропускают подвижную фазу (элюент),вводят пробу и снова пропускают подвижную фазу. В процессе движения по колонке компоненты смеси расчленяются на зоны. Эти зоны разделены зонами чистого растворителя и выходят из колонки поочередно. По аппаратурному оформлению процесса хроматографию подразделяют на колоночную, когда разделение веществ проводится в специальных колонках, и плоскостную: тонкослойную и бумажную. В тонкослойной хроматографии разделение проводится в тонком слое сорбента, в бумажной- на специальной бумаге. На практике обычно пользуются классификацией по применяемым фазам или по механизмам. Классификация по применяемой технике скорее указывает на технику эксперимента и позволяет получить дополнительную информацию об используемом методе. Среди специальных методов различают хроматографию с программированием температуры, с программированием потока, с высаливанием, селективное, ступенчатое и градиентное элюирование, двухмерную хроматографию, хроматографию с обращенными фазами. Высокоэффективные жидкостная (ВЭЖХ) и тонкослойная хроматографии (ВЭТСХ), согласно изложенным типам классификации, формально относятся к новым типам разделения. Тем не менее, необходимо отметить, что ВЭЖХ и ВЭТСХ, являясь современными формами реализации классических методов, не только улучшают эти варианты, но и представляют собой качественно новый уровень хроматографического разделения, что и позволяет выделить их в специальные методы. Метод ТСХ (являющийся предварительным) предполагает разделение веществ в общих системах растворителей на хроматографические зоны. Каждая зона, в которой были обнаружены те или иные соединения, затем исследуется в частных системах растворителей или анализируется с последующим элюированием веществ методом ГЖХ (являющимся подтверждающим). ГЖХ - один из наиболее распространенных методов, применяемых в судебной химии для анализа отравляющих веществ, обладающий высокой чувствительностью и надежностью определения искомых веществ в биологическом материале. Для определения "летучих ядов" (спиртов - метилового, этилового, пропилового, бутилового, амилового спиртов и их изомеров; хлорорганических соединений, ароматических углеводородов, альдегидов и кетонов, углеводородов, входящих в состав бензина и керосина) в биологических объектах применяются аналитические колонки с неподвижными жидкими фазами различной полярности (трикрезилфосфат, реоплекс-400, сквалан, ПЭГ-600), нанесенные на инертные носители в количестве 10-15%. ГЖХ нашла свое применение в анализе лекарственных веществ в качестве скринингового метода благодаря своей универсальности. Необходимым условием является переведение исследуемого вещества в летучее состояние. Каждый компонент выходит из колонки на детектор. Наиболее часто используемым в лабораториях детектором является детектор ионизации пламени (ДИП). Другие (реже встречающиеся) детекторы - азотно-фосфорный детектор и детектор захвата электронов (ДЭЗ). По мере того, как каждый компонент проходит через детектор, подается сигнал, результатом которого является пик на хроматограмме, полученной с помощью записывающего устройства. Список использованной литературы 1. Токсикологическая химия. Метаболизм и анализ токсикантов. Под ред Н.И. Калетиной. – М.: Геотар-Медиа, 2015.-1016 с. 2. Токсикологическая химия. Под ред. Т.В. Плетневой. - М.: Геотар-Медиа, 2016.- 512 с 3. Токсикологическая химия. Ситуационные задачи и упражнения. Под ред. Т.В. Плетневой. - М.: Геотар-Медиа, 2017.- 352 с 4. Лужников Е. А. Клиническая токсикология.—М.: МИА, 2014.—576 с. 5. Граник В.Г. Токсикология лекарств.-М.: Вузовская книга, 2014.-428с. 6. Общая токсикология. Под ред. Б. А. Курляндского, В. А. Филова. –М.:Медицина, 2016.-729с. 7. Жебентяев, А.И. Токсикологическая химия : учебное пособие /А.И. Жебентяев, Н.А. Алексеев. – Витебск : 2015. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
