Отчет по лабораторной работе Разделение и определение меди и цинка при их совместном присутствии
 Скачать 132.48 Kb. Скачать 132.48 Kb.
|
|
Уральский федеральный университет имени первого Президента России Б.Н. Ельцина Физико-технологический институт Кафедра ФХМА Отчет по лабораторной работе: «Разделение и определение меди и цинка при их совместном присутствии» Преподаватель Абрамов А. В. Студенты Уланова О.Д. Попова А.А. Группа Фт-200017 Екатеринбург 2022 Цель работы: Разработать методику для хроматографического разделения цинка и меди, построить кривую элюирования и по полученным данным определить содержание катионов металлов в исследуемом растворе задачи. Реактивы и оборудование: Сульфат меди, 0,05 М раствор Хлорид цинка , 0,05 М раствор Соляная кислота, 0,02; 0,5; 1,0; 2,0 М растворы Трилон Б, 0,05 М титрованный раствор Аммиачный буферный раствор рН = 10 Эриохром черный Т Раствор аммиака 1:1 Хлорид аммония, 0,1 М раствор Мурексид, насыщенный раствор Катионообменник КУ-2-8 воздушно-сухой в Н-форме Теоретическое введение: В основе метода лежит обмен ионами между двумя фазами, одна из которой является неподвижной, в качестве которой выступает неорганический или синтетический органический ионообменник, а другая фаза является подвижной, которую непрерывно пропускают через неподвижную фазу. В соответствии с природой функциональных групп иониты бывают катионообменниками, анионов, и комплексообразующими ионитами, в которых помимо ионной связи происходит образование дополнительной координационной связи с обмениваемым ионом. В данной работе применяется катионит: RH + Mez+⇄ RMe+ H+ Ионный обмен является обратимым, стехиометрическим и эквивалентным процессом. Этот процесс протекает до установления гетерогенного равновесия. Термодинамическая константа равновесия будет иметь вид: где 𝑎 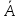 , 𝑎 , 𝑎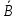 – активности ионов А, В в ионообменнике, 𝑎𝐴, 𝑎𝐵 – активности ионов А, В в растворе. – активности ионов А, В в ионообменнике, 𝑎𝐴, 𝑎𝐵 – активности ионов А, В в растворе.Константа равновесия или константа ионного обмена без учёта коэффициентов активности, имеет вид: Коэффициент распределения компонента А (В): D(𝐴) = 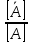 ; D(𝐵) = ; D(𝐵) = 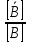 Тогда константа ионного обмена, по существу, представляет собой отношение коэффициентов распределения компонентов А и В. Поэтому эту константу очень часто называют коэффициентом селективности. D (𝐵) α𝐴,𝐵=  D (𝐴) Если αA,B > 1, то это означает, что находящийся в растворе ион В имеет большее сродство к иониту, чем ион А. Поэтому ранее написанное равновесие сдвинуто вправо. Если αA,B < 1, то будет преобладать противоположный процесс. Коэффициент селективности ионного обмена зависит от природы ионита и обмениваемых ионов, от концентрации иона в растворе, рН, комплексообразования, температуры и т.д. Факторами, влияющими на селективность, являются величины заряда иона и его размер. Ионы, имеющие одинаковый заряд, будут сорбироваться ионообменником тем лучше, чем больше радиус иона. При сравнении степени сродства ионов с разными зарядами можно сказать, что с увеличением заряда иона увеличивается и сорбция. С разбавлением раствора увеличивается сорбция ионов с более высоким зарядом. Применение в качестве элюентов комплексообразующих реагентов. Комлексообразование позволяет влиять на состояние разделяемых ионов в растворе так как именно при образовании комплексных соединений проявляются различия в ионных радиусах, строении электронных оболочек. Поэтому переведение ионов металлов в комплексные ионы позволяет значительно увеличить различие в коэффициентах распределения и, тем самым, улучшить разделение близких по свойствам элементов. Ход работы: Часть I. Определение фактора разделения меди и цинка В мерную пробирку вместимостью 25 мл помещаем по 10 мл раствора цинка и меди по отдельности, по 15 мл соляной кислоты соответствующей концентрации (0,02; 0,5; 1,0; 2,0 М) и по 0,20 г воздушно-сухого Катионообменник КУ-2-8 воздушно-сухой в Н-форме. Колбы ставят на механический встряхиватель до достижения состояния равновесия (  1 час). 1 час). Определяем исходную концентрацию солей меди и цинка методом комплексонометрии. Определение проводим в аликвотной части раствора 10 мл (в двух параллельных пробах). После сорбции в аликвотной части раствора 10,0 мл (в двух параллельных пробах) определяем содержание меди и цинка методом комплексонометрии. Комплексонометрическое определение цинка состоит в следующем: к исследуемому раствору прибавляем 50 мл воды, нейтрализуем раствор при помощи аммиака (1:1) до рН = 7-8 по универсальной индикаторной бумаге, затем приливаем 10 мл аммиачного буферного раствора, на кончике шпателя немного индикатора эриохром черного Т, после чего титруем 0,05 М раствором Трилона Б до перехода окраски из фиолетовой в синюю. Комплексонометрическое определение меди состоит в следующем: исследуемый раствор нейтрализуем до рН = 8, для чего добавляют раствор аммиака (1:1) до тех пор, пока от одной капли аммиака не появится голубое окрашивание, затем добавляем 10 мл 1 М раствора хлорида аммония, 8-10 капель насыщенного раствора мурексида и титруют 0,05 М раствором комплексона III до перехода желтой окраски раствора (при высоких содержаниях меди возможна сине-зеленая окраска) в фиолетовую. На основании экспериментальных данных рассчитали коэффициент распределения элементов и построили график зависимости коэффициентов распределения от концентрации соляной кислоты в растворе (с учетом разбавления). Определяем факторы разделения цинка и меди при одинаковых концентрациях соляной кислоты и выбираем условия разделения этих элементов. Результаты расчетов представили в виде таблицы:
D= 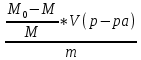
Для цинка: M=CТрБ*V*10-3*МZn*а=0,05*2,3*10-3*65,39* 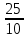 =0,0188г =0,0188гM0=CТрБ*VZn*10-3*МZn =0,05*12,6*10-3*65,39=0,0412г D= 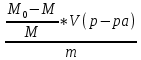 = =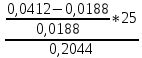 =145,7075 =145,7075Для меди: M=CТрБ*V*10-3*МCu*а=0,05*1,1*10-3*63,55* 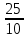 =0,0087г =0,0087гM0=CТрБ*VCu*10-3*МCu =0,05*9,15*10-3*63,55=0,0291г D= 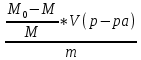 = =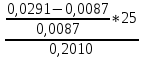 =289,4618 =289,4618Коэффициент селективности: α= 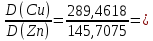 1,9866 1,9866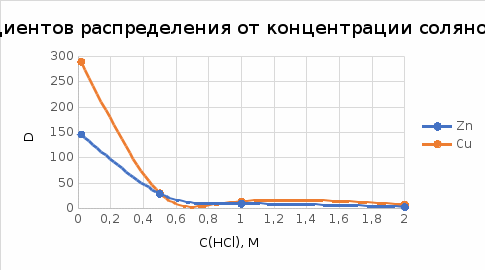 Химизм Для разделения используется различие в сорбируемости на катионите хлоридных комплексов меди (II) и цинка, которые образуются при различных концентрациях соляной кислоты. Концентрация HCl, необходимая для удаления ионов, связана со стабильностью их отрицательно заряженных хлоридных комплексов. Таблица констант образования хлоридных комплексов :
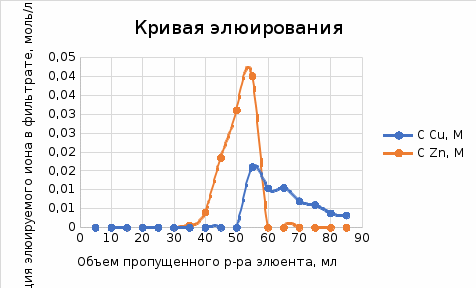
*-нейтральные молекулы в растворе В растворе HCl , ионы цинка образуют устойчивые комплексные частицы [ZnCl2]0, [ZnCl]+ и др., но менее устойчивые. Ионы меди (II) тоже образуют комплексные частицы [CuCl]+, но менее прочные, чем у цинка. Поэтому ионы меди (II) при использовании соляной кислоты с C = 0,02 М в этих условиях практически не образуют комплексных анионов, но образуют катионы, которые сорбируются катионитом. Уменьшение концентрации соляной кислоты приводит к разрушению комплексных анионов, ионы цинка и меди, также их комплексные катионы количественно сорбируются при 0,02 М раствора HCl. Повышение концентрации соляной кислоты приводит к повышению прочности анионного комплекса цинка, и он десорбируется с колонки. Из 1М и 2 М раствора соляной кислоты частично сорбирует только медь, цинк остается в растворе. Мы не можем использовать соляную кислоту C=0,5 М, так как при α =1 разделение соединений невозможно. Только вещества с разными коэффициентами распределения будут перемещаться вдоль колонки с разными скоростями, что и приведет к их хроматографическому разделению. Следовательно, нужно так подобрать подвижную и неподвижную фазы, чтобы D1 ≠ D2. Берём 1М и 2М , потому что чем больше концентрация тем более прочным будет анионный комплекс цинка и он выходит из колонки. Часть II. Построение кривых элюирования Переводим ионообменник в требуемую ионную форму, применяя для этого растворы соответствующих реагентов и воду, которая не содержит удаленных примесей. Через хроматографическую колонку пропускаем анализируемую смесь, состоящую из 5 мл растворов цинка и меди со скоростью  1 капля в 4 секунды. Затем элюируют первый компонент раствором HCl с подходящей концентрацией (условия определили по результатам первой части лабораторной работы). Элюат собираем порциями по 5 мл в мерные цилиндры, и анализируем последовательно отобранные пробы на содержание первого определяемого компонента методом комплексонометрии. Элюирование проводим до полного вымывания компонента из колонки. По полученным данным строим кривую элюирования. 1 капля в 4 секунды. Затем элюируют первый компонент раствором HCl с подходящей концентрацией (условия определили по результатам первой части лабораторной работы). Элюат собираем порциями по 5 мл в мерные цилиндры, и анализируем последовательно отобранные пробы на содержание первого определяемого компонента методом комплексонометрии. Элюирование проводим до полного вымывания компонента из колонки. По полученным данным строим кривую элюирования.После этого меняем элюент или оставляем предыдущий (концентрация HCl выбрана по результатам первой части лабораторной работы), пропускают его через колонку со скоростью 1 капля в секунду, собирая элюат аналогично в мерные цилиндры. Последовательно отобранные аликвотные порции анализируем на содержание второго компонента методом комплексонометрии. Строим кривую элюирования. По кривым элюирования определяем объемы кислот, необходимые для полного элюирования разделяемых ионов. Сначала для элюентной хроматографии использовали соляную кислоту С = 2М, после отделения ионов цинка не меняли элюент.
 Объем комплексона III на титрование холостых растворов: V(Zn)=12,6 мл V(Cu)=9,15 мл Тогда, концентрация меди и цинка в растворах: Cхол= 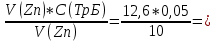 0,063 М 0,063 МCхол= 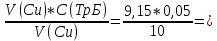 0,04575 М 0,04575 МДля цинка: С(Zn)= 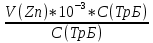 = =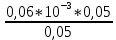 =0,0006 М =0,0006 М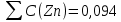 М М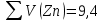 мл млОбъем цинка в растворе: V= 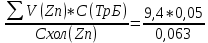 =7,46 мл =7,46 млПогрешность: r= 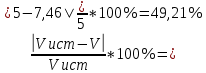 Для меди: С(Cu)= 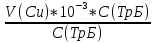 = =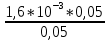 =0,016 М =0,016 М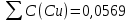 М М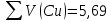 мл млОбъем цинка в растворе: V= 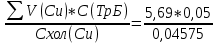 =6,22 мл =6,22 млПогрешность: r= 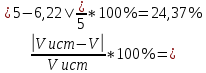 После выбрали 1М соляную кислоту, также не меняя элюент.
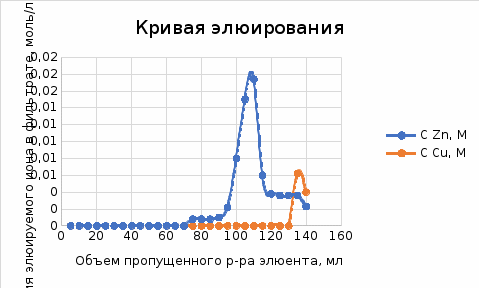 Объем комплексона III на титрование холостых растворов: V(Zn)=13 мл V(Cu)=9,7 мл Тогда, концентрация меди и цинка в растворах: Cхол= 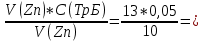 0,065 М 0,065 МCхол= 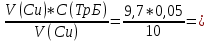 0,0485 М 0,0485 МДля цинка: С(Zn)= 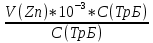 = =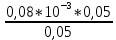 =0,0008 М =0,0008 М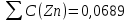 М М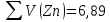 мл млОбъем цинка в растворе: V= 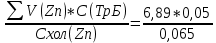 =5,3 мл =5,3 млПогрешность: r= 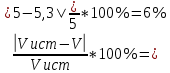 Для меди: С(Cu)= 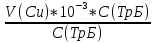 = =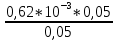 =0,0062 М =0,0062 М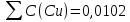 М М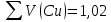 мл млОбъем меди в растворе: V= 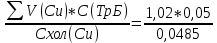 =1,05 мл =1,05 млПогрешность: r= 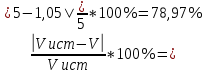 При построении кривых элюирования мы видим высокую селективность, но плохую эффективность. Мы наблюдаем на кривой с C=2М плохое разделение. Используя соляную кислоту 2М ионы цинка и меди выходят быстрее, чем при 1М, так как чем больше концентрация, тем больше ионов хлора присутствует в растворе, тогда комплексных анионов образуется большее количество, которые не сорбируются на катионите, поэтому ионы металлов выходят из колонки с большей скоростью. В дальнейшем используем соляную кислоту C=1М. Часть III. Разделение и определение меди и цинка при их совместном присутствии Элюирование первого и второго компонентов проводим в соответствии с ранее выбранными условиями. Элюат собираем в мерную колбу подходящего объема, для дальнейшего количественного определения методом комплексонометрии. Рассчитываем результаты анализа: содержание меди и цинка в анализируемом растворе в граммах. Из предыдущих расчётов и опытов выбрали в качестве элюента раствор соляной кислоты с концентрацией 1М. При помощи мерных цилиндров (вместимость 100 и 50мл) набрали 130мл раствора из-под колонки. Внесли раствор в мерную колбу объёмом 200мл и довели водой до метки. После чего комлексонометрическим методом определили содержание ионов цинка в растворе, отобрав аликвоту 10мл. Провели титрование двух параллелей, используя ТрБ С=0,05. Объём ТрБ, пошедшего на титрование: 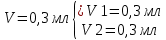 Объем цинка в растворе: V= 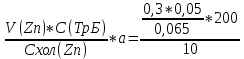 =4, 62 мл =4, 62 млМасса цинка в растворе: m=CТрБ*VТрБ*M*a=0,05*0,3*10-3* 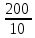 *65,39=0,0196г *65,39=0,0196гПогрешность: r= 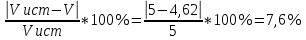 Вывод: В ходе работы мы разработали методику разделения и определения меди и цинка при их совместном присутствии методом ионообменной хроматографии, исходя из взаимодействия ионов цинка и меди (II) с соляной кислотой при различных её концентрациях и сорбента. Определили объём цинка в растворе задачи. Погрешность составила 7,6 %, при этом медь осталась в колонке. Таким образом, мы можем разделить медь и цинк путём метода хроматографии, используя в качестве сорбента катионит КУ-2-8. Однако разделить проблематично, так как комплексные соединения меди и цинка довольно близки по свойствам, поэтому скорости перемещения по колонке схожи, по расчётам можем наблюдать, что коэффициенты распределения во многих случаях почти идентичны. Вариантом решения проблемы может быть увеличение высоты хроматографического столба. |
