Ответы на вопросы. 1. Способы выражения концентрации растворов Массовая доля (w)
 Скачать 0.84 Mb. Скачать 0.84 Mb.
|
|
1. Способы выражения концентрации растворов 1. Массовая доля (w) - отношение массы компонента m(x) к массе раствора m(р-р) 2. Молярная концентрация (С(х)) - число молей растворенного вещества, содержащихся в одном литре раствора. Если один литр раствора содержит один моль растворенного вещества, то в таком растворе С(р.в.) = 1 моль/л n(x) m(x) С(х)=--------- =-------------------- моль/л V(p-p) M(x) ∙ V(p-p) 3. Молярная концентрация эквивалента (С(1/z х)) - число молей эквивалента растворенного вещества, содержащихся в одном литре раствора. Молярная масса эквивалента вещества М(1/z х) - отношение молярной массы его (М) к числу эквивалентности (z) M(1/z x) = M(х) / z где: n (1/zx)- количество вещества эквивалента, моль V(p-p) – объем раствора, л Чтобы определить молярную массу эквивалента кислоты, нужно ее молярную массу разделить на основность кислоты: M(1/z H2SO4)= M(H2SO4) / 2 = 98/2 = 49 г/моль Чтобы определить молярную массу эквивалента основания, нужно его молярную массу разделить на кислотность основания: M(1/zВа(OН)2)= M(Ва(OН)2) / 2 = 171/2 = 85,59 г/моль Чтобы определить молярную массу эквивалента соли, нужно ее молярную массу разделить на произведение валентности (степени окисления) металла на число ионов металла в молекуле: M(1/z Al2(SO4)3)= M(Al2(SO4)3) / 2 ∙ 3 = 342 / 6 = 57 г/моль 4. Моляльная концентрация (В(х)) – отношение количества вещества n(x) к массе растворителя m(p-pль) Электролиты. Классификация (примеры, диссоциация электролитов) Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения ионов. 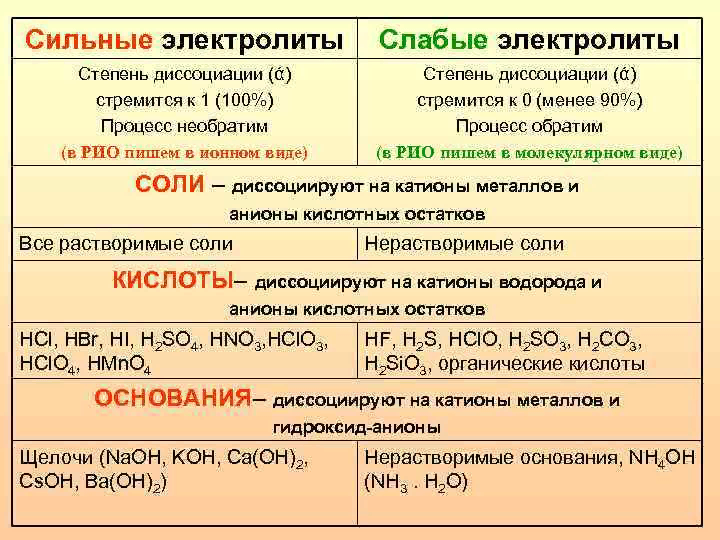  ТЭД Аррениуса, определение кислот, оснований, солей по Аррениусу Сванте Аррениус разработал первую современную кислотно-основную теорию, которая, хоть и не лишена недостатков, но актуальна и по сей день. Согласно теории Аррениуса: · кислоты являются электролитами, которые диссоциируют с образованием ионов водорода, например: HCl→H++Cl- · основания - это электролиты, которые диссоциируют в растворах с отщеплением гидроксид-ионов (ОН-), например: NaOH→Na++OH- Поскольку, при смешивании водного раствора кислоты и основания получается нейтральный раствор, кислотно-основную реакцию Аррениус назвал реакцией нейтрализации.  Степень диссоциации? Какие факторы влияют на степень диссоциации? Степенью диссоциации αэлектролита называется доля его молекул, подвергшихся диссоциации, т.е. отношение числа, молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе. где: n – количество молекул электролита распавшихся на ионы; N – общее количество молекул электролита в растворе. Сила электролита определяется по величине степени его диссоциации и константы. В случае электролита АХ, диссоциирующего на ионы А+ и Х-, константа и степень диссоциации связаны соотношением (закон разбавления Оствальда): К = α2См/(1-α). Где: См- молярная концентрация электролита, моль/л. Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять, что 1-α≈1. Тогда выражение закона разбавления упрощается: К = α2См, откуда α = √К/См . При разбавлении раствора слабого электролита (т.е. при уменьшении концентрации электролита См) степень его диссоциации возрастает. Если в растворе электролита АХ степень его диссоциации равна α, то концентрации ионов А+ и Х- в растворе одинаковы и составляют: [А+] = [Х-] = αСм. Подставив сюда значение αиз предыдущего соотношения, находим: [А+] = [Х-] = См√К/См = √К∙См.  Константа диссоциации слабого электролита. Какие факторы влияют на константу диссоциации. При растворении в воде или других растворителях, состоящих из полярных молекул, электролиты подвергаются электролитической диссоциации, т.е. распадаются на положительно и отрицательно заряженные ионы - катионы и анионы. Слабыми называют электролиты, диссоциирующие в растворах не полностью. В их растворах устанавливается равновесие между недиссоциированными молекулами и про-дуктами их диссоциации - ионами. Например, в водном растворе уксусной кислоты устанавливается равновесие СН3СООН ↔ Н++СН3СОО-, константа которого(константа диссоциации)связана с концентра-циями соответствующих частиц соотношением: [Н+][СН3СОО-] К= -------------------- [СН3СООН] Константа диссоциации показывает отношение произведения концентраций ионов к концентрации молекул слабого электролита в растворе. Величина Кдис электролита зависит от природы электролита и растворителя, температуры, но не зависит от концентрации раствора |
