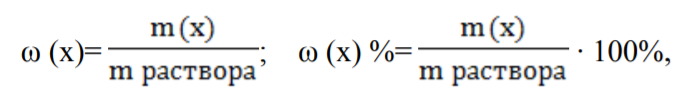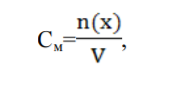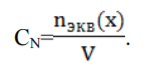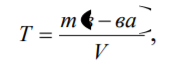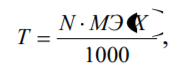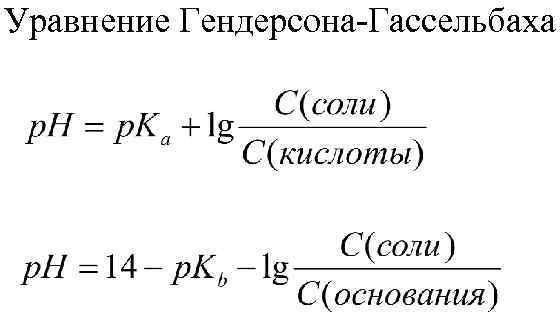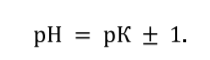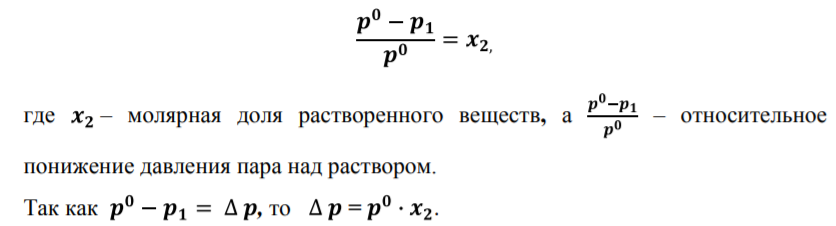|
|
растворы. Способы выражения концентрации растворов массовая доля вещества в растворе
Способы выражения концентрации растворов: массовая доля вещества в растворе, молярная концентрация, нормальная концентрация, титр. Массовая доля (ω) - отношение массы соответствующего компонента в растворе m(x) к общей массе этого раствора. 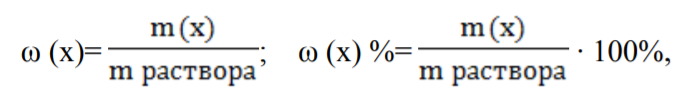 Выражается в единицах или процентах. ω (х)= ; ω (х) %= ∙ 100%, где m раствора = m растворенного вещества + m растворителя; Согласно формуле ρ= m/V, где ρ- плотность раствора, m-масса, V объем, тогда m раствора = V раствора∙ ρ. Молярная концентрация (См) - отношение количества растворенного вещества к объему раствора. Численно (См) равна количеству молей растворенного вещества, содержащегося в 1 л. раствора). Выражается она в моль/л. Сокращенно пишут М. Например, 2М (NaOH). 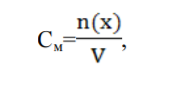 Молярная концентрация эквивалента (Нормальная концентрация СN или Н)- количество моль эквивалентов вещества, содержащегося в 1 л раствора. 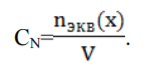 Единица измерения моль эквивалентов/л. Сокращенно обозначается буквой N. Если раствор 1Н раствор – в 1 л раствора содержится 1 эквивалент или 1 эквивалентная масса вещества; 0,1Н –О,1мольэквивалента растворенного вещества, раствор деценормальный.; Титрованная концентрация (титр) (Т)- масса растворенного вещества, содержащаяся в 1 мл раствора, выраженная в граммах. Определятся по формуле: 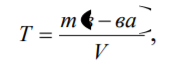 где m (в-ва) – масса вещества в г, V – объѐм раствора в мл. Так как в 1л 1000мл, то зная титр можно рассчитать N раствора и по молярной концентрации эквивалента определить титр: 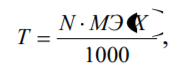 где N – нормальная концентрация, МЭ (Х) – моль-эквивалент вещества (частиц) Х.
Способы приготовления растворов (метод навески, метод разбавления, приготовление из фиксанала, метод смешивания).
1. Метод точной навески используют для приготовления растворов для веществ которые отвечают следующим требованиям: а) вещество должно быть химически чистым, не содержать примесей; б) строго отвечать химической формуле; в) быть устойчивым как в твердом виде, так и в растворе, не взаимодействовать с окружающей средой; г) иметь достаточно большую молекулярную массу. 2. Фиксанальный метод. Предполагает приготовление растворов из фиксаналов. Фиксанал – приготовленные с особой точностью ампула с сухим веществом или раствором с точно известной концентрацией. Фиксанал разбивают и переносят в колбу для растворения. Этот метод считается наиболее точным. 3. Метод приблизительной навески. Большинство растворов готовят методом примерной навески, т.к. они не отвечают необходимым требованиям, а точную концентрацию устанавливают физико-химическими методами или путем титрования. 4. Метод разбавления. Из раствора с точно известной концентрацией готовят разбавлением раствор другой концентрации. Концентрация полученного раствора зависит от концентрации исходного раствора. Какие растворы называются буферными растворами? Буферными растворами называются растворы, сохраняющие неизменными значения рН при разбавлении или добавлении небольшого количества сильной кислоты или основания Классификация буферных растворов. Примеры. Кислотные, т. е. состоящие из слабой кислоты и избытка сопряженного с ней основания (соли, образованной сильным основанием и анионом этой кислоты). Например: СН3СООН и СН3СООNa − ацетатный буфер Основные, т.е. состоящие из слабого основания и избытка сопряженной с ним кислоты (т.е. соли, образованной сильной кислотой и катионом этого основания). Например: NH4OH и NH4Cl – аммиачный буфер. Амфотерные буферные растворы. К ним относятся аминокислотные белковые буферные растворы. Уравнение для расчета рН буферных систем кислотного и основного типа (Гендерсона – Гассельбаха). Факторы, влияющие на значение рН буферных систем. 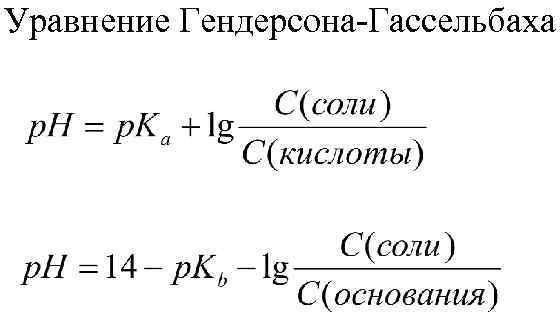 Константа диссоциации и соотношение компонентов Интервал буферного действия (определение и формула для расчета). Интервал значений рН, выше и ниже которого буферное действие прекращается, называется зоной буферного действия 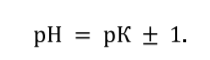
Буферная емкость (определение; формула для расчета; факторы, влияющие на значение буферной емкости).
Буферная емкость это способность буферной системы противодействовать изменению рН среды при добавлении определенных количеств сильной кислоты или сильного основания. Буферная емкость (В) выражается количеством моль эквивалентов сильной кислоты или щелочи, которое следует добавить к одному литру буфера, чтобы сместить рН на единицу.   Буферная емкость зависит от концентрации электролитов и соотношения компонентов буфера. Буферная емкость зависит от концентрации электролитов и соотношения компонентов буфера. Состав и механизм действия ацетатного буфера. Ацетатный буфер из уксусной кислоты и ацетата натрия
При добавлении к такому буферу кислоты, например, HCl,
ацетатионы будут связывать катионы Н+
, образуя слабую кислоту СН3СООН:
CH3COO ‾ +H +  CH3COOH CH3COOH
Если к этому буферному раствору добавить сильное основание,
например, NaOH, то молекулы уксусной кислоты будут реагировать с
гидроксид-ионами с образованием слабого электролита Н2О и СН3СОО ‾:
CH3COOН + OH ‾  CH3COO ‾ + H2O. CH3COO ‾ + H2O.
Состав и механизм действия аммиачного буфера.
Состав и механизм действия бикарбонатного буфера. Бикарбонатная буферная система несколько сложнее других буферных систем, состоящих из пары слабая кислота / сопряженное основание:
H2CO3  H+ + HCO3− H+ + HCO3−
Состав и механизм действия гемоглобинового буфера.
В составе гемоглобиновой буферной системы в качестве донора протона выступают две слабые кислоты: гемоглобин(HHb) и оксигемоглобин(HhbO2)
Механизм буферного действия этой сист. основан на след. р-ях: 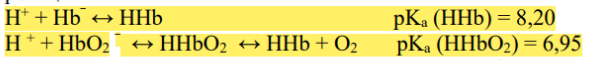 Состав и механизм действия фосфатного буфера. Фосфатный буфер состоит из гидрофосфатных и дигидрофосфатных анионов (HPO4(^2-) и H2PO4(^-))
Пример:
H(^+) + HPO4(^2-) <> H2PO4(^-)
OH(^-) + H2PO4(^2-) <> HPO4(^2-) + H2O
Состав и механизм действия белкового буфера.
Белковый буфер представляет систему из белка (протеин - Pt) и его соли. Компоненты буфера могут быть изображены как Pt-COOH - слабодиссоциированная белок-кислота и её соль Pt-COONa
Pt-COOH <> Pt-COO(^-) + H(^+)
Pt-COONa <> Pt-COO(^-) + Na(^+)
Кислотная буферная система:
NH3(^+)-R-COOH + OH(^-) <> H2N -R-COOH +H2O
H3N(^+)-R-COO(^-) + H(^+) <> H3N(^+)-R-COOH
Основная буферная система:
H2N-R-COO(^-) + H(^+) <> H3N(^+)-R-COOH
H3N(^+)-R-COO(^-) + OH(^-) <> H2N-R-COO(^-) + H2O
КОР (кислотно-основное равновесие организма). Основные показатели КОР. Соотношение определѐнной концентрации ионов Н+ и ОН в органах, тканях, жидкостях организма называется кислотно-основным равновесием (КОР)  
Диффузия (определение и примеры).
Диффузия – это самопроизвольный процесс выравнивания концентрации растворенного вещества в растворе, обусловленный переносом частиц растворенного вещества и растворителя.
Осмос (определение и примеры). Эндо- и экзосмос (определение и примеры).
осмос – это односторонняя диффузия растворителя через полупроницаемую перегородку в раствор какого-либо вещества.
Явление движения растворителя из окружающей среды в осмотическую ячейку называют эндосмосом.
экзосмос – это движение растворителя из осмотической ячейки в окружающую среду.
Осмотическое давление (закон Вант – Гоффа) – формулировка и математическое выражение.
Осмотическое давление разбавленного раствора неэлектролита равно тому давлению, которое производило бы растворѐнное вещество, если бы оно при той же температуре находилось в газообразном состоянии и занимало объѐм, равный объѐму раствора

Роль осмоса в биосистемах (тургор, плазмолиз, гемолиз, изотонические растворы, гипертонические растворы).
Я не шатаю хули они от меня хотят, напишу так:
Осмос регулирует поступление воды в клетки и межклеточные структуры.
Упругость клеток (тургор), эластичность тканей, сохранение определенной формы органов обусловлены осмотическим давлением.
В медицинской практике широко применяются изотонические (физиологические) и гипертонические растворы.
Помещая клетку в дистиллированную воду, наблюдается эндосмос (молекулы воды
проникают вовнутрь клетки), происходит набухание, а затем разрыв оболочки и вытекание клеточного содержимого. Это явление в случае эритроцитов называется гемолизом.
Человеческий организм характеризуется постоянством осмотического давления, колебания его незначительны. Поэтому при различных процедурах в кровь человека в больших
количествах можно вводить только изотонические растворы.
В хирургии применяют гипертонические растворы
Горькая соль и глауберова соль являются сильными слабительными средствами.
Почка – эффективный осмотический аппарат. Основная функция ее заключается в удалении продуктов обмена из крови
Одним из основных механизмов поступления минеральных веществ в эмаль зубов следует считать осмотическое давление
В концентрированных растворах солей отмечается сморщивание клеток – плазмолиз
Если у двух растворов осмотическое давление одинаковое, то эти растворы называются изотоническими и между ними происходит подлинно равновесный обмен молекулами растворителя

Давление пара разбавленных растворов неэлектролитов. Первый закон Рауля. Давление пара, содержащего нелетучее растворенное вещество, прямо пропорционально молярной(мольной) доле растворителя.  Первый закон Рауля формулируется следующим образом: Относительное понижение давления насыщенного пара растворителя над раствором, содержащим нелетучее растворенное вещество равно молярной доле растворенного вещества. 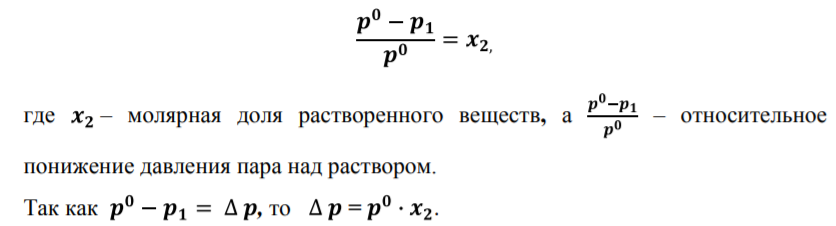
Температура кипения и замерзания растворов. Второй закон Рауля.
Температура кипения жидкости – это температура, при которой давление насыщенного пара над жидкостью равно внешнему давлению.
Любое чистое вещество, находящееся в жидком состоянии, характеризуется определѐнной температурой замерзания, при которой оно полностью отвердевает

где Е и К – коэффициенты пропорциональности, соответственно эбуллиоскопическая и криоскопическая константы, зависящие только от природы растворителя, а b – моляльность раствора |
|
|
 Скачать 0.91 Mb.
Скачать 0.91 Mb.