1714 биохимия. 10. Заполните таблицу Уровни структурной организации белков
 Скачать 0.57 Mb. Скачать 0.57 Mb.
|
|
10. Заполните таблицу: Уровни структурной организации белков
1. Что такое ферменты? Перечислите их основные свойства. Чем отличаются ферменты от химических катализаторов Ферменты – биологические катализаторы белковой природы. Все ферменты разделены на шесть классов, каждый из которых имеет строго определенный номер:
Название класса указывает на тип химической реакции, катализируемой ферментами. Следовательно, имеется шесть основных типов ферментативных реакций. По строению ферменты могут быть однокомпонентными, простыми белками, и двухкомпонентными, сложными белками. Во втором случае в составе фермента обнаруживается добавочная группа небелковой природы. Добавочную группу, прочно связанную, не отделяемую от белковой части, называют простетической группой; в отличие от этого добавочную группу, легко отделяющуюся от апофермента и способную к самостоятельному существованию, обычно именуют коферментом. Характерной особенностью двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам. Таким образом, хотя непосредственным исполнителем каталитической функции является простетическая группа, образующая каталитический центр, ее действие немыслимо без участия полипептидных фрагментов белковой части фермента. Более того, в апоферменте есть участок, характеризующийся специфической структурой, избирательно связывающий кофермент. Это так называемый кофермент связывающий домен; его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, очень сходна. Таковы, например, пространственные структуры нуклеотид связывающих доменов ряда дегидрогеназ. Иначе обстоит дело у однокомпонентных ферментов, не имеющих добавочной группы, которая могла бы входить в непосредственный контакт с преобразуемым соединением. Эту функцию выполняет часть белковой молекулы, называемая каталитическим центром. Предполагают, что каталитический центр однокомпонентного фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, располагающихся в определенной части белковой молекулы. Чаще всего в каталитических центрах однокомпонентных ферментов встречаются остатки сер, гис, три, арг, цис, асп, глу и тир. Радикалы перечисленных аминокислот выполняют здесь ту же функцию, что и кофермент в составе двухкомпонентного фермента. Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных точках единой полипептидной цепи. Поэтому каталитический центр возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру. Следовательно, изменение третичной структуры фермента под влиянием тех или иных факторов может привести к деформации каталитического центра и изменению ферментативной активности. Кроме каталитического центра, образованного сочетанием аминокислотных радикалов или присоединением кофермента, у ферментов различают еще два центра: субстратный и аллостерический. Под субстратным центром понимают участок молекулы фермента, ответственный за присоединение вещества (субстрата), подвергающегося ферментативному превращению. Часто этот участок называют “якорной площадкой” фермента, где, как судно на якорь, становится субстрат. Во многих случаях прикрепление субстрата к ферменту идет за счет взаимодействия с α-аминогрулпой радикала лиз, расположенного в субстратном центре. Эту же роль может выполнять СООН-группа глу, а также НS-группа цис. Однако работы последних лет показали, что гораздо большее значение здесь имеют силы гидрофобных взаимодействий и водородные связи, возникающие между радикалами аминокислотных остатков субстратного центра фермента и соответствующими группировками в молекуле субстрата. Понятие о каталитическом и субстратном центре не следует абсолютизировать. В реальных ферментах субстратный центр может совпадать (или перекрываться) с каталитическим центром. Более того, каталитический центр может окончательно формироваться в момент присоединения субстрата. Поэтому часто говорят об активном центре фермента, представляющем сочетание первого и второго. Активный центр у ферментов располагается на две щели при двухъядерной структуре, например у лизоцима и рибонуклеазы, или на дне глубокой впадины, как у химотрипсиногена. Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому определенного низкомолекулярного (а иногда - и высокомолекулярного) вещества изменяется третичная структура белковой молекулы. Вследствие этого изменяется конфигурация активного центра, сопровождающаяся либо увеличением, либо снижением каталитической активности фермента. Это явление лежит в основе так называемой аллостерической регуляции каталитической активности ферментов. Общие свойства катализаторов 1. Катализаторы сами не вызывают химическую реакцию, а только ускоряют реакцию, которая протекает и без них. 2. Не влияют на энергетический итог реакции. 3. В обратимых реакциях катализаторы ускоряют как прямую, так и обратную реакцию, причем в одинаковой степени, из чего следует, что катализаторы: - не влияют на направленность обратимой реакции, которая определяется только соотношением концентраций исходных веществ (субстратов) и конечных продуктов; - не влияют на положение равновесия обратимой реакции, а только ускоряют его достижение. Особенности ферментов как биологических катализаторов Ферменты обладают всеми общими свойствами обычных катализаторов. Но, по сравнению с обычными катализаторами, все ферменты являются белками. Поэтому они обладают особенностями, отличающими их от обычных катализаторов. Эти особенности ферментов, как биологических катализаторов, иногда называют общими свойствами ферментов. К ним относится следующее.
12. Приведите структуру витамина В1, его активной формы (ТПФ). Каковы его биологическая роль, распрастранение в природе, суточная потребность, а также причины и проявления авитаминоза? Приведите химизм реакций с указанием ферментов в которых В1 принимает участие как кофермент Витамин В1 (тиамин; антиневритный), как отмечалось, был первым кристаллическим витамином, выделенным К. Функом в 1912 г. Позже был осуществлен его химический синтез. Наряду с аминогруппой витамин B1 содержит атомы серы, поэтому он был назван тиамином. В химической структуре его содержатся два кольца – пиримидиновое и тиазоловое, соединенных метиленовой связью. Обе кольцевые системы синтезируются отдельно в виде фосфорилированных форм, затем объединяются через четвертичный атом азота. 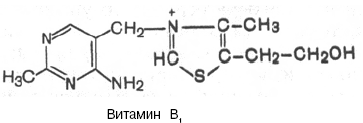 Тиамин хорошо растворим в воде. Водные растворы тиамина в кислой среде выдерживают нагревание до высоких температур без снижения биологической активности. В нейтральной и особенно в щелочной среде витамин B1, наоборот, быстро разрушается при нагревании. Этим объясняется частичное или даже полное разрушение тиамина при кулинарной обработке пищи, например выпечке теста с добавлением гидрокарбоната натрия или карбоната аммония. При окислении тиамина образуется тиохром, дающий синюю флюоресценцию при УФ-облучении. На этом свойстве тиамина основано его количественное определение. Витамин B1 легко всасывается в кишечнике, но не накапливается в тканях и не обладает токсическими свойствами. Избыток пищевого тиамина быстро выводится с мочой. В превращении витамина B1 в его активную форму – тиаминпирофосфат (ТПФ), называемый также тиаминдифосфатом (ТДФ), участвует специфический АТФ-зависимый фермент тиаминпирофосфокиназа, содержащаяся главным образом в печени и ткани мозга. Опытами с меченным 32Р АТФ доказан перенос на тиамин целиком пирофосфатной группы в присутствии фермента. ТПФ имеет следующее строение:  Если витамин B1 поступает с пищей в виде ТПФ, то пирофосфатная группа отщепляется от него под действием кишечных пирофосфатаз. При отсутствии или недостаточности тиамина развивается тяжелое заболевание – бери-бери, широко распространенное в ряде стран Азии и Индокитая, где основным продуктом питания является рис. Следует отметить, что недостаточность витамина B1 встречается и в европейских странах, где она известна как симптом Вернике, проявляющийся в виде энцефалопатии, или синдром Вейса с преимущественным поражением сердечно-сосудистой системы. Специфические симптомы связаны с преимущественными нарушениями деятельности и сердечно-сосудистой, и нервной систем, а также пищеварительного тракта. В настоящее время пересматривается точка зрения, что бери-бери у человека является следствием недостаточности только витамина В1. Более вероятно, что это заболевание представляет собой комбинированный авитаминоз или полиавитаминоз, при котором организм испытывает недостаток также в рибофлавине, пиридоксине, витаминах РР, С и др. На животных и добровольцах получен экспериментальный авитаминоз Bl . В зависимости от преобладания тех или иных симптомов различают ряд клинических типов недостаточности, в частности полиневритную (сухую) форму бери-бери, при которой на первый план выступают нарушения в периферической нервной системе. При так называемой отечной форме бери-бери преимущественно поражается сердечно-сосудистая система, хотя отмечаются также явления полиневрита. Наконец, выделяют остро протекающую кардиальную форму болезни, называемую пернициозной, которая приводит к летальному исходу в результате развития острой сердечной недостаточности. В связи с внедрением в медицинскую практику кристаллического препарата тиамина летальность резко сократилась и наметились рациональные пути лечения и профилактики этого заболевания. К наиболее ранним симптомам авитаминоза В1 относятся нарушения моторной и секреторной функций пищеварительного тракта: потеря аппетита, замедление перистальтики (атония) кишечника, а также изменения психики, заключающиеся в потере памяти на недавние события, склонности к галлюцинациям; отмечаются изменения деятельности сердечно-сосудистой системы: одышка, сердцебиение, боли в области сердца. При дальнейшем развитии авитаминоза выявляются симптомы поражения периферической нервной системы (дегенеративные изменения нервных окончаний и проводящих пучков), выражающиеся в расстройстве чувствительности, ощущении покалывания, онемения и болей по ходу нервов. Эти поражения завершаются контрактурами, атрофией и параличами нижних, а затем и верхних конечностей. В этот же период развиваются явления сердечной недостаточности (учащение ритма, сверлящие боли в области сердца). Биохимические нарушения при авитаминозе В1 проявляются развитием отрицательного азотистого баланса, выделением в повышенных количествах с мочой аминокислот и креатина, накоплением в крови и тканях α-кетокислот, а также пентозосахаров. Содержание тиамина и ТПФ в сердечной мышце и печени у больных бери-бери в 5-6 раз ниже нормы. Экспериментально доказано, что витамин B1 в форме ТПФ является составной часть минимум 5 ферментов, участвующих в промежуточном обмене веществ. ТПФ входит в состав двух сложных ферментных систем – пируват- и α-кетоглутаратдегидрогеназных комплексов, катализирующих окислительное декарбоксилирование пировиноградной и α-кетоглутаровой кислот. 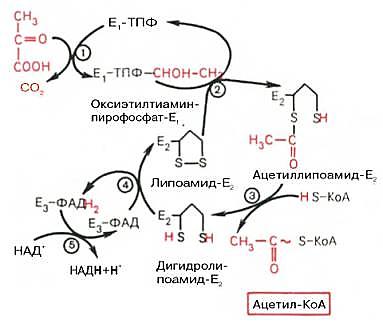 Рис. 1. Механизм действия пируватдегидрогеназного комплекса. Е1- пируватдегидрогеназа; Е2 - ди-гидролипоилацетилтрансфсраза; Е3-дигидролипоилдегидрогеназа; цифры в кружках обозначают стадии процесса. В составе транскетолазы ТПФ участвует в переносе гликоальдегидного радикала от кетосахаров на альдосахара. ТПФ является коферментом пируватдекарбоксилазы клеток дрожжей (при алкогольной ферментации) и дегидрогеназы γ-оксикетоглутаровой кислоты.  Приведенными примерами, вероятнее всего, не ограничиваются биологические функции тиамина. В частности, ТПФ участвует в окислительном декарбоксилировании глиоксиловой кислоты и α-кетокислот, образующихся при распаде аминокислот с разветвленной боковой цепью; в растениях ТПФ является эссенциальным кофактором при синтезе валина и лейцина в составе фермента ацетолактатсинтетазы. Витамин В1 широко распространен в природе. Основное количество его человек получает с растительной пищей. Много витамина B1 содержится в дрожжах, пшеничном хлебе из муки грубого помола, оболочке и зародышах семян хлебных злаков, сое, фасоли, горохе, меньше – в картофеле, моркови, капусте. Из продуктов животного происхождения наиболее богаты витамином B1 печень, почки, мозг. Некоторые бактерии, населяющие кишечник животных, способны синтезировать достаточное количество тиамина: например, количества витамина В1, синтезированного микрофлорой кишечника коров, оказывается вполне достаточно для покрытия потребностей организма. Рекомендуемые Институтом питания РАМН нормы суточного потребления тиамина для отдельных групп населения составляют от 1,2 до 2,2 мг. 3. Какие общие закономерности в суммарном нуклеотидном составе всех типов ДНК установил Е. Чаргафф? Что такое коэффициент специфичности ДНК? Изучая химический состав ДНК в 1950 году, Эрвин Чаргафф (сформулировал важные положения относительно структуры ДНК:
8. Поясните такие свойства мембран как текучесть, динамичность и ассиметрия Мембраны — это пленки толщиной 5-7 нм, состоящие из липидов и белков. Относительное количество белков и липидов в составе разных мембран варьирует: иногда преобладают липиды, иногда большую часть массы мембраны составляют белки. В некоторых мембранах белки и липиды содержатся поровну. Липиды располагаются в два слоя. Гидрофильные "головки" молекул обращены наружу, а гидрофобные "хвосты" — внутрь мембраны. Способность липидов в водных растворах самопроизвольно объединяться подобным образом обеспечивает замкнутость мембран. Другими словами, мембраны всегда существуют в виде пузырьков. Если сделать иголкой "дырку" в мембране, то при удалении иголки липиды сомкнутся, т.е. они обеспечивают целостность мембраны. 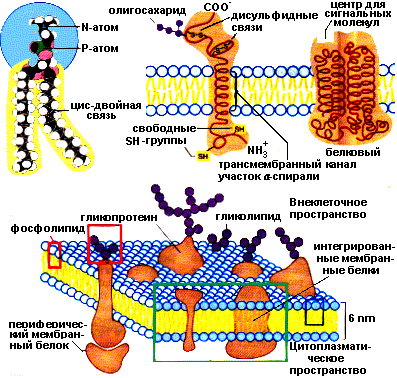 Рис.2. Структура плазматической мембраны Асимметрия мембран Хотя каждый монослой образован из липидов, ориентированных одинаковым образом, тем не менее, липидный состав монослоев различен. Например, в плазматической мембране эритроцитов фосфатидилхолины преобладают в наружном слое, а фосфатидилсерины во внутреннем слое мембраны. Углеводные части белков и липидов располагаются на наружной части мембраны. Кроме того, поверхности мембраны отличаются по составу белков. Степень такой асимметрии мембран различна у разных типов мембран и может меняться в процессе жизнедеятельности клетки и ее старения. Подвижность (жесткость) и текучесть мембран также зависят от ее состава. Повышенная жесткость обуславливается увеличением соотношения насыщенных и ненасыщенных жирных кислот, а также холестерина. Физические свойства мембран зависят от расположения белков в липидном слое. Липиды мембран способны к диффузии в пределах слоя параллельно поверхности мембраны (латеральная диффузия). Белки тоже способны к латеральной диффузии. Поперечная диффузия в мембранах сильно ограничена. Динамичность и текучесть мембран Мембраны по своей консистенции похожи на растительное масло. В такой среде (больше жидкой, чем твердой) молекулы могут достаточно свободно перемещаться. Способность молекул в составе мембраны к перемещению получила название текучести мембран. Было показано, что молекулы липидов перемещаются вдоль слоя очень часто. Наоборот, перемещение из одного слоя в другой — редчайшее событие. Поэтому состав липидов в слоях мембраны, как правило, различен. Что касается белков, то они также могут "плыть" вдоль мембраны, но перемещаться с одной стороны на другую или переворачиваться относительно липидного бислоя они не могут. Строгая организованность липидного слоя мембраны не лишает его большой динамичности, которая возникает из-за передвижения липидных молекул в пределах мембраны, т.е. за счет интрамолекулярных движений липидов в пределах бислоя. Известно по крайней мере четыре типа интрамолекулярных движений липидов в пределах мембраны: латеральная диффузия, вращательная диффузия, вертикальные колебания и флип-флоп. Мембраны могут быть и более жидкими (более текучими), и более твердыми (менее текучими). Текучесть мембраны зависит от того, какие липиды входят в состав мембраны и какие жирные кислоты входят в состав липидов. При повышении температуры подвижность липидов в бислое увеличивается, связи между молекулами ослабевают, текучесть мембраны увеличивается. При понижении температуры подвижность липидов уменьшается, а их гидрофобные хвосты образуют жесткую структуру, при этом текучесть мембраны уменьшается. Необходимо, чтобы мембрана обладала определенной степенью текучести, при которой молекулы белков способны менять свою конформацию так, как это нужно для их нормального функционирования. Чем меньше текучесть мембраны, тем труднее белкам изменять свою форму при химическом взаимодействии, а это может привести к замедлению скорости химической реакции, вплоть до полной ее остановки. Таким образом, функция липидов заключается не только в том, что они поддерживают целостность мембран, но и в регуляции работы встроенных в мембрану белков. Было показано, что растения и микроорганизмы при изменении внешних условий (например, температуры) меняют соотношение насыщенных и ненасыщенных жирных кислот в составе фосфолипидов мембран и таким образом регулируют ее текучесть. У животных текучесть мембраны может уменьшать холостерол. 20. Опишите механизм световой стадии фотосинтеза. Приведите Z-схему фотосинтетического переноса электронов в мембране тилакоидов. Световая стадия – это процесс использования света для расщепления воды; при этом выделяется кислород и образуются богатые энергией соединения. Под действием фотонов электрон хроматофора активируется, затем он возвращается в исходное состояние. При этом высвобождается энергия, используемая для создания протонного градиента, а затем синтеза АТФ и восстановления никотинамидадениндинуклеотидфосфата (НАДФ) до НАДФН+. Последнее может происходить за счёт обратного транспорта электронов с затратой АТФ. Голландский микробиолог Ван Ниль, изучая особенности бактериального фотосинтеза и сравнивая его с фотосинтезом у растений, в 1937— 1941 гг. высказал предположение, что первичная фотохимическая реакция фотосинтеза состоит в диссоциации воды, а не в разложении СО2, как предполагалось ранее. В соответствии с этим уравнение фотосинтеза по Ван Нилю можно представить в следующем виде: 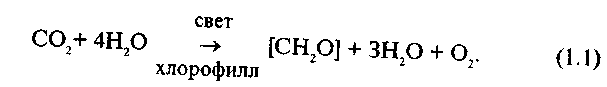 Эта суммарная реакция уравнения слагается из трех этапов: Так как весь кислород фотосинтеза выделяется из воды, общее уравнение фотосинтеза имеет следующий вид: Из уравнений следует, что фотосинтез представляет собой окислительно-восстановительный процесс, в котором вода окисляется до О2, а углекислый газ восстанавливается до углеводов. Сущность происходящих реакций фотосинтеза на свету была выяснена в 50-х годах американским физиологом и биохимиком растений Д.И. Арноном. Им было высказано предположение о том, что в процессе фотосинтеза происходит не фотолиз воды (разрыв молекулы Н-О-Н на два радикала Η и ОН), требующий большого количества энергии (110 ккал/моль), а фотоокисление, т.е. мобилизация электрона. Последующие работы показали, что система фотоокисления воды — сложный структурный и энзиматический комплекс, легко повреждаемый воздействием температур, ферментными ядами, физическими агентами, нарушающими нативные структуры хлоропласта (детергенты, рН, ультрафиолет и др.). В других опытах было показано, что выделенные из листьев шпината хлоропласты под действием света способны восстанавливать НАДФ и фосфорилировать АДФ. Эти процессы протекают в тилакоидах хлоропластов. Полученный из стромы хлоропластов гомогенат, лишенный мембран, ассимилировал СО2, если в реакционной среде присутствовали НАДФ.Η и АТФ:  В этих опытах было открыто явление фотофосфорилирования и показано, что НАДФ.Н и АТФ — конечные продукты световой фазы фотосинтеза, а также установлено протекание световой фазы в тилакоидах хлоропласта, а темновой — в его строме. Различают циклическое и нециклическое фотофосфорилирование, соответственно двум типам потока электронов. При циклическом потоке электроны, переданные от молекулы хлорофилла первичному акцептору, возвращаются к ней обратно, а при нециклическом — происходит фотоокисление воды и передача электрона от воды к НАДФ. Энергия, выделяемая в ходе этой окислительно-восстановительной реакции, частично используется на синтез АТФ. Оба типа фотофосфорилирования принято включать в световую фазу фотосинтеза, однако свет необходим только на первых этапах этих процессов (перенос электрона по цепи переносчиков может происходить в темноте). В зависимости от состояния хлоропластов расположение и набор переносчиков в электрон-транспортной цепи (ЭТЦ) могут меняться. 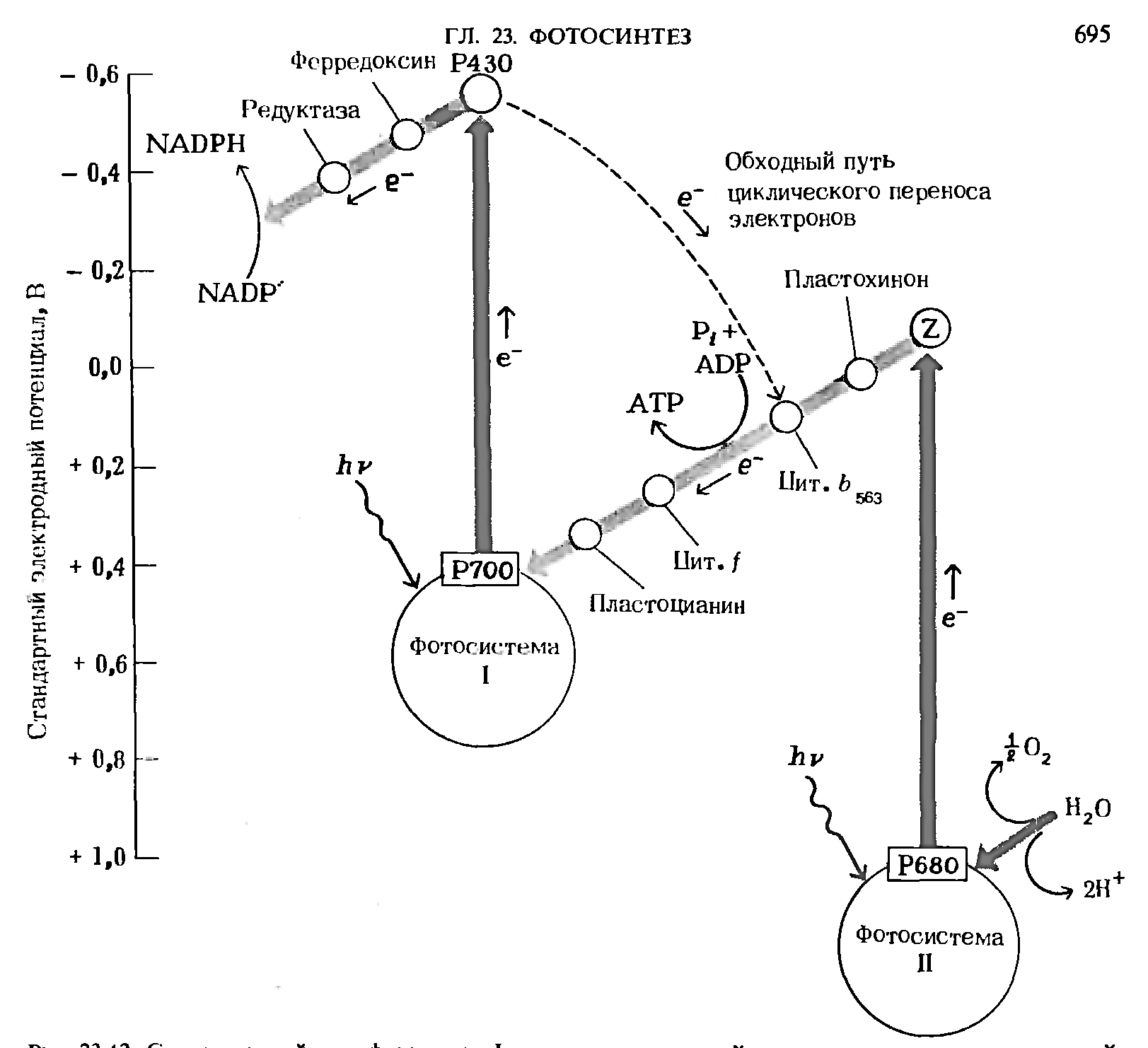 Рис. 3. Совместное действие фотосистем I и II. Z-схема фотосинтетического переноса электронов в мембране тилакоидов На рис. 3 представлен не только путь электронов, переходящих от Н2О к NADP +, но и энергетические взаимоотношения. Вертикальная ось этой диаграммы соответствует энергетической шкале. Процессы, при которых электроны переносятся «вверх», требуют затраты световой энергии, а процессы, при которых электроны движутся «вниз», сопровождаются уменьшением свободной энергии. При поглощении кванта света фотосистемой I один из ее электронов переходит из состояния с относительно низкой энергией в состояние, богатое энергией, вследствие чего фотохимический реакционный центр фотосистемы I, находящийся теперь в возбужденном состоянии, становится очень мошным восстановителем, так что электроны движутся от него «вниз» к NADP + и восстанавливают его в NADPH. Высокоэнергетические электроны, движущиеся от фотосистемы II к фотосистеме I, также получили энергию от квантов света, но от тех, которые были поглощены фотосистемой И. Дырки в фотосистеме И, ставшей теперь очень мощным окислителем (акцептором электронов), заполняются электронами, которые движутся «вниз» от Н2О. Z-схема, следовательно, показывает тот путь, по которому электроны переходят от Н2О к NADP + , восстанавливая его в NADPH, т.е. путь от большого положительного стандартного потенциала (+ 0,82 В) к большому отрицательному (— 0,32 В). Свободную энергию, необходимую для переноса одного электрона от Н20 к NADP +, поставляют два поглощенных кванта света; один из них поглощается фотосистемой I, а другой-фотосистемой II. Прерывистая черная стрелка между Р430 и цитохромом bуказывает альтернативный, или обходный, путь, которым следуют электроны в циклическом потоке электронов и фосфорилированин. В циклиxеском потоке электронов участвует только фотосистема I; электроны возвращаются по обходному пути к фотосистеме I вместо того, чтобы восстанавливать NАDР+ в NАDРН Список литературы:
|
